| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 98. Примеры диаграмм состояния
В этом параграфе мы перечислим основные типы кривых равновесия; в отличие от предыдущего параграфа мы будем рассматривать теперь их вид не только вблизи особых точек, но и целиком. Эти кривые (называемые также диаграммами состояния) могут иметь весьма разнообразную форму, в большинстве же случаев, однако, она подходит под один из приведенных ниже типов, или же является комбинацией нескольких из них. Заштрихованные области на всех этих диаграммах всегда являются областями разделения на фазы, а незаштрихованные — областями однородных состояний.
Точки пересечения горизонтальных линий с кривыми, ограничивающими области разделения на фазы, определяют состав фаз, на которые (при данных Р и Т) происходит разделение. Относительные количества обеих фаз определяются при этом тем же «правилом рычага», о котором упоминалось в § 81.
Ниже мы говорим для определенности о диаграммах  такие же типы диаграмм возможны и в координатах
такие же типы диаграмм возможны и в координатах  Концентрация
Концентрация  откладывается вдоль оси абсцисс и меняется в пределах от 0 до 1.
откладывается вдоль оси абсцисс и меняется в пределах от 0 до 1.
1. Имеются две фазы; каждая из них может обладать любой концентрацией (т. е. обе компоненты в обеих фазах смешиваются в произвольных отношениях). В простейшем случае, когда кривые не имеют никаких максимумов или минимумов (кроме точек чистого вещества), диаграмма состояния имеет вид, изображенный на рис: 31 (так называемая сигара).

Рис. 31.
Пусть одной из фаз является жидкость (область под сигарой), а другой — пар (область над сигарой);  верхняя кривая сигары называется в этом случае кривой конденсации, а нижняя — кривой точек кипения.
верхняя кривая сигары называется в этом случае кривой конденсации, а нижняя — кривой точек кипения.
Если нагревать жидкую смесь определенного состава, то при температуре, определяющейся пересечением вертикальной прямой AD (соответствующей данной концентрации) с нижней кривой сигары (точка В), жидкость начнет кипеть. При этом выкипает пар, состав которого определяется точкой С, т. е. обладает меньшей концентрацией, чем жидкость. Концентрация остающейся жидкости будет, очевидно, повышаться, а соответственно будет повышаться ее точка кипения. При дальнейшем нагревании точка, изображающая состояние жидкой фазы, будет передвигаться вверх по нижней кривой, а точка, изображающая выкипающий пар, — вверх по верхней кривой. Кипение закончится при различных температурах в зависимости от того, каким образом происходит процесс. Если кипение происходит в закрытом сосуде, так что весь выкипающий пар остается все время в соприкосновении с жидкостью, то, очевидно, жидкость целиком выкипит при температуре, при которой пар имеет концентрацию, равную первоначальной концентрации жидкости (точка D). Таким образом, в этом случае начало и конец кипения происходят при температурах, определяемых пересечением вертикальной прямой  с нижней и с верхней кривой сигары.
с нижней и с верхней кривой сигары.
Если же выкипающий пар все время удаляется (кипение в открытом сосуде), то в равновесии с жидкостью в каждый момент находится лишь только что выкипевший пар. Очевидно, что в этом случае кипение закончится в точке G кипения чистого вещества, в которой состав жидкости и пара одинаков. Подобным же образом происходит конденсация пара в жидкость.
Совершенно аналогичное положение имеет место в случае, когда двумя фазами являются жидкость (область над сигарой), и твердое тело (область под сигарой).

Рис. 32.

Рис. 33.

Рис. 34.
2. Обе компоненты смешиваются в обеих фазах в произвольных отношениях (как и в предыдущем случае), но имеется точка равных концентраций. При этом диаграмма состояния имеет вид, изображенный на рис. 32 (или аналогичный с минимумом). В точке равных концентраций обе кривые имеют максимум или минимум и касаются друг друга.
Переход из одной фазы в другую происходит подобно тому, как было описано в предыдущем случае, с той лишь разницей, что процесс может закончиться (если одна из фаз все время удаляется например, при кипении жидкости в открытом сосуде) не только в точке чистого вещества, но и в точке равных концентраций. При составе, соответствующем самой этой точке, переход совершается целиком при одной температуре.
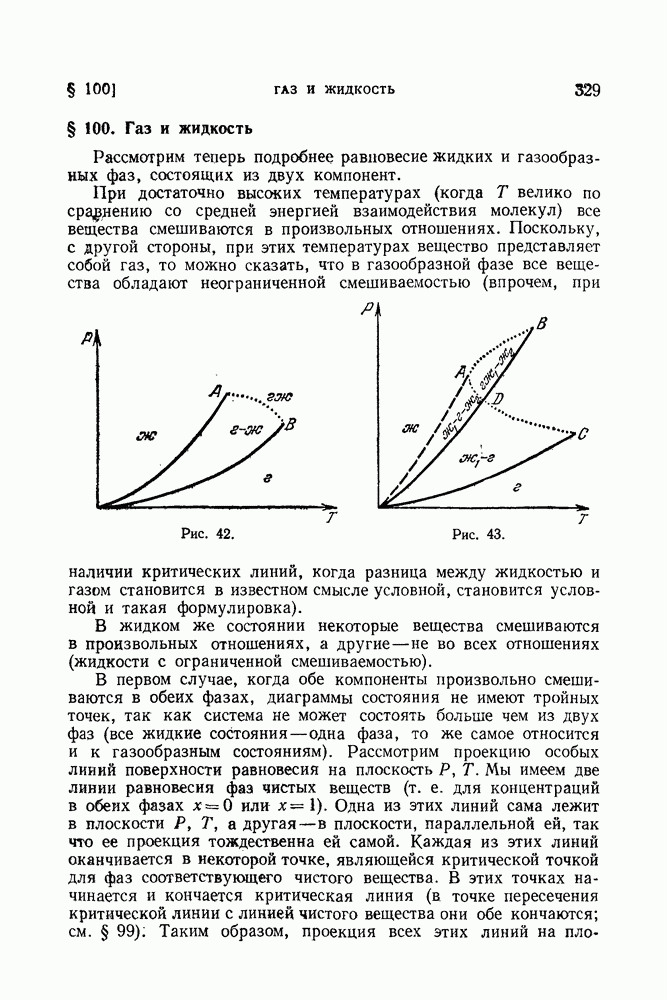
3. Имеются две фазы — жидкость и газ, в которых обе компоненты произвольно смешиваются, причем имеется критическая точка. Диаграмма состояния изображена на рис. 33 (К — критическая точка). Область справа от кривой соответствует жидким состояниям, а область слева — газообразным. Следует, однако, помнить, что при наличии критической точки можно, строго говоря, различать жидкую и газообразную фазы лишь тогда, когда обе находятся одновременно в равновесии друг с другом.
Диаграмма рассматриваемого типа приводит к следующему своеобразному явлению. Если нагревать в закрытом сосуде жидкость, состав которой изображается прямой АС (проходящей справа от точки К), то после начала кипения (в точке В) по мере дальнейшего нагревания количество пара будет постепенно возрастать, но, начиная с некоторого момента, начнет снова уменьшаться, пока пар не исчезнет вовсе в точке С (так называемая ретроградная конденсация).
4. Две жидкости смешиваются не во всех отношениях. Диаграмма состояния изображена на рис. 34. При температурах выше температуры критической точки К компоненты смешиваются в произвольных отношениях. Ниже этой температуры компоненты не смешиваются в тех отношениях, которые изображаются точками внутри заштрихованной области. В этой области происходит расслоение на две жидкие смеси, концентрации которых определяются точками пересечения соответствующей горизонтальной прямой с кривой равновесия. Возможны аналогичные диаграммы, где точка К является точкой минимума, а также такие, где имеются две критические точки: верхняя и нижняя, так что область расслоения на две фазы (два раствора) ограничена замкнутой кривой.
5. В жидком (или газообразном) состоянии обе компоненты смешиваются в произвольных отношениях. В твердом же (или жидком) — не во всех отношениях (ограниченная смешиваемость). В этом случае существует тройная точка. Смотря по тому, лежит ли температура тройной точки ниже температур равновесия фаз чистых компонент (точки А и С) или между ними (она не может, очевидно, лежать выше них при сделанном нами предположении, что в более высокой фазе компоненты произвольно смешиваются), диаграммы состояния имеют такой вид, как изображено соответственно на рис. 35 и 36. Пусть, например, фаза с неограниченной смешиваемостью является жидкостью, а с ограниченной смешиваемостью — твердым телом. Область над кривой ABC (рис. 35) или ADC (рис. 36) есть область жидких состояний; области по сторонам от ADF и CEG (рис. 35) или ABF и CEG (рис. 36) - области однородных твердых фаз (твердых растворов). В тройной точке (температура которой определяется прямой DBE) находятся в равновесии жидкость и два твердых раствора с разными концентрациями. Точка В на рис. 35 называется эвтектической точкой. Жидкая смесь, обладающая концентрацией, соответствующей этой точке, замерзает целиком при этой же концентрации (в то время как при других концентрациях вымерзает твердая смесь с концентрацией, отличной от концентрации жидкости).
Области ADB и СВЕ (рис. 35) и области ADB и GDE (рис. 36) соответствуют разделению на жидкую и одну из твердых фаз; области DEGF (рис. 35) и BEGF (рис. 36) — разделению на две твердые фазы.
Если в случае диаграммы типа рис. 35 в твердом состоянии компоненты совсем не смешиваются, то диаграмма состояния приобретает вид, изображенный на рис. 37. В заштрихованных областях выше прямой АБС находятся в равновесии смешанная жидкая фаза с твердой фазой одного из чистых веществ, а под АБС — твердые фазы обоих чистых веществ. При понижении температуры жидкой смеси из нее вымерзает одно или другое чистое вещество, смотря по тому, лежит ли концентрация жидкости справа или слева от эвтектической точки.

Рис. 35.

Рис. 36.

Рис. 37.
По мере дальнейшего понижения температуры состав жидкости изменяется по кривой DB или ЕВ, и жидкость замерзает целиком в эвтектической точке В.
6. В жидком состоянии обе компоненты смешиваются в произвольных отношениях. В твердом же состоянии компоненты не смешиваются вовсе, но образуют химическое соединение определенного состава. Диаграмма состояния изображена на рис. 38. Прямая DE определяет состав химического соединения. Имеются две тройные точки В и G, в которых находятся в равновесии жидкая фаза, твердое химическое соединение и твердая фаза одной из чистых компонент. Между точками В и G находится точка равных концентраций D (ср. рис. 29). Легко видеть, где и на какие фазы происходит разделение: в области DBE — на жидкую фазу и твердое химическое соединение, под прямой СВЕ — на химическое соединение и одно из твердых чистых веществ, и т. д. Замерзание жидкости оканчивается в одной из эвтектических точек G или В, смотря по тому, лежит ли концентрация жидкости справа или слева от прямой DE.
7. В жидком состоянии обе компоненты смешиваются в произвольных отношениях, а в твердом не смешиваются вовсе, но образуют химическое соединение, разлагающееся, однако, при некоторой температуре — раньше, чем наступит плавление.
Прямая, определяющая состав этого соединения, не может окончиться, как в предыдущем случае, в точке равных концентраций, так как не доходит до точки плавления. Поэтому она может окончиться в тройной точке типа, изображенного на рис. 30 в § 97 (точка А на рис. 39). На рис. 39, изображающем возможный вид диаграммы состояния для этого случая, легко видеть, на какие фазы происходит разделение в различных точках заштрихованной области.
8. В твердом состоянии компоненты вовсе не смешиваются, а в жидком — не во всех отношениях.

Рис. 38.

Рис. 39.

Рис. 40.
В этом случае имеются две тройные точки, в которых находятся в равновесии жидкость с двумя твердыми чистыми веществами (точка В на рис. 40) и одно из чистых веществ с двумя смешанными жидкими фазами различных концентраций (точка D). Незаштрихованные области над ABC и над DE изображают жидкие состояния с различными концентрациями; заштрихованная область над CD — область разделения на две жидкие фазы; область DEF — разделение на жидкость и одно из чистых твердых веществ, и т. д.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- НЕКОТОРЫЕ ОБОЗНАЧЕНИЯ
- ГЛАВА I. ОСНОВНЫЕ ПРИНЦИПЫ СТАТИСТИКИ
- § 1. Статистическое распределение
- § 2. Статистическая независимость
- § 3. Теорема Лиувилля
- § 4. Роль энергии
- § 5. Статистическая матрица
- § 6. Статистическое распределение в квантовой статистике
- § 7. Энтропия
- § 8. Закон возрастания энтропии
- ГЛАВА II. ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
- § 9. Температура
- § 10. Макроскопическое движение
- § 11. Адиабатический процесс
- § 12. Давление
- § 13. Работа и количество тепла
- § 14. Тепловая функция
- § 15. Свободная энергия и термодинамический потенциал
- § 16. Соотношения между производными термодинамических величин
- § 17. Термодинамическая шкала температуры
- § 18. Процесс Джоуля — Томсона
- § 19. Максимальная работа
- § 20. Максимальная работа, производимая телом, находящимся во внешней среде
- § 21. Термодинамические неравенства
- § 22. Принцип Ле-Шателье
- § 23. Теорема Нериста
- § 24. Зависимость термодинамических величин от числа частиц
- § 25. Равновесие тела во внешнем поле
- § 26. Вращающиеся тела
- § 27. Термодинамические соотношения в релятивистской области
- ГЛАВА III. РАСПРЕДЕЛЕНИЕ ГИББСА
- § 28. Распределение Гиббса
- § 29. Распределение Максвелла
- Задачи
- § 30. Распределение вероятностей для осциллятора
- § 31. Свободная энергия в распределении Гиббса
- Задачи
- § 32. Термодинамическая теория возмущений
- § 33. Разложение по степеням h
- § 34. Распределение Гиббса для вращающихся тел
- § 35. Распределение Гиббса с переменным числом частиц
- § 36. Вывод термодинамических соотношений из распределения Гиббса
- ГЛАВА IV. ИДЕАЛЬНЫЙ ГАЗ
- § 37. Распределение Больцмана
- § 38. Распределение Больцмана в классической статистике
- Задачи
- § 39. Столкновения молекул
- Задачи
- § 40. Неравновесный идеальный газ
- § 41. Свободная энергия больцмановского идеального газа
- § 42. Уравнение состояния идеального газа
- Задачи
- § 43. Идеальный газ с постоянной теплоемкостью
- Задачи
- § 44. Закон равнораспределения
- § 43. Одноатомный идеальный газ
- § 46. Одноатомный газ. Влияние электронного момента
- § 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- § 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- § 49. Двухатомный газ. Колебания атомов
- § 50. Двухатомный газ. Влияние электронного момента
- § 51. Многоатомный газ
- § 52. Магнетизм газов
- Задачи
- ГЛАВА V. РАСПРЕДЕЛЕНИЯ ФЕРМИ И БОЗЕ
- § 53. Распределение Ферми
- § 54. Распределение Бозе
- § 55. Неравновесные ферми- и бозе-газы
- § 56. Ферми- и бозе-газы элементарных частиц
- § 57. Вырожденный электронный газ
- § 58. Теплоемкость вырожденного электронного газа
- § 60. Магнетизм электронного газа. Сильные поля
- § 61. Релятивистский вырожденный электронный газ
- Задачи
- § 62. Вырожденный бозе-газ
- Задача
- § 63. Черное излучение
- ГЛАВА VI. ТВЕРДЫЕ ТЕЛА
- § 64. Твердые тела при низких температурах
- § 65. Твердые тела при высоких температурах
- § 66. Интерполяционная формула Дебая
- § 67. Тепловое расширение твердых тел
- § 68. Сильно анизотропные кристаллы
- § 69. Колебания кристаллической решетки
- § 70. Плотность числа колебаний
- § 71. Фононы.
- § 72. Операторы рождения и уничтожения фононов
- § 73. Отрицательные температуры
- ГЛАВА VII. НЕИДЕАЛЬНЫЕ ГАЗЫ
- § 74. Отклонение газов от идеальности
- § 75. Разложение по степеням плотности
- § 76. Формула ван-дер-Ваальса
- § 77. Связь вириального коэффициента с амплитудой рассеяния
- § 78. Термодинамические величины классической плазмы
- § 79. Метод корреляционных функций
- § 80. Термодинамические величины вырожденной плазмы
- ГЛАВА VIII. РАВНОВЕСИЕ ФАЗ
- § 81. Условия равновесия фаз
- § 82. Формула Клапейрона — Клаузиуса
- § 83. Критическая точка
- § 84. Закон соответственных состояний
- ГЛАВА IX. РАСТВОРЫ
- § 85. Системы с различными частицами
- § 86. Правило фаз
- § 87. Слабые растворы
- § 88. Осмотическое давление
- § 89. Соприкосновение фаз растворителя
- § 90. Равновесие по отношению к растворенному веществу
- Задачи
- § 91. Выделение тепла и изменение объема при растворении
- § 92. Растворы сильных электролитов
- § 93. Смесь идеальных газов
- § 94. Смесь изотопов
- § 95. Давление пара над концентрированным раствором
- § 96. Термодинамические неравенства в растворах
- § 97. Кривые равновесия
- § 98. Примеры диаграмм состояния
- § 99. Пересечение особых кривых поверхности равновесия
- § 100. Газ и жидкость
- ГЛАВА X. ХИМИЧЕСКИЕ РЕАКЦИИ
- § 101. Условие химического равновесия
- § 102. Закон действующих масс
- Задачи
- § 103. Теплота реакции
- § 104. Ионизационное равновесие
- § 105. Равновесие по отношению к образованию пар
- ГЛАВА XI. СВОЙСТВА ВЕЩЕСТВА ПРИ ОЧЕНЬ БОЛЬШИХ ПЛОТНОСТЯХ
- § 106. Уравнение состояния вещества при больших плотностях
- § 107. Равновесие тел с большой массой
- § 108. Энергия гравитирующего тела
- § 109. Равновесие нейтронной сферы
- ГЛАВА XII. ФЛУКТУАЦИИ
- § 110. Распределение Гаусса
- § 111. Распределение Гаусса для нескольких величин
- § 112. Флуктуации основных термодинамических величин
- Задачи
- § 113. Флуктуации в идеальном газе
- § 114. Формула Пуассона
- § 115. Флуктуации в растворах
- § 116. Пространственная корреляция флуктуаций плотности
- § 117. Корреляция флуктуаций плотности в вырожденном газе
- Задачи
- § 118. Корреляция флуктуаций во времени
- § 119. Временная корреляция флуктуаций нескольких величин
- § 120. Симметрия кинетических коэффициентов
- § 121. Диссипативная функция
- § 122. Спектральное разложение флуктуаций
- § 123. Обобщенная восприимчивость
- § 124. Флуктуационно-диссипационная теорема
- § 125. Флуктуационно-диссипационная теорема для нескольких величин
- § 126. Операторное выражение обобщенной восприимчивости
- § 127. Флуктуации изгиба длинных молекул
- ГЛАВА XIII. СИММЕТРИЯ КРИСТАЛЛОВ
- § 128. Элементы симметрии кристаллической решетки
- § 129. Решетка Бравэ
- § 130. Кристаллические системы
- § 131. Кристаллические классы
- § 132. Пространственные группы
- § 133. Обратная решетка
- § 134. Неприводимые представления пространственных групп
- § 135. Симметрия относительно обращения времени
- § 136. Свойства симметрии нормальных колебаний кристаллической решетки
- § 137. Структуры с одно- и двумерной периодичностью
- § 138. Корреляционная функция в двумерных системах
- § 139. Симметрия по ориентации молекул
- § 140. Нематические и холестерические жидкие кристаллы
- § 141. Флуктуации в жидких кристаллах
- ГЛАВА XIV. ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА И КРИТИЧЕСКИЕ ЯВЛЕНИЯ
- § 142. Фазовые переходы второго рода
- § 143. Скачок теплоемкости
- § 144. Влияние внешнего поля на фазовый переход
- § 145. Изменение симметрии при фазовом переходе второго рода
- § 146. Флуктуации параметра порядка
- § 147. Эффективный гамильтониан
- § 148. Критические индексы
- § 149. Масштабная инвариантность
- § 150. Изолированные и критические точки непрерывного перехода
- § 151. Фазовый переход второго рода в двумерной решетке
- § 152. Ван-дер-ваальсова теория критической точки
- § 153. Флуктуационная теория критической точки
- ГЛАВА XV. ПОВЕРХНОСТИ
- § 154. Поверхностное натяжение
- § 155. Поверхностное натяжение кристаллов
- § 156. Поверхностное давление
- § 157. Поверхностное натяжение растворов
- § 158. Поверхностное натяжение растворов сильных электролитов
- § 159. Адсорбция
- § 160. Смачивание
- § 161. Краевой угол
- § 162. Образование зародышей при фазовых переходах
- § 163. Невозможность существования фаз в одномерных системах