| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 88. Осмотическое давление
В этом и в следующих параграфах мы рассмотрим некоторые свойства растворов, причем по-прежнему будем считать раствор слабым и потому будем пользоваться формулами предыдущего параграфа.
Предположим, что два раствора одного и того же вещества в одном и том же растворителе, но обладающие различными концентрациями  отделены друг от друга перегородкой, сквозь которую могут проникать молекулы растворителя, но не растворенного вещества (полупроницаемая перегородка). Давления с обеих сторон перегородки будут при этом различными (рассуждения в § 12 о равенстве давлений здесь неприменимы благодаря наличию полупроницаемой перегородки). Разность этих давлений носит название осмотического давления.
отделены друг от друга перегородкой, сквозь которую могут проникать молекулы растворителя, но не растворенного вещества (полупроницаемая перегородка). Давления с обеих сторон перегородки будут при этом различными (рассуждения в § 12 о равенстве давлений здесь неприменимы благодаря наличию полупроницаемой перегородки). Разность этих давлений носит название осмотического давления.
Условием равновесия между обоими растворами будет (кроме равенства их температур) равенство химических потенциалов растворителя в них. Химические потенциалы растворенного вещества при этом не должны быть одинаковы, так как вследствие полупроницаемости перегородки равновесие имеет место только по отношению к растворителю.
Обозначая давления в обоих растворах буквами  и
и  и воспользовавшись выражением (87,4), получим условие равновесия в виде
и воспользовавшись выражением (87,4), получим условие равновесия в виде

Разность давлений  (т. е. осмотическое давление) для слабых растворов относительно мала. Поэтому можно разложить
(т. е. осмотическое давление) для слабых растворов относительно мала. Поэтому можно разложить  в ряд по степеням
в ряд по степеням  и оставить только два первых члена:
и оставить только два первых члена:

Подставляя это в (88,1), находим

Но производная  есть молекулярный объем v чистого растворителя. Таким образом,
есть молекулярный объем v чистого растворителя. Таким образом,

В частности, если с одной стороны перегородки находится чистый растворитель  то осмотическое давление
то осмотическое давление

где  есть число молекул растворенного вещества в объеме У растворителя (ввиду слабости раствора V с большой точностью равно полному объему раствора).
есть число молекул растворенного вещества в объеме У растворителя (ввиду слабости раствора V с большой точностью равно полному объему раствора).
Формулу (88,3) называют формулой Вант-Гоффа. Следует обратить внимание на то, что она применима к слабым растворам независимо от конкретного рода веществ (как растворителя, так и растворенного вещества), а также на сходство этой формулы с уравнением состояния идеального газа. Вместо давления газа здесь стоит осмотическое давление, вместо объема газа — объем раствора и вместо количества частиц в газе количество молекул растворенного вещества.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ
- НЕКОТОРЫЕ ОБОЗНАЧЕНИЯ
- ГЛАВА I. ОСНОВНЫЕ ПРИНЦИПЫ СТАТИСТИКИ
- § 1. Статистическое распределение
- § 2. Статистическая независимость
- § 3. Теорема Лиувилля
- § 4. Роль энергии
- § 5. Статистическая матрица
- § 6. Статистическое распределение в квантовой статистике
- § 7. Энтропия
- § 8. Закон возрастания энтропии
- ГЛАВА II. ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
- § 9. Температура
- § 10. Макроскопическое движение
- § 11. Адиабатический процесс
- § 12. Давление
- § 13. Работа и количество тепла
- § 14. Тепловая функция
- § 15. Свободная энергия и термодинамический потенциал
- § 16. Соотношения между производными термодинамических величин
- § 17. Термодинамическая шкала температуры
- § 18. Процесс Джоуля — Томсона
- § 19. Максимальная работа
- § 20. Максимальная работа, производимая телом, находящимся во внешней среде
- § 21. Термодинамические неравенства
- § 22. Принцип Ле-Шателье
- § 23. Теорема Нериста
- § 24. Зависимость термодинамических величин от числа частиц
- § 25. Равновесие тела во внешнем поле
- § 26. Вращающиеся тела
- § 27. Термодинамические соотношения в релятивистской области
- ГЛАВА III. РАСПРЕДЕЛЕНИЕ ГИББСА
- § 28. Распределение Гиббса
- § 29. Распределение Максвелла
- Задачи
- § 30. Распределение вероятностей для осциллятора
- § 31. Свободная энергия в распределении Гиббса
- Задачи
- § 32. Термодинамическая теория возмущений
- § 33. Разложение по степеням h
- § 34. Распределение Гиббса для вращающихся тел
- § 35. Распределение Гиббса с переменным числом частиц
- § 36. Вывод термодинамических соотношений из распределения Гиббса
- ГЛАВА IV. ИДЕАЛЬНЫЙ ГАЗ
- § 37. Распределение Больцмана
- § 38. Распределение Больцмана в классической статистике
- Задачи
- § 39. Столкновения молекул
- Задачи
- § 40. Неравновесный идеальный газ
- § 41. Свободная энергия больцмановского идеального газа
- § 42. Уравнение состояния идеального газа
- Задачи
- § 43. Идеальный газ с постоянной теплоемкостью
- Задачи
- § 44. Закон равнораспределения
- § 43. Одноатомный идеальный газ
- § 46. Одноатомный газ. Влияние электронного момента
- § 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- § 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- § 49. Двухатомный газ. Колебания атомов
- § 50. Двухатомный газ. Влияние электронного момента
- § 51. Многоатомный газ
- § 52. Магнетизм газов
- Задачи
- ГЛАВА V. РАСПРЕДЕЛЕНИЯ ФЕРМИ И БОЗЕ
- § 53. Распределение Ферми
- § 54. Распределение Бозе
- § 55. Неравновесные ферми- и бозе-газы
- § 56. Ферми- и бозе-газы элементарных частиц
- § 57. Вырожденный электронный газ
- § 58. Теплоемкость вырожденного электронного газа
- § 60. Магнетизм электронного газа. Сильные поля
- § 61. Релятивистский вырожденный электронный газ
- Задачи
- § 62. Вырожденный бозе-газ
- Задача
- § 63. Черное излучение
- ГЛАВА VI. ТВЕРДЫЕ ТЕЛА
- § 64. Твердые тела при низких температурах
- § 65. Твердые тела при высоких температурах
- § 66. Интерполяционная формула Дебая
- § 67. Тепловое расширение твердых тел
- § 68. Сильно анизотропные кристаллы
- § 69. Колебания кристаллической решетки
- § 70. Плотность числа колебаний
- § 71. Фононы.
- § 72. Операторы рождения и уничтожения фононов
- § 73. Отрицательные температуры
- ГЛАВА VII. НЕИДЕАЛЬНЫЕ ГАЗЫ
- § 74. Отклонение газов от идеальности
- § 75. Разложение по степеням плотности
- § 76. Формула ван-дер-Ваальса
- § 77. Связь вириального коэффициента с амплитудой рассеяния
- § 78. Термодинамические величины классической плазмы
- § 79. Метод корреляционных функций
- § 80. Термодинамические величины вырожденной плазмы
- ГЛАВА VIII. РАВНОВЕСИЕ ФАЗ
- § 81. Условия равновесия фаз
- § 82. Формула Клапейрона — Клаузиуса
- § 83. Критическая точка
- § 84. Закон соответственных состояний
- ГЛАВА IX. РАСТВОРЫ
- § 85. Системы с различными частицами
- § 86. Правило фаз
- § 87. Слабые растворы
- § 88. Осмотическое давление
- § 89. Соприкосновение фаз растворителя
- § 90. Равновесие по отношению к растворенному веществу
- Задачи
- § 91. Выделение тепла и изменение объема при растворении
- § 92. Растворы сильных электролитов
- § 93. Смесь идеальных газов
- § 94. Смесь изотопов
- § 95. Давление пара над концентрированным раствором
- § 96. Термодинамические неравенства в растворах
- § 97. Кривые равновесия
- § 98. Примеры диаграмм состояния
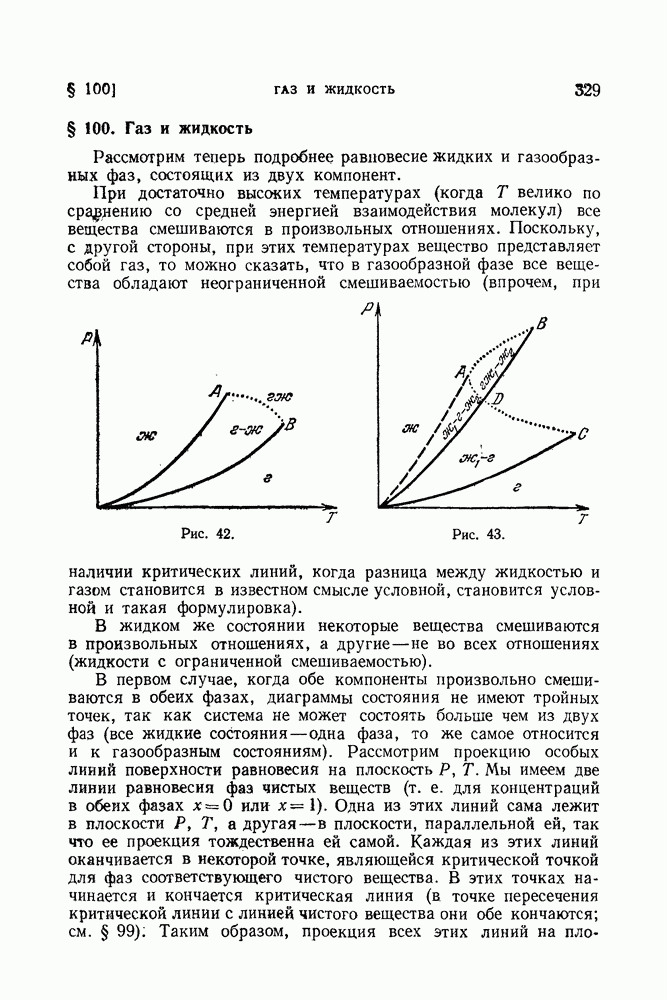
- § 99. Пересечение особых кривых поверхности равновесия
- § 100. Газ и жидкость
- ГЛАВА X. ХИМИЧЕСКИЕ РЕАКЦИИ
- § 101. Условие химического равновесия
- § 102. Закон действующих масс
- Задачи
- § 103. Теплота реакции
- § 104. Ионизационное равновесие
- § 105. Равновесие по отношению к образованию пар
- ГЛАВА XI. СВОЙСТВА ВЕЩЕСТВА ПРИ ОЧЕНЬ БОЛЬШИХ ПЛОТНОСТЯХ
- § 106. Уравнение состояния вещества при больших плотностях
- § 107. Равновесие тел с большой массой
- § 108. Энергия гравитирующего тела
- § 109. Равновесие нейтронной сферы
- ГЛАВА XII. ФЛУКТУАЦИИ
- § 110. Распределение Гаусса
- § 111. Распределение Гаусса для нескольких величин
- § 112. Флуктуации основных термодинамических величин
- Задачи
- § 113. Флуктуации в идеальном газе
- § 114. Формула Пуассона
- § 115. Флуктуации в растворах
- § 116. Пространственная корреляция флуктуаций плотности
- § 117. Корреляция флуктуаций плотности в вырожденном газе
- Задачи
- § 118. Корреляция флуктуаций во времени
- § 119. Временная корреляция флуктуаций нескольких величин
- § 120. Симметрия кинетических коэффициентов
- § 121. Диссипативная функция
- § 122. Спектральное разложение флуктуаций
- § 123. Обобщенная восприимчивость
- § 124. Флуктуационно-диссипационная теорема
- § 125. Флуктуационно-диссипационная теорема для нескольких величин
- § 126. Операторное выражение обобщенной восприимчивости
- § 127. Флуктуации изгиба длинных молекул
- ГЛАВА XIII. СИММЕТРИЯ КРИСТАЛЛОВ
- § 128. Элементы симметрии кристаллической решетки
- § 129. Решетка Бравэ
- § 130. Кристаллические системы
- § 131. Кристаллические классы
- § 132. Пространственные группы
- § 133. Обратная решетка
- § 134. Неприводимые представления пространственных групп
- § 135. Симметрия относительно обращения времени
- § 136. Свойства симметрии нормальных колебаний кристаллической решетки
- § 137. Структуры с одно- и двумерной периодичностью
- § 138. Корреляционная функция в двумерных системах
- § 139. Симметрия по ориентации молекул
- § 140. Нематические и холестерические жидкие кристаллы
- § 141. Флуктуации в жидких кристаллах
- ГЛАВА XIV. ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА И КРИТИЧЕСКИЕ ЯВЛЕНИЯ
- § 142. Фазовые переходы второго рода
- § 143. Скачок теплоемкости
- § 144. Влияние внешнего поля на фазовый переход
- § 145. Изменение симметрии при фазовом переходе второго рода
- § 146. Флуктуации параметра порядка
- § 147. Эффективный гамильтониан
- § 148. Критические индексы
- § 149. Масштабная инвариантность
- § 150. Изолированные и критические точки непрерывного перехода
- § 151. Фазовый переход второго рода в двумерной решетке
- § 152. Ван-дер-ваальсова теория критической точки
- § 153. Флуктуационная теория критической точки
- ГЛАВА XV. ПОВЕРХНОСТИ
- § 154. Поверхностное натяжение
- § 155. Поверхностное натяжение кристаллов
- § 156. Поверхностное давление
- § 157. Поверхностное натяжение растворов
- § 158. Поверхностное натяжение растворов сильных электролитов
- § 159. Адсорбция
- § 160. Смачивание
- § 161. Краевой угол
- § 162. Образование зародышей при фазовых переходах
- § 163. Невозможность существования фаз в одномерных системах