| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ГЛАВА II. ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
§ 9. Температура
Физические величины, характеризующие макроскопические состояния тел, называют термодинамическими. Среди этих величин есть такие, которые наряду с термодинамическим имеют также и чисто механический смысл; таковы, например, энергия и объем. Существуют, однако, и другого рода величины, появляющиеся именно как результат чисто статистических закономерностей и вообще не имеющие смысла в применении к немакроскопическим системам; такова, например, энтропия.
В дальнейшем мы введем целый ряд соотношений между термодинамическими величинами, которые имеют место независимо от того, к каким именно конкретным телам эти величины относятся. Такие соотношения называют термодинамическими.
При использовании термодинамических величин обычно не представляют никакого интереса те ничтожные флуктуации, которые они испытывают. Соответственно этому мы и будем полностью пренебрегать этими флуктуациями, рассматривая термодинамические величины как меняющиеся лишь при изменении макроскопического состояния тела.
Рассмотрим два тела, находящиеся в тепловом равновесии друг с другом, причем оба тела вместе составляют замкнутую систему. Тогда энтропия S этой системы имеет наибольшее возможное (при данной энергии Е системы) значение. Энергия Е есть сумма энергий  каждого из тел:
каждого из тел:  . То же самое касается энтропии S системы, причем энтропия каждого из тел является функцией энергии этого же тела:
. То же самое касается энтропии S системы, причем энтропия каждого из тел является функцией энергии этого же тела:  Поскольку
Поскольку  , где Е — постоянная, то S есть в действительности функция одной независимой переменной, и необходимое условие максимума можно написать в виде
, где Е — постоянная, то S есть в действительности функция одной независимой переменной, и необходимое условие максимума можно написать в виде

откуда

Этот вывод без труда обобщается на случай любого числа тел, находящихся в равновесии друг с другом.
Таким образом, если система находится в состоянии термодинамического равновесия, то производная энтропии по энергии для всех ее частей одинакова, т. е. постоянна вдоль всей системы. Величину, обратную производной энтропии тела S по его энергии Е, называют его абсолютной температурой, или просто температурой Т:

Температуры тел, находящихся в равновесии друг с другом, следовательно, одинаковы:  .
.
Как и энтропия, температура является, очевидно, величиной чисто статистического характера, имеющей смысл исключительно для макроскопических тел.
Рассмотрим, далее, два тела, составляющие вместе замкнутую систему, но не находящиеся в равновесии друг с другом. Их температуры  различны. С течением времени между телами будет устанавливаться равновесие, причем их температуры будут постепенно выравниваться. Их общая энтропия
различны. С течением времени между телами будет устанавливаться равновесие, причем их температуры будут постепенно выравниваться. Их общая энтропия  должна при этом возрастать, т. е. ее производная по времени положительна:
должна при этом возрастать, т. е. ее производная по времени положительна:

Поскольку полная энергия сохраняется, то  так что
так что

Пусть температура второго тела выше температуры первого  . Тогда
. Тогда  (соответственно
(соответственно  . Другими словами, энергия второго тела уменьшается, а энергия первого увеличивается. Это свойство температуры можно сформулировать так: энергия переходит от тел с более высокой к телам с более низкой температурой.
. Другими словами, энергия второго тела уменьшается, а энергия первого увеличивается. Это свойство температуры можно сформулировать так: энергия переходит от тел с более высокой к телам с более низкой температурой.
Энтропия S есть безразмерная величина. Поэтому из определения (9,1) следует, что температура имеет размерность энергии и потому может измеряться в единицах энергии, например в эргах. Однако эрг оказывается в обычных условиях слишком большой величиной и на практике принято измерять температуру в особых единицах, называемых градусами Кельвина или просто градусами.
Переводной коэффициент между эргами и градусами, т. е. число эргов в градусе, называется постоянной Больцмана и обозначается обычно буквой  она равна
она равна

Мы условимся в дальнейшем во всех формулах подразумевать температуру измеренной в энергетических единицах. Для перехода при численных расчетах к температуре, измеренной в градусах, достаточно просто заменить Т на kT. Постоянное же использование множителя k, единственное назначение которого состоит в напоминании об условных единицах измерения температуры, лишь загромождало бы формулы.
Если пользоваться температурой в градусах, то воизбежание появления постоянной k в общих термодинамических соотношениях принято вводить этот множитель также и в определение энтропии, написав

вместо (7,7). Тогда формула (9,1) определения температуры, а с нею и все общие термодинамические соотношения, получаемые ниже в этой главе, не изменятся при переходе к градусам.
Таким образом, правило перехода к градусам состоит в замене в формулах

| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- НЕКОТОРЫЕ ОБОЗНАЧЕНИЯ
- ГЛАВА I. ОСНОВНЫЕ ПРИНЦИПЫ СТАТИСТИКИ
- § 1. Статистическое распределение
- § 2. Статистическая независимость
- § 3. Теорема Лиувилля
- § 4. Роль энергии
- § 5. Статистическая матрица
- § 6. Статистическое распределение в квантовой статистике
- § 7. Энтропия
- § 8. Закон возрастания энтропии
- ГЛАВА II. ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
- § 9. Температура
- § 10. Макроскопическое движение
- § 11. Адиабатический процесс
- § 12. Давление
- § 13. Работа и количество тепла
- § 14. Тепловая функция
- § 15. Свободная энергия и термодинамический потенциал
- § 16. Соотношения между производными термодинамических величин
- § 17. Термодинамическая шкала температуры
- § 18. Процесс Джоуля — Томсона
- § 19. Максимальная работа
- § 20. Максимальная работа, производимая телом, находящимся во внешней среде
- § 21. Термодинамические неравенства
- § 22. Принцип Ле-Шателье
- § 23. Теорема Нериста
- § 24. Зависимость термодинамических величин от числа частиц
- § 25. Равновесие тела во внешнем поле
- § 26. Вращающиеся тела
- § 27. Термодинамические соотношения в релятивистской области
- ГЛАВА III. РАСПРЕДЕЛЕНИЕ ГИББСА
- § 28. Распределение Гиббса
- § 29. Распределение Максвелла
- Задачи
- § 30. Распределение вероятностей для осциллятора
- § 31. Свободная энергия в распределении Гиббса
- Задачи
- § 32. Термодинамическая теория возмущений
- § 33. Разложение по степеням h
- § 34. Распределение Гиббса для вращающихся тел
- § 35. Распределение Гиббса с переменным числом частиц
- § 36. Вывод термодинамических соотношений из распределения Гиббса
- ГЛАВА IV. ИДЕАЛЬНЫЙ ГАЗ
- § 37. Распределение Больцмана
- § 38. Распределение Больцмана в классической статистике
- Задачи
- § 39. Столкновения молекул
- Задачи
- § 40. Неравновесный идеальный газ
- § 41. Свободная энергия больцмановского идеального газа
- § 42. Уравнение состояния идеального газа
- Задачи
- § 43. Идеальный газ с постоянной теплоемкостью
- Задачи
- § 44. Закон равнораспределения
- § 43. Одноатомный идеальный газ
- § 46. Одноатомный газ. Влияние электронного момента
- § 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- § 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- § 49. Двухатомный газ. Колебания атомов
- § 50. Двухатомный газ. Влияние электронного момента
- § 51. Многоатомный газ
- § 52. Магнетизм газов
- Задачи
- ГЛАВА V. РАСПРЕДЕЛЕНИЯ ФЕРМИ И БОЗЕ
- § 53. Распределение Ферми
- § 54. Распределение Бозе
- § 55. Неравновесные ферми- и бозе-газы
- § 56. Ферми- и бозе-газы элементарных частиц
- § 57. Вырожденный электронный газ
- § 58. Теплоемкость вырожденного электронного газа
- § 60. Магнетизм электронного газа. Сильные поля
- § 61. Релятивистский вырожденный электронный газ
- Задачи
- § 62. Вырожденный бозе-газ
- Задача
- § 63. Черное излучение
- ГЛАВА VI. ТВЕРДЫЕ ТЕЛА
- § 64. Твердые тела при низких температурах
- § 65. Твердые тела при высоких температурах
- § 66. Интерполяционная формула Дебая
- § 67. Тепловое расширение твердых тел
- § 68. Сильно анизотропные кристаллы
- § 69. Колебания кристаллической решетки
- § 70. Плотность числа колебаний
- § 71. Фононы.
- § 72. Операторы рождения и уничтожения фононов
- § 73. Отрицательные температуры
- ГЛАВА VII. НЕИДЕАЛЬНЫЕ ГАЗЫ
- § 74. Отклонение газов от идеальности
- § 75. Разложение по степеням плотности
- § 76. Формула ван-дер-Ваальса
- § 77. Связь вириального коэффициента с амплитудой рассеяния
- § 78. Термодинамические величины классической плазмы
- § 79. Метод корреляционных функций
- § 80. Термодинамические величины вырожденной плазмы
- ГЛАВА VIII. РАВНОВЕСИЕ ФАЗ
- § 81. Условия равновесия фаз
- § 82. Формула Клапейрона — Клаузиуса
- § 83. Критическая точка
- § 84. Закон соответственных состояний
- ГЛАВА IX. РАСТВОРЫ
- § 85. Системы с различными частицами
- § 86. Правило фаз
- § 87. Слабые растворы
- § 88. Осмотическое давление
- § 89. Соприкосновение фаз растворителя
- § 90. Равновесие по отношению к растворенному веществу
- Задачи
- § 91. Выделение тепла и изменение объема при растворении
- § 92. Растворы сильных электролитов
- § 93. Смесь идеальных газов
- § 94. Смесь изотопов
- § 95. Давление пара над концентрированным раствором
- § 96. Термодинамические неравенства в растворах
- § 97. Кривые равновесия
- § 98. Примеры диаграмм состояния
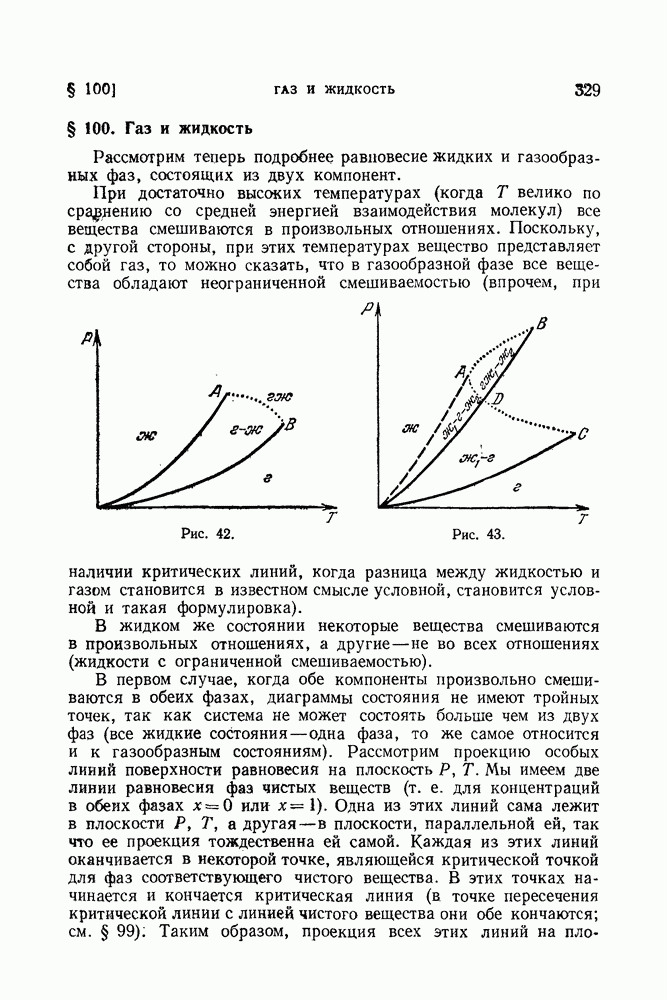
- § 99. Пересечение особых кривых поверхности равновесия
- § 100. Газ и жидкость
- ГЛАВА X. ХИМИЧЕСКИЕ РЕАКЦИИ
- § 101. Условие химического равновесия
- § 102. Закон действующих масс
- Задачи
- § 103. Теплота реакции
- § 104. Ионизационное равновесие
- § 105. Равновесие по отношению к образованию пар
- ГЛАВА XI. СВОЙСТВА ВЕЩЕСТВА ПРИ ОЧЕНЬ БОЛЬШИХ ПЛОТНОСТЯХ
- § 106. Уравнение состояния вещества при больших плотностях
- § 107. Равновесие тел с большой массой
- § 108. Энергия гравитирующего тела
- § 109. Равновесие нейтронной сферы
- ГЛАВА XII. ФЛУКТУАЦИИ
- § 110. Распределение Гаусса
- § 111. Распределение Гаусса для нескольких величин
- § 112. Флуктуации основных термодинамических величин
- Задачи
- § 113. Флуктуации в идеальном газе
- § 114. Формула Пуассона
- § 115. Флуктуации в растворах
- § 116. Пространственная корреляция флуктуаций плотности
- § 117. Корреляция флуктуаций плотности в вырожденном газе
- Задачи
- § 118. Корреляция флуктуаций во времени
- § 119. Временная корреляция флуктуаций нескольких величин
- § 120. Симметрия кинетических коэффициентов
- § 121. Диссипативная функция
- § 122. Спектральное разложение флуктуаций
- § 123. Обобщенная восприимчивость
- § 124. Флуктуационно-диссипационная теорема
- § 125. Флуктуационно-диссипационная теорема для нескольких величин
- § 126. Операторное выражение обобщенной восприимчивости
- § 127. Флуктуации изгиба длинных молекул
- ГЛАВА XIII. СИММЕТРИЯ КРИСТАЛЛОВ
- § 128. Элементы симметрии кристаллической решетки
- § 129. Решетка Бравэ
- § 130. Кристаллические системы
- § 131. Кристаллические классы
- § 132. Пространственные группы
- § 133. Обратная решетка
- § 134. Неприводимые представления пространственных групп
- § 135. Симметрия относительно обращения времени
- § 136. Свойства симметрии нормальных колебаний кристаллической решетки
- § 137. Структуры с одно- и двумерной периодичностью
- § 138. Корреляционная функция в двумерных системах
- § 139. Симметрия по ориентации молекул
- § 140. Нематические и холестерические жидкие кристаллы
- § 141. Флуктуации в жидких кристаллах
- ГЛАВА XIV. ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА И КРИТИЧЕСКИЕ ЯВЛЕНИЯ
- § 142. Фазовые переходы второго рода
- § 143. Скачок теплоемкости
- § 144. Влияние внешнего поля на фазовый переход
- § 145. Изменение симметрии при фазовом переходе второго рода
- § 146. Флуктуации параметра порядка
- § 147. Эффективный гамильтониан
- § 148. Критические индексы
- § 149. Масштабная инвариантность
- § 150. Изолированные и критические точки непрерывного перехода
- § 151. Фазовый переход второго рода в двумерной решетке
- § 152. Ван-дер-ваальсова теория критической точки
- § 153. Флуктуационная теория критической точки
- ГЛАВА XV. ПОВЕРХНОСТИ
- § 154. Поверхностное натяжение
- § 155. Поверхностное натяжение кристаллов
- § 156. Поверхностное давление
- § 157. Поверхностное натяжение растворов
- § 158. Поверхностное натяжение растворов сильных электролитов
- § 159. Адсорбция
- § 160. Смачивание
- § 161. Краевой угол
- § 162. Образование зародышей при фазовых переходах
- § 163. Невозможность существования фаз в одномерных системах