| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 89. Соприкосновение фаз растворителя
Рассмотрим равновесие двух соприкасающихся фаз растворителя, в каждой из которых растворено некоторое количество одного и того же вещества. Условиями равновесия являются (кроме равенства давлений и температур) равенства химических потенциалов растворителя и растворенного вещества в обеих фазах. Мы воспользуемся здесь первым из них и напишем его в виде

где  и
и  - концентрации, а
- концентрации, а  - химические потенциалы обеих фаз чистого растворителя.
- химические потенциалы обеих фаз чистого растворителя.
Надо заметить, что рассматриваемая нами теперь система, состоящая из двух компонент и имеющая две фазы, обладает двумя термодинамическими степенями свободы. Поэтому из четырех величин  только две можно выбрать произвольно; если мы выберем, например, Р или Т и одну из концентраций, то другая концентрация будет при этом определена.
только две можно выбрать произвольно; если мы выберем, например, Р или Т и одну из концентраций, то другая концентрация будет при этом определена.
Если бы обе фазы растворителя не содержали растворенного вещества, то условием их равновесия было бы

(температуру и давление обеих фаз мы при этом обозначили через  ).
).
Таким образом, в то время как при равновесии фаз чистого растворителя зависимость между давлением и температурой определяется уравнением (89,2), после растворения в этих фазах какого-либо вещества та же зависимость определяется уравнением (89,1). Для слабых растворов обе эти кривые близки друг к другу.
Разложим теперь в равенстве  по степеням
по степеням  и
и  , где
, где  и
и  - давление и температура в некоторой точке на кривой равновесия фаз чистого растворителя, близкой к данной точке Р, Т на кривой равновесия фаз раствора.
- давление и температура в некоторой точке на кривой равновесия фаз чистого растворителя, близкой к данной точке Р, Т на кривой равновесия фаз раствора.
Оставляя в разложении только члены первого порядка относительно  и принимая во внимание (89,2), получим из (89,1)
и принимая во внимание (89,2), получим из (89,1)

Но  не что иное, как энтропия s и объем v чистого растворителя (отнесенные к одной молекуле). Приписывая им также индекс, указывающий фазу, находим
не что иное, как энтропия s и объем v чистого растворителя (отнесенные к одной молекуле). Приписывая им также индекс, указывающий фазу, находим

Согласно формуле (81,5) имеем:  , где
, где  - теплота
- теплота  перехода растворителя из первой фазы во вторую. Поэтому (89,3) можно переписать также и в виде
перехода растворителя из первой фазы во вторую. Поэтому (89,3) можно переписать также и в виде

Разберем два частных случая этой формулы. Выберем сначала точку  так, чтобы
так, чтобы  Тогда
Тогда  будет расстоянием по оси абсцисс между обеими кривыми при одной и той же ординате. Другими словами,
будет расстоянием по оси абсцисс между обеими кривыми при одной и той же ординате. Другими словами,  будет представлять собой изменение температуры перехода между двумя фазами при растворении, т. е. разность между температурой Т этого перехода (при давлении Р), когда обе фазы являются растворами, и температурой
будет представлять собой изменение температуры перехода между двумя фазами при растворении, т. е. разность между температурой Т этого перехода (при давлении Р), когда обе фазы являются растворами, и температурой  перехода (при том же давлении) для чистого растворителя. Так как при этом
перехода (при том же давлении) для чистого растворителя. Так как при этом  то из (89,4) получим
то из (89,4) получим

Если одна из фаз (скажем, первая) является чистым растворителем  то
то

Эта формула определяет, в частности, изменение температуры замерзания при растворении, если растворенное вещество нерастворимо в твердой фазе; двумя фазами являются при этом жидкий раствор и твердый растворитель, а  есть разность между температурой вымерзания растворителя из раствора и температурой замерзания чистого растворителя. При замерзании тепло выделяется, т. е. q отрицательно. Поэтому и
есть разность между температурой вымерзания растворителя из раствора и температурой замерзания чистого растворителя. При замерзании тепло выделяется, т. е. q отрицательно. Поэтому и  , т. е. если вымерзает чистый растворитель, то растворение понижает температуру замерзания.
, т. е. если вымерзает чистый растворитель, то растворение понижает температуру замерзания.
Соотношение (89,6) определяет также изменение температуры кипения при растворении, если растворенное вещество не летуче: двумя фазами являются при этом жидкий раствор и пар растворителя.  есть теперь разность температуры выкипания растворителя из раствора и температуры кипения чистого растворителя.
есть теперь разность температуры выкипания растворителя из раствора и температуры кипения чистого растворителя.
Поскольку при кипении теплота поглощается, то  , а потому и
, а потому и  , т. е. температура кипения при растворении повышается.
, т. е. температура кипения при растворении повышается.
Все эти следствия из формулы (89,6) находятся в полном согласии с принципом Ле-Шателье. Пусть, например, жидкий раствор находится в равновесии с твердым растворителем. Если увеличить концентрацию раствора, то, согласно принципу Ле-Шателье, должна понизиться температура замерзания так, чтобы часть твердого растворителя перешла в раствор и концентрация понизилась. Система как бы противодействует выведению ее из состояния равновесия. Аналогично, если увеличить концентрацию Жидкого раствора, находящегося в равновесии с паром растворителя, то температура кипения должна повыситься так, чтобы часть пара сконденсировалась в раствор и концентрация понизилась.
Рассмотрим теперь другой частный случай формулы (89,4), выбрав точку  так, чтобы
так, чтобы  . Тогда
. Тогда  будет расстоянием между обеими кривыми при одной и той же абсциссе, т. е. разностью между давлением при равновесии двух фаз растворов и двух фаз чистого растворителя (при одной и той же температуре). Теперь
будет расстоянием между обеими кривыми при одной и той же абсциссе, т. е. разностью между давлением при равновесии двух фаз растворов и двух фаз чистого растворителя (при одной и той же температуре). Теперь  и из (89,4) получаем
и из (89,4) получаем

Применим эту формулу к равновесию между жидкой и газообразной фазами. В этом случае объемом одной фазы (жидкой) можно пренебречь по сравнению с объемом другой, и (89,7) переходит в

где v — молекулярный объем газообразной фазы (фаза I). Замечая, что  и подставляя с той же точностью
и подставляя с той же точностью  есть давление насыщенного пара над чистым растворителем), можно написать эту формулу в виде
есть давление насыщенного пара над чистым растворителем), можно написать эту формулу в виде

Если газообразная фаза представляет собой пар чистого растворителя  то (89,9) приобретает вид
то (89,9) приобретает вид
 (89,10)
(89,10)
где с — концентрация раствора.
Эта формула определяет разность между давлением насыщенного пара растворителя над раствором (Р) и над чистым растворителем  . Относительное понижение давления насыщенного пара при растворении равно концентрации раствора (закон Рауля).
. Относительное понижение давления насыщенного пара при растворении равно концентрации раствора (закон Рауля).
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ
- НЕКОТОРЫЕ ОБОЗНАЧЕНИЯ
- ГЛАВА I. ОСНОВНЫЕ ПРИНЦИПЫ СТАТИСТИКИ
- § 1. Статистическое распределение
- § 2. Статистическая независимость
- § 3. Теорема Лиувилля
- § 4. Роль энергии
- § 5. Статистическая матрица
- § 6. Статистическое распределение в квантовой статистике
- § 7. Энтропия
- § 8. Закон возрастания энтропии
- ГЛАВА II. ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
- § 9. Температура
- § 10. Макроскопическое движение
- § 11. Адиабатический процесс
- § 12. Давление
- § 13. Работа и количество тепла
- § 14. Тепловая функция
- § 15. Свободная энергия и термодинамический потенциал
- § 16. Соотношения между производными термодинамических величин
- § 17. Термодинамическая шкала температуры
- § 18. Процесс Джоуля — Томсона
- § 19. Максимальная работа
- § 20. Максимальная работа, производимая телом, находящимся во внешней среде
- § 21. Термодинамические неравенства
- § 22. Принцип Ле-Шателье
- § 23. Теорема Нериста
- § 24. Зависимость термодинамических величин от числа частиц
- § 25. Равновесие тела во внешнем поле
- § 26. Вращающиеся тела
- § 27. Термодинамические соотношения в релятивистской области
- ГЛАВА III. РАСПРЕДЕЛЕНИЕ ГИББСА
- § 28. Распределение Гиббса
- § 29. Распределение Максвелла
- Задачи
- § 30. Распределение вероятностей для осциллятора
- § 31. Свободная энергия в распределении Гиббса
- Задачи
- § 32. Термодинамическая теория возмущений
- § 33. Разложение по степеням h
- § 34. Распределение Гиббса для вращающихся тел
- § 35. Распределение Гиббса с переменным числом частиц
- § 36. Вывод термодинамических соотношений из распределения Гиббса
- ГЛАВА IV. ИДЕАЛЬНЫЙ ГАЗ
- § 37. Распределение Больцмана
- § 38. Распределение Больцмана в классической статистике
- Задачи
- § 39. Столкновения молекул
- Задачи
- § 40. Неравновесный идеальный газ
- § 41. Свободная энергия больцмановского идеального газа
- § 42. Уравнение состояния идеального газа
- Задачи
- § 43. Идеальный газ с постоянной теплоемкостью
- Задачи
- § 44. Закон равнораспределения
- § 43. Одноатомный идеальный газ
- § 46. Одноатомный газ. Влияние электронного момента
- § 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- § 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- § 49. Двухатомный газ. Колебания атомов
- § 50. Двухатомный газ. Влияние электронного момента
- § 51. Многоатомный газ
- § 52. Магнетизм газов
- Задачи
- ГЛАВА V. РАСПРЕДЕЛЕНИЯ ФЕРМИ И БОЗЕ
- § 53. Распределение Ферми
- § 54. Распределение Бозе
- § 55. Неравновесные ферми- и бозе-газы
- § 56. Ферми- и бозе-газы элементарных частиц
- § 57. Вырожденный электронный газ
- § 58. Теплоемкость вырожденного электронного газа
- § 60. Магнетизм электронного газа. Сильные поля
- § 61. Релятивистский вырожденный электронный газ
- Задачи
- § 62. Вырожденный бозе-газ
- Задача
- § 63. Черное излучение
- ГЛАВА VI. ТВЕРДЫЕ ТЕЛА
- § 64. Твердые тела при низких температурах
- § 65. Твердые тела при высоких температурах
- § 66. Интерполяционная формула Дебая
- § 67. Тепловое расширение твердых тел
- § 68. Сильно анизотропные кристаллы
- § 69. Колебания кристаллической решетки
- § 70. Плотность числа колебаний
- § 71. Фононы.
- § 72. Операторы рождения и уничтожения фононов
- § 73. Отрицательные температуры
- ГЛАВА VII. НЕИДЕАЛЬНЫЕ ГАЗЫ
- § 74. Отклонение газов от идеальности
- § 75. Разложение по степеням плотности
- § 76. Формула ван-дер-Ваальса
- § 77. Связь вириального коэффициента с амплитудой рассеяния
- § 78. Термодинамические величины классической плазмы
- § 79. Метод корреляционных функций
- § 80. Термодинамические величины вырожденной плазмы
- ГЛАВА VIII. РАВНОВЕСИЕ ФАЗ
- § 81. Условия равновесия фаз
- § 82. Формула Клапейрона — Клаузиуса
- § 83. Критическая точка
- § 84. Закон соответственных состояний
- ГЛАВА IX. РАСТВОРЫ
- § 85. Системы с различными частицами
- § 86. Правило фаз
- § 87. Слабые растворы
- § 88. Осмотическое давление
- § 89. Соприкосновение фаз растворителя
- § 90. Равновесие по отношению к растворенному веществу
- Задачи
- § 91. Выделение тепла и изменение объема при растворении
- § 92. Растворы сильных электролитов
- § 93. Смесь идеальных газов
- § 94. Смесь изотопов
- § 95. Давление пара над концентрированным раствором
- § 96. Термодинамические неравенства в растворах
- § 97. Кривые равновесия
- § 98. Примеры диаграмм состояния
- § 99. Пересечение особых кривых поверхности равновесия
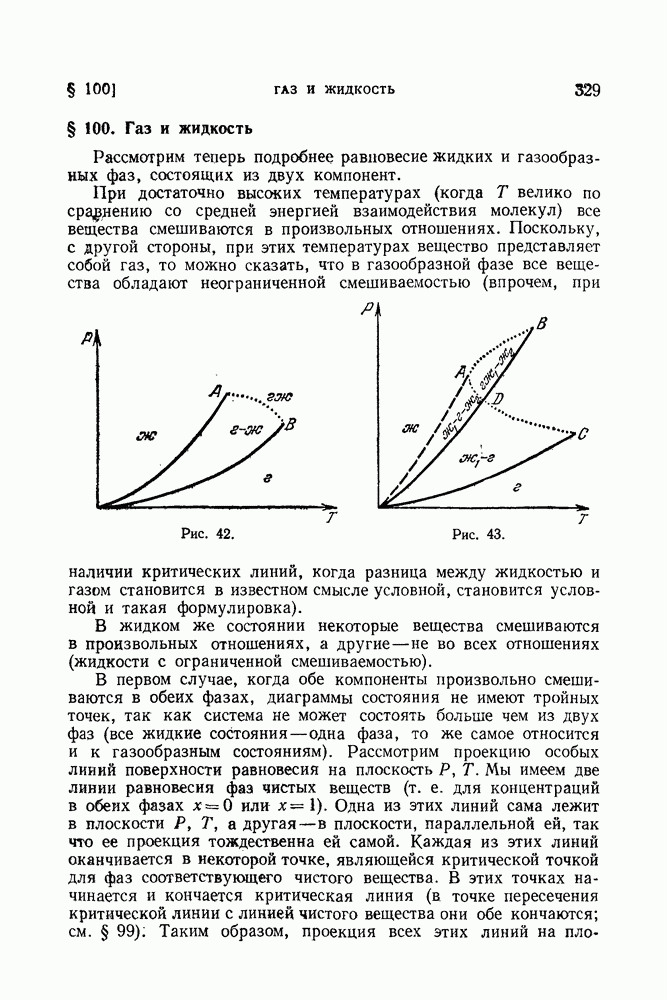
- § 100. Газ и жидкость
- ГЛАВА X. ХИМИЧЕСКИЕ РЕАКЦИИ
- § 101. Условие химического равновесия
- § 102. Закон действующих масс
- Задачи
- § 103. Теплота реакции
- § 104. Ионизационное равновесие
- § 105. Равновесие по отношению к образованию пар
- ГЛАВА XI. СВОЙСТВА ВЕЩЕСТВА ПРИ ОЧЕНЬ БОЛЬШИХ ПЛОТНОСТЯХ
- § 106. Уравнение состояния вещества при больших плотностях
- § 107. Равновесие тел с большой массой
- § 108. Энергия гравитирующего тела
- § 109. Равновесие нейтронной сферы
- ГЛАВА XII. ФЛУКТУАЦИИ
- § 110. Распределение Гаусса
- § 111. Распределение Гаусса для нескольких величин
- § 112. Флуктуации основных термодинамических величин
- Задачи
- § 113. Флуктуации в идеальном газе
- § 114. Формула Пуассона
- § 115. Флуктуации в растворах
- § 116. Пространственная корреляция флуктуаций плотности
- § 117. Корреляция флуктуаций плотности в вырожденном газе
- Задачи
- § 118. Корреляция флуктуаций во времени
- § 119. Временная корреляция флуктуаций нескольких величин
- § 120. Симметрия кинетических коэффициентов
- § 121. Диссипативная функция
- § 122. Спектральное разложение флуктуаций
- § 123. Обобщенная восприимчивость
- § 124. Флуктуационно-диссипационная теорема
- § 125. Флуктуационно-диссипационная теорема для нескольких величин
- § 126. Операторное выражение обобщенной восприимчивости
- § 127. Флуктуации изгиба длинных молекул
- ГЛАВА XIII. СИММЕТРИЯ КРИСТАЛЛОВ
- § 128. Элементы симметрии кристаллической решетки
- § 129. Решетка Бравэ
- § 130. Кристаллические системы
- § 131. Кристаллические классы
- § 132. Пространственные группы
- § 133. Обратная решетка
- § 134. Неприводимые представления пространственных групп
- § 135. Симметрия относительно обращения времени
- § 136. Свойства симметрии нормальных колебаний кристаллической решетки
- § 137. Структуры с одно- и двумерной периодичностью
- § 138. Корреляционная функция в двумерных системах
- § 139. Симметрия по ориентации молекул
- § 140. Нематические и холестерические жидкие кристаллы
- § 141. Флуктуации в жидких кристаллах
- ГЛАВА XIV. ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА И КРИТИЧЕСКИЕ ЯВЛЕНИЯ
- § 142. Фазовые переходы второго рода
- § 143. Скачок теплоемкости
- § 144. Влияние внешнего поля на фазовый переход
- § 145. Изменение симметрии при фазовом переходе второго рода
- § 146. Флуктуации параметра порядка
- § 147. Эффективный гамильтониан
- § 148. Критические индексы
- § 149. Масштабная инвариантность
- § 150. Изолированные и критические точки непрерывного перехода
- § 151. Фазовый переход второго рода в двумерной решетке
- § 152. Ван-дер-ваальсова теория критической точки
- § 153. Флуктуационная теория критической точки
- ГЛАВА XV. ПОВЕРХНОСТИ
- § 154. Поверхностное натяжение
- § 155. Поверхностное натяжение кристаллов
- § 156. Поверхностное давление
- § 157. Поверхностное натяжение растворов
- § 158. Поверхностное натяжение растворов сильных электролитов
- § 159. Адсорбция
- § 160. Смачивание
- § 161. Краевой угол
- § 162. Образование зародышей при фазовых переходах
- § 163. Невозможность существования фаз в одномерных системах