| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ГЛАВА VIII. РАВНОВЕСИЕ ФАЗ
§ 81. Условия равновесия фаз
Состояние (равновесное) однородного тела определяется заданием каких-либо двух термодинамических величин, например объема V и энергии Е. Однако нет никаких оснований утверждать, что при всякой заданной паре значений V и Е тепловому равновесию будет соответствовать именно однородное состояние тела. Может оказаться, что при данных объеме и энергии в тепловом равновесии тело не является однородным, а распадается на две соприкасающиеся однородные части, находящиеся в различных состояниях.
Такие состояния вещества, которые могут существовать одновременно в равновесии друг с другом, соприкасаясь между собой, называются различными фазами вещества.
Напишем условия равновесия двух фаз друг с другом. Прежде всего, как и для любых находящихся в равновесии тел, должны быть равны температуры  обеих фаз:
обеих фаз:

Далее должно выполняться условие равенства давлений в обеих фазах:

поскольку на поверхности их соприкосновения силы, с которыми обе фазы действуют друг на друга, должны быть равны и противоположны.
Наконец, должно выполняться условие равенства химических потенциалов обеих фаз:

которое выводится для двух фаз в точности тем же образом, как это было сделано в § 25 для любых двух соприкасающихся участков тела. Если потенциалы выражены как функции от давления и температуры, то, обозначая равные друг другу температуры и давления обеих фаз через Т и Р, мы получим уравнение

откуда давление и температура находящихся в равновесии фаз могут быть выражены как функции друг друга.
Таким образом, две фазы могут находиться в равновесии друг с другом не при любых давлении и температуре; задание одной из этих величин вполне определяет вторую.
Если откладывать на осях координат давление и температуру, то точки, в которых возможно равновесие фаз, будут лежать на некоторой кривой (кривой равновесия фаз). При этом точки, лежащие по сторонам этой кривой, будут представлять собой однородные состояния тела. При изменении состояния тела вдоль линии, пересекающей кривую равновесия, наступает расслоение фаз (в точке пересечения кривой), после чего тело переходит в другую фазу. Заметим, что при медленном изменении состояния тела оно иногда может остаться однородным даже тогда, когда при полном равновесии уже должно было бы наступить разделение фаз (таковы, например, переохлажденный пар и перегретая жидкость). Такие состояния, однако, метастабильны.
Если изображать равновесие фаз с помощью диаграммы, в которой на осях координат откладываются температура и объем (отнесенный к определенному количеству вещества), то состояния, в которых имеются одновременно две фазы, будут заполнять целую область плоскости, а не только одну кривую; это отличие от диаграммы Р, Т связано с тем, что объем V в противоположность давлению неодинаков у обеих фаз. В результате получается диаграмма изображенного на рис. 12 типа. Точки в областях  и II по обе стороны заштрихованной области соответствуют однородным первой и второй фазам. Заштрихованная же область изображает состояния, в которых обе фазы находятся в равновесии друг с другом: в какой-либо точке а находятся в равновесии фазы I и II с удельными объемами, определяемыми абсциссами точек 1 и 2, лежащих на горизонтальной прямой, проходящей через точку а. Непосредственно из баланса количества вещества легко заключить, что количества фаз I и II при этом обратно пропорциональны длинам отрезков
и II по обе стороны заштрихованной области соответствуют однородным первой и второй фазам. Заштрихованная же область изображает состояния, в которых обе фазы находятся в равновесии друг с другом: в какой-либо точке а находятся в равновесии фазы I и II с удельными объемами, определяемыми абсциссами точек 1 и 2, лежащих на горизонтальной прямой, проходящей через точку а. Непосредственно из баланса количества вещества легко заключить, что количества фаз I и II при этом обратно пропорциональны длинам отрезков  (так называемое правило рычага).
(так называемое правило рычага).
Аналогично условиям равновесия двух фаз, равновесие трех фаз одного и того же вещества определяется равенствами

Если обозначить снова общие значения давления и температуры трех фаз посредством Р и Т, то мы получим условия


Рис. 12.
Это два уравнения с двумя неизвестными Р и Т; они имеют в качестве решений определенные пары значений Р и Т. Состояния, в которых одновременно существуют три фазы (так называемые тройные точки), на диаграмме Р, Т изобразятся изолированными точками, являющимися точками пересечения кривых равновесия каждых двух из трех фаз (рис. 13; области I, II, III - области трех однородных фаз). Равновесие более чем трех фаз одного и того же вещества, очевидно, невозможно.
На диаграмме Т, V окрестность тройной точки имеет вид, изображенный на рис. 14, где заштрихованные области — области попарного равновесия фаз; удельные объемы трех фаз, находящихся в равновесии в тройной точке (при температуре  ), определяются абсциссами точек 1, 2, 3.
), определяются абсциссами точек 1, 2, 3.

Рис. 13.

Рис. 14.
Переход из одной фазы в другую сопровождается выделением или поглощением некоторого количества тепла (теплота перехода). Согласно условиям равновесия такой переход происходит при постоянных давлении и температуре. Но при процессе, протекающем при постоянном давлении, количество поглощаемого телом тепла равно изменению его тепловой функции. Поэтому теплота перехода, отнесенная к одной молекуле, есть
 (81,4)
(81,4)
где  - тепловые функции обеих фаз, отнесенные к одной молекуле. Величина q положительна, если при переходе из первой фазы во вторую тепло поглощается, и отрицательна, если при этом переходе тепло выделяется.
- тепловые функции обеих фаз, отнесенные к одной молекуле. Величина q положительна, если при переходе из первой фазы во вторую тепло поглощается, и отрицательна, если при этом переходе тепло выделяется.
Поскольку  (для тел, состоящих из одного вещества) есть термодинамический потенциал на одну молекулу, то можно написать:
(для тел, состоящих из одного вещества) есть термодинамический потенциал на одну молекулу, то можно написать:  (
( - молекулярные энергия, энтропия и объем). Поэтому условие
- молекулярные энергия, энтропия и объем). Поэтому условие  дает
дает

где Т и Р — температура и давление обеих фаз, откуда

Заметим, что эта формула вытекает и непосредственно из того, что  а температура постоянна (эта формула применима здесь, так как переход совершается обратимо — обе фазы во время перехода остаются в равновесии друг с другом).
а температура постоянна (эта формула применима здесь, так как переход совершается обратимо — обе фазы во время перехода остаются в равновесии друг с другом).

Рис. 15.
Пусть две кривые на рис. 15 изображают химические потенциалы двух фаз как функции температуры (при заданном давлении). Точка пересечения обеих кривых определяет температуру  при которой (при данном давлении) обе фазы могут находиться в равновесии друг с другом. При всех остальных температурах может существовать либо одна, либо другая фаза. Легко видеть, что при температурах ниже Та существует, т. е. является устойчивой, первая фаза, а при температурах выше
при которой (при данном давлении) обе фазы могут находиться в равновесии друг с другом. При всех остальных температурах может существовать либо одна, либо другая фаза. Легко видеть, что при температурах ниже Та существует, т. е. является устойчивой, первая фаза, а при температурах выше  -вторая. Это следует из того, что устойчиво то состояние, в котором
-вторая. Это следует из того, что устойчиво то состояние, в котором  меньше (так как термодинамический потенциал стремится при заданных Я и Г к минимуму). С другой стороны, в точке пересечения обеих кривых значение производной
меньше (так как термодинамический потенциал стремится при заданных Я и Г к минимуму). С другой стороны, в точке пересечения обеих кривых значение производной  больше, чем значение
больше, чем значение  т. е. энтропия первой фазы
т. е. энтропия первой фазы  меньше, чем энтропия второй
меньше, чем энтропия второй  Поэтому теплота перехода
Поэтому теплота перехода  положительна. Таким образом, мы приходим к выводу, что если при повышении температуры тело переходит из одной фазы в другую, то при этом тепло поглощается. Этот результат можно было бы получить и из принципа
положительна. Таким образом, мы приходим к выводу, что если при повышении температуры тело переходит из одной фазы в другую, то при этом тепло поглощается. Этот результат можно было бы получить и из принципа  ателье.
ателье.
Задачи
1. Определить температурную зависимость давления насыщенного пара над твердым телом (пар рассматривать как идеальный газ; как газ, так и твердое тело обладают постоянными теплоемкостями).
Решение. Химический потенциал пара определяется формулой (43,3), а твердого тела — формулой (65,6) (ввиду относительной малости давления насыщенного пара можно для твердого тела пренебречь величиной PV и считать Ф равным F). Приравнивая оба выражения, найдем

где индекс 1 относится к твердому телу, 2 — к пару.
В том же приближении тепловую функцию твердого тела можно считать равной его энергии; теплота перехода (теплота возгонки)  равна
равна

В частности, теплота перехода при  есть
есть  так что можно написать:
так что можно написать: 
2. Определить скорость испарения конденсированного тела в пустоту. Решение. Скорость испарения в пустоту определяется числом частиц, покидающих в единицу времени единицу площади поверхности тела. Рассмотрим тело, находящееся в равновесии со своим насыщенным паром. Тогда число частиц, покидающих поверхность тела, равно числу частиц, падающих в течение того же времени на эту поверхность и «прилипающих» к ней, т. е. равно

где  — давление насыщенного пара, a R — некоторый средний коэффициент отражения частиц газа, сталкивающихся с поверхностью тела (см. (39,2)). Если
— давление насыщенного пара, a R — некоторый средний коэффициент отражения частиц газа, сталкивающихся с поверхностью тела (см. (39,2)). Если  не слишком велико, то число частиц, покидающих поверхность тела, не зависит от того, имеется ли в окружающем пространстве пар или нет, так что написанное выражение определяет искомую скорость испарения в пустоту.
не слишком велико, то число частиц, покидающих поверхность тела, не зависит от того, имеется ли в окружающем пространстве пар или нет, так что написанное выражение определяет искомую скорость испарения в пустоту.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- НЕКОТОРЫЕ ОБОЗНАЧЕНИЯ
- ГЛАВА I. ОСНОВНЫЕ ПРИНЦИПЫ СТАТИСТИКИ
- § 1. Статистическое распределение
- § 2. Статистическая независимость
- § 3. Теорема Лиувилля
- § 4. Роль энергии
- § 5. Статистическая матрица
- § 6. Статистическое распределение в квантовой статистике
- § 7. Энтропия
- § 8. Закон возрастания энтропии
- ГЛАВА II. ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
- § 9. Температура
- § 10. Макроскопическое движение
- § 11. Адиабатический процесс
- § 12. Давление
- § 13. Работа и количество тепла
- § 14. Тепловая функция
- § 15. Свободная энергия и термодинамический потенциал
- § 16. Соотношения между производными термодинамических величин
- § 17. Термодинамическая шкала температуры
- § 18. Процесс Джоуля — Томсона
- § 19. Максимальная работа
- § 20. Максимальная работа, производимая телом, находящимся во внешней среде
- § 21. Термодинамические неравенства
- § 22. Принцип Ле-Шателье
- § 23. Теорема Нериста
- § 24. Зависимость термодинамических величин от числа частиц
- § 25. Равновесие тела во внешнем поле
- § 26. Вращающиеся тела
- § 27. Термодинамические соотношения в релятивистской области
- ГЛАВА III. РАСПРЕДЕЛЕНИЕ ГИББСА
- § 28. Распределение Гиббса
- § 29. Распределение Максвелла
- Задачи
- § 30. Распределение вероятностей для осциллятора
- § 31. Свободная энергия в распределении Гиббса
- Задачи
- § 32. Термодинамическая теория возмущений
- § 33. Разложение по степеням h
- § 34. Распределение Гиббса для вращающихся тел
- § 35. Распределение Гиббса с переменным числом частиц
- § 36. Вывод термодинамических соотношений из распределения Гиббса
- ГЛАВА IV. ИДЕАЛЬНЫЙ ГАЗ
- § 37. Распределение Больцмана
- § 38. Распределение Больцмана в классической статистике
- Задачи
- § 39. Столкновения молекул
- Задачи
- § 40. Неравновесный идеальный газ
- § 41. Свободная энергия больцмановского идеального газа
- § 42. Уравнение состояния идеального газа
- Задачи
- § 43. Идеальный газ с постоянной теплоемкостью
- Задачи
- § 44. Закон равнораспределения
- § 43. Одноатомный идеальный газ
- § 46. Одноатомный газ. Влияние электронного момента
- § 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- § 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- § 49. Двухатомный газ. Колебания атомов
- § 50. Двухатомный газ. Влияние электронного момента
- § 51. Многоатомный газ
- § 52. Магнетизм газов
- Задачи
- ГЛАВА V. РАСПРЕДЕЛЕНИЯ ФЕРМИ И БОЗЕ
- § 53. Распределение Ферми
- § 54. Распределение Бозе
- § 55. Неравновесные ферми- и бозе-газы
- § 56. Ферми- и бозе-газы элементарных частиц
- § 57. Вырожденный электронный газ
- § 58. Теплоемкость вырожденного электронного газа
- § 60. Магнетизм электронного газа. Сильные поля
- § 61. Релятивистский вырожденный электронный газ
- Задачи
- § 62. Вырожденный бозе-газ
- Задача
- § 63. Черное излучение
- ГЛАВА VI. ТВЕРДЫЕ ТЕЛА
- § 64. Твердые тела при низких температурах
- § 65. Твердые тела при высоких температурах
- § 66. Интерполяционная формула Дебая
- § 67. Тепловое расширение твердых тел
- § 68. Сильно анизотропные кристаллы
- § 69. Колебания кристаллической решетки
- § 70. Плотность числа колебаний
- § 71. Фононы.
- § 72. Операторы рождения и уничтожения фононов
- § 73. Отрицательные температуры
- ГЛАВА VII. НЕИДЕАЛЬНЫЕ ГАЗЫ
- § 74. Отклонение газов от идеальности
- § 75. Разложение по степеням плотности
- § 76. Формула ван-дер-Ваальса
- § 77. Связь вириального коэффициента с амплитудой рассеяния
- § 78. Термодинамические величины классической плазмы
- § 79. Метод корреляционных функций
- § 80. Термодинамические величины вырожденной плазмы
- ГЛАВА VIII. РАВНОВЕСИЕ ФАЗ
- § 81. Условия равновесия фаз
- § 82. Формула Клапейрона — Клаузиуса
- § 83. Критическая точка
- § 84. Закон соответственных состояний
- ГЛАВА IX. РАСТВОРЫ
- § 85. Системы с различными частицами
- § 86. Правило фаз
- § 87. Слабые растворы
- § 88. Осмотическое давление
- § 89. Соприкосновение фаз растворителя
- § 90. Равновесие по отношению к растворенному веществу
- Задачи
- § 91. Выделение тепла и изменение объема при растворении
- § 92. Растворы сильных электролитов
- § 93. Смесь идеальных газов
- § 94. Смесь изотопов
- § 95. Давление пара над концентрированным раствором
- § 96. Термодинамические неравенства в растворах
- § 97. Кривые равновесия
- § 98. Примеры диаграмм состояния
- § 99. Пересечение особых кривых поверхности равновесия
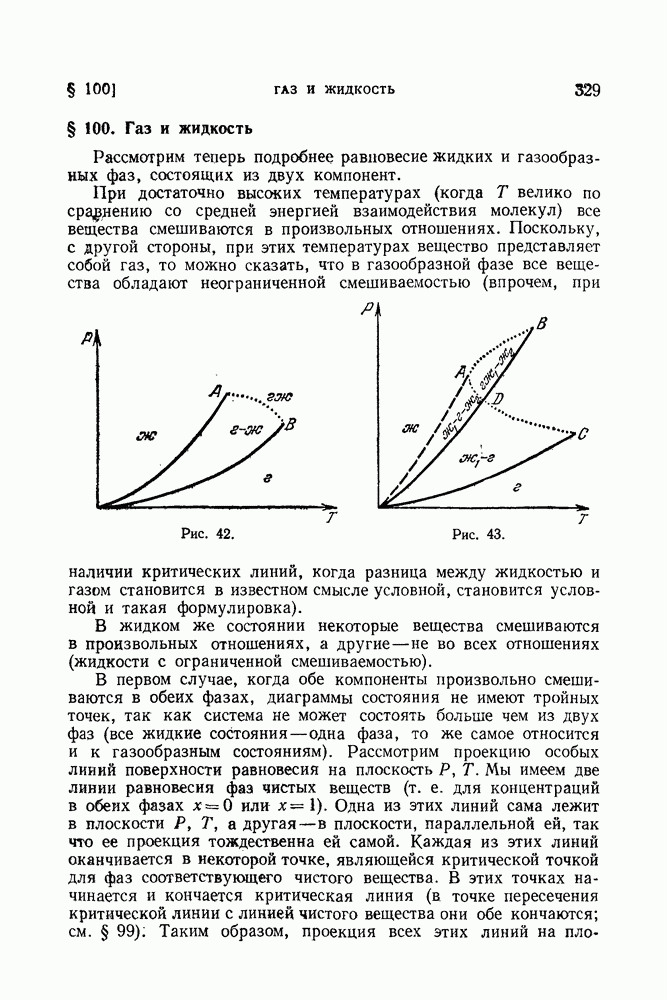
- § 100. Газ и жидкость
- ГЛАВА X. ХИМИЧЕСКИЕ РЕАКЦИИ
- § 101. Условие химического равновесия
- § 102. Закон действующих масс
- Задачи
- § 103. Теплота реакции
- § 104. Ионизационное равновесие
- § 105. Равновесие по отношению к образованию пар
- ГЛАВА XI. СВОЙСТВА ВЕЩЕСТВА ПРИ ОЧЕНЬ БОЛЬШИХ ПЛОТНОСТЯХ
- § 106. Уравнение состояния вещества при больших плотностях
- § 107. Равновесие тел с большой массой
- § 108. Энергия гравитирующего тела
- § 109. Равновесие нейтронной сферы
- ГЛАВА XII. ФЛУКТУАЦИИ
- § 110. Распределение Гаусса
- § 111. Распределение Гаусса для нескольких величин
- § 112. Флуктуации основных термодинамических величин
- Задачи
- § 113. Флуктуации в идеальном газе
- § 114. Формула Пуассона
- § 115. Флуктуации в растворах
- § 116. Пространственная корреляция флуктуаций плотности
- § 117. Корреляция флуктуаций плотности в вырожденном газе
- Задачи
- § 118. Корреляция флуктуаций во времени
- § 119. Временная корреляция флуктуаций нескольких величин
- § 120. Симметрия кинетических коэффициентов
- § 121. Диссипативная функция
- § 122. Спектральное разложение флуктуаций
- § 123. Обобщенная восприимчивость
- § 124. Флуктуационно-диссипационная теорема
- § 125. Флуктуационно-диссипационная теорема для нескольких величин
- § 126. Операторное выражение обобщенной восприимчивости
- § 127. Флуктуации изгиба длинных молекул
- ГЛАВА XIII. СИММЕТРИЯ КРИСТАЛЛОВ
- § 128. Элементы симметрии кристаллической решетки
- § 129. Решетка Бравэ
- § 130. Кристаллические системы
- § 131. Кристаллические классы
- § 132. Пространственные группы
- § 133. Обратная решетка
- § 134. Неприводимые представления пространственных групп
- § 135. Симметрия относительно обращения времени
- § 136. Свойства симметрии нормальных колебаний кристаллической решетки
- § 137. Структуры с одно- и двумерной периодичностью
- § 138. Корреляционная функция в двумерных системах
- § 139. Симметрия по ориентации молекул
- § 140. Нематические и холестерические жидкие кристаллы
- § 141. Флуктуации в жидких кристаллах
- ГЛАВА XIV. ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА И КРИТИЧЕСКИЕ ЯВЛЕНИЯ
- § 142. Фазовые переходы второго рода
- § 143. Скачок теплоемкости
- § 144. Влияние внешнего поля на фазовый переход
- § 145. Изменение симметрии при фазовом переходе второго рода
- § 146. Флуктуации параметра порядка
- § 147. Эффективный гамильтониан
- § 148. Критические индексы
- § 149. Масштабная инвариантность
- § 150. Изолированные и критические точки непрерывного перехода
- § 151. Фазовый переход второго рода в двумерной решетке
- § 152. Ван-дер-ваальсова теория критической точки
- § 153. Флуктуационная теория критической точки
- ГЛАВА XV. ПОВЕРХНОСТИ
- § 154. Поверхностное натяжение
- § 155. Поверхностное натяжение кристаллов
- § 156. Поверхностное давление
- § 157. Поверхностное натяжение растворов
- § 158. Поверхностное натяжение растворов сильных электролитов
- § 159. Адсорбция
- § 160. Смачивание
- § 161. Краевой угол
- § 162. Образование зародышей при фазовых переходах
- § 163. Невозможность существования фаз в одномерных системах