| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
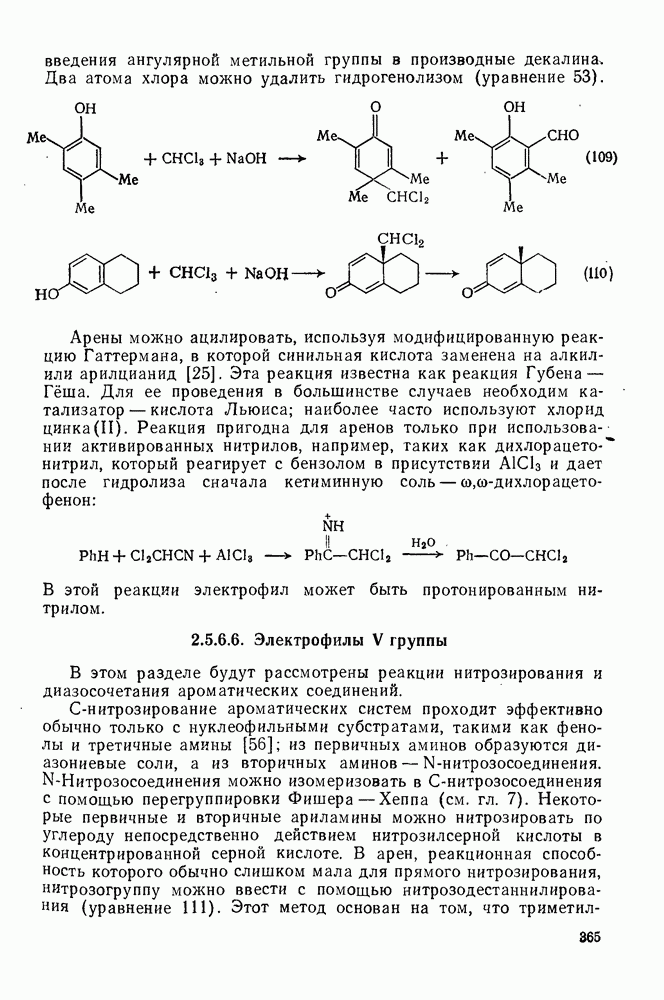
2.5.6.6. Электрофилы V группы
В этом разделе будут рассмотрены реакции нитрозирования и диазосочетания ароматических соединений.
С-нитрозирование ароматических систем проходит эффективно обычно только с нуклеофильными субстратами, такими как фенолы и третичные амины [56]; из первичных аминов образуются диазониевые соли, а из вторичных аминов —  -нитрозосоединения. С-Нитрозосоединения можно изомеризовать в С-нитрозосоединения с помощью перегруппировки Фишера — Хеппа (см. гл. 7). Некоторые первичные и вторичные ариламины можно нитрозировать по углероду непосредственно действием нитрозилсерной кислоты в концентрированной серной кислоте. В арен, реакционная способность которого обычно слишком мала для прямого нитрозирования, нитрозогруппу можно ввести с помощью нитрозодестаннилирования (уравнение 111).
-нитрозосоединения. С-Нитрозосоединения можно изомеризовать в С-нитрозосоединения с помощью перегруппировки Фишера — Хеппа (см. гл. 7). Некоторые первичные и вторичные ариламины можно нитрозировать по углероду непосредственно действием нитрозилсерной кислоты в концентрированной серной кислоте. В арен, реакционная способность которого обычно слишком мала для прямого нитрозирования, нитрозогруппу можно ввести с помощью нитрозодестаннилирования (уравнение 111).
Этот метод основан на том, что триметил станнильный остаток является более легко уходящей группой, чем протон [57].

Установить истинную природу электрофила при нитрозировании фенолов значительно труднее, чем в случае нитрования. Обычно для нитрозирования требуются сильнонуклеофильные ароматические субстраты, поскольку ион нитрозония значительно устойчивее иона нитрония и, следовательно, значительно менее реакционноспособен. Кинетические исследования [58] показали, что реакционная способность иона нитрозония по крайней мере в 1014 раз ниже реакционной способности иона нитрония. Нитрозирование в концентрированной хлорной кислоте  почти наверняка идет с участием иона нитрозония. Нитрозирование бензола и толуола происходит в 10,4 М хлорной кислоте, однако поскольку ион нитрозония и хлорная кислота являются окислителями, то в действительности всегда образуется много нитросоединения. Высокая устойчивость иона нитрозония приводит к тому, что стадия 1 (см. уравнение 27) становится особенно легко обратимой, и величина
почти наверняка идет с участием иона нитрозония. Нитрозирование бензола и толуола происходит в 10,4 М хлорной кислоте, однако поскольку ион нитрозония и хлорная кислота являются окислителями, то в действительности всегда образуется много нитросоединения. Высокая устойчивость иона нитрозония приводит к тому, что стадия 1 (см. уравнение 27) становится особенно легко обратимой, и величина  — большой. При этом наблюдаются значительные первичные кинетические изотопные эффекты. Для реакций с фенолом и
— большой. При этом наблюдаются значительные первичные кинетические изотопные эффекты. Для реакций с фенолом и  фенолом величина
фенолом величина  равна
равна  , а для анизола
, а для анизола  . Гексадейтеробензол реагирует в дейтеросерной кислоте примерно в 8,5 раз медленнее, чем обычный бензол. По-видимому, лимитирующая стадия разложения
. Гексадейтеробензол реагирует в дейтеросерной кислоте примерно в 8,5 раз медленнее, чем обычный бензол. По-видимому, лимитирующая стадия разложения  -комплекса характерна для нитрозирования ароматических субстратов с различной степенью нуклеофильности. Полагают, что нитрозирование n-крезола проходит двумя путями (схема уравнений 112), причем оба включают быстрое и обратимое образование диенового интермедиата, который затем медленно превращается в конечный продукт спонтанно или за счет кислотно-катализируемого процесса.
-комплекса характерна для нитрозирования ароматических субстратов с различной степенью нуклеофильности. Полагают, что нитрозирование n-крезола проходит двумя путями (схема уравнений 112), причем оба включают быстрое и обратимое образование диенового интермедиата, который затем медленно превращается в конечный продукт спонтанно или за счет кислотно-катализируемого процесса.

Ароматические ионы диазония, представляющие собой обычно слабые электрофилы, сочетаются с образованием азосоединений только с сильнонуклеофильными ароматическими соединениями. Большинство примеров представляют собой реакции аминов и фенолов [59]. Замещение проходит обычно в пара-положение к элек-тронодонорному заместителю, а если это положение занято, то в орто-положение. В реакциях сочетания фенолов и аминов важную роль играет кислотность среды. С фенолами реакция проходит быстро только в слабощелочном растворе (уравнение 113), по-видимому, потому, что неионизированная форма не является обычно достаточно реакционноспособной. Значение  раствора фенолят-иоиа должно быть не слишком высоким, иначе реакция не пройдет обычным путем, поскольку в достаточно щелочной среде арил-диазониевый ион превращается в соответствующий арилрадикал через диазогидроксид. Реакции арилдиазониевых солей с аминами осуществляются обычно в нейтральной или слабоосновной среде (уравнение 114). Тот факт, что сочетание осуществляется в пара-положение даже в кислой среде, означает, что в реакции участвует непротонированный амин. Первичные и вторичные амины часто сочетаются по азоту с образованием триазенов, в особенности, если избегать сильнокислых условий. В некоторых случаях это особенно выгодно, поскольку в кислых условиях можно регенерировать ди-азоний и, следовательно, триазены, которые являются относительно устойчивыми, можно рассматривать как защищенные диазониевые соли (уравнение 115).
раствора фенолят-иоиа должно быть не слишком высоким, иначе реакция не пройдет обычным путем, поскольку в достаточно щелочной среде арил-диазониевый ион превращается в соответствующий арилрадикал через диазогидроксид. Реакции арилдиазониевых солей с аминами осуществляются обычно в нейтральной или слабоосновной среде (уравнение 114). Тот факт, что сочетание осуществляется в пара-положение даже в кислой среде, означает, что в реакции участвует непротонированный амин. Первичные и вторичные амины часто сочетаются по азоту с образованием триазенов, в особенности, если избегать сильнокислых условий. В некоторых случаях это особенно выгодно, поскольку в кислых условиях можно регенерировать ди-азоний и, следовательно, триазены, которые являются относительно устойчивыми, можно рассматривать как защищенные диазониевые соли (уравнение 115).
При сочетании бензолдиазониевого иона с анилином образуется триазен (диазоаминобензол) желтого цвета. При нагревании диазоаминобензола с анилином и гидрохлоридом анилина в течение некоторого времени происходит межмолекулярная перегруппировка с образованием м-аминоазобензола. Эта перегруппировка включает образование неустойчивого, но кинетически предпочтительного продукта, который затем медленно диспропорционирует и рекомбинируется в термодинамически более устойчивый продукт (схема уравнений 116).

Азосоединения получают уже свыше 100 лет с целью использования их в качестве красителей. Для придания красителю способности растворяться в воде в молекулу обычно вводят еульфогруппу. Все простые производные азобензола имеют желтую или оранжевую окраску. Более глубокий тон окраски, а также более высокая устойчивость к свету и стирке достигаются путем увеличения цепи сопряжения хромофора. К типичным азокрасителям относятся оранжевый II (70) и конго красный (71).

Обычно нуклеофильность ацилированных амннов, арнловых эфиров и фенольных эфиров недостаточна для образования азосоединений с арилдиазониевыми солями, если только не присутствуют электроноакцепторные группы, увеличивающие электрофильность диазониевой группы. Ион  -тринитробензолдиазония сочетается с мезитиленом,
-тринитробензолдиазония сочетается с мезитиленом,  -тетраметилбензолом и пентаметнлбензолом, однако, к удивлению, не реагирует с дуролом (
-тетраметилбензолом и пентаметнлбензолом, однако, к удивлению, не реагирует с дуролом ( -тетраметилбензол).
-тетраметилбензол).
Как упоминалось ранее (см. разд. 2.5.6.2), при реакциях сочетания арилдиазониевых солей наблюдались кинетические изотопные эффекты. Получены также доказательства [60] в пользу того, что для отрыва протона основанием из  -комплекса (уравнение 27) переходное состояние, включающее
-комплекса (уравнение 27) переходное состояние, включающее  -углерод, водород и основание, вовсе не обязательно должно быть линейным. Пр и диазосочетании
-углерод, водород и основание, вовсе не обязательно должно быть линейным. Пр и диазосочетании  обнаружен первичный кинетический изотопный эффект
обнаружен первичный кинетический изотопный эффект  , обусловленный пространственными затруднениями. С другой стороны, в реакциях диазосочетания
, обусловленный пространственными затруднениями. С другой стороны, в реакциях диазосочетания  отсутствуют изотопные эффекты Поскольку пространственные требования для обоих заместителей в положении 8 должны быть примерно одинаковыми, то отсутствие изотопного эффекта во второй реакции обусловлено внутримолекулярным основным катализом. Атака основания на уходящий протон имеет место прежде чем электрофильная группа становится копланарной с нафталиновым ядром (см. 72).
отсутствуют изотопные эффекты Поскольку пространственные требования для обоих заместителей в положении 8 должны быть примерно одинаковыми, то отсутствие изотопного эффекта во второй реакции обусловлено внутримолекулярным основным катализом. Атака основания на уходящий протон имеет место прежде чем электрофильная группа становится копланарной с нафталиновым ядром (см. 72).

| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- ПРЕДИСЛОВИЕ
- ИЗ ПРЕДИСЛОВИЯ К ТОМУ 1 АНГЛИЙСКОГО ИЗДАНИЯ
- ЧАСТЬ I. НОМЕНКЛАТУРА И СТЕРЕОХИМИЯ
- 1.1. ВВЕДЕНИЕ И СТЕРЕОХИМИЯ
- 1.1.2. СИММЕТРИЯ И ХИРАЛЬНОСТЬ
- 1.1.3. ХИМИЧЕСКАЯ ТОПОЛОГИЯ
- 1.1.4. ИЗОМЕРИЯ
- 1.1.4.2. Строение
- 1.1.4.3. Абсолютная конфигурация
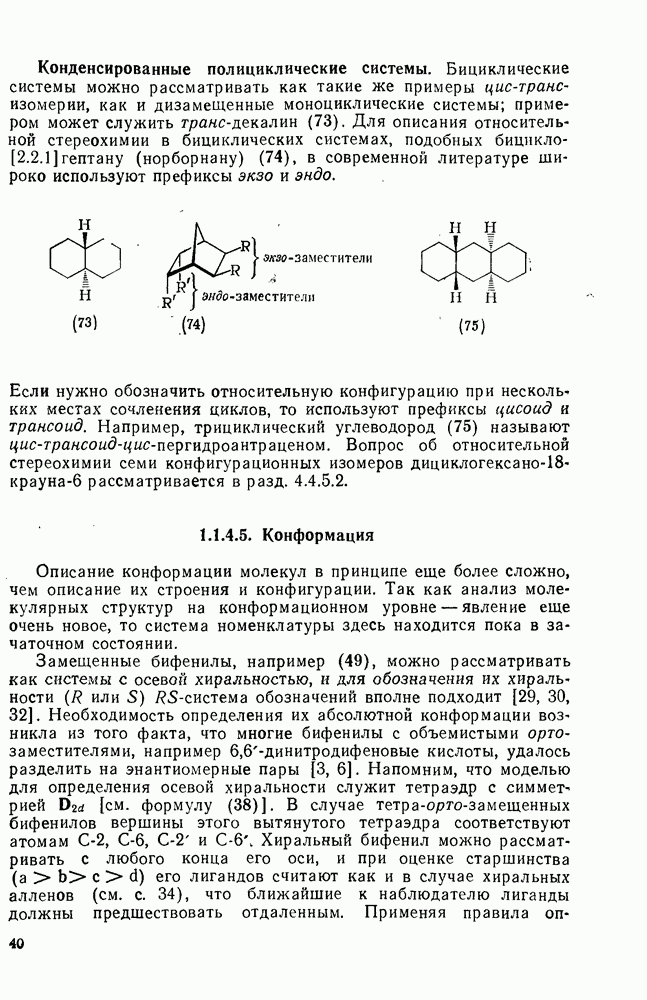
- 1.1.4.4. Относительная конфигурация
- 1.1.4.5. Конформация
- 1.1.4.6. Концепция изомерии
- 1.1.5. ТОПИЗМ
- 1.1.5.2. Прохиральность
- 1.1.5.3. Псевдоасимметрия (псевдохиральность)
- 1.1.6. ТОПОМЕРИЯ
- 1.1.7. ДИНАМИЧЕСКАЯ СТЕРЕОХИМИЯ. КРАТКИЕ СВЕДЕНИЯ
- ЧАСТЬ 2. УГЛЕВОДОРОДЫ
- 2.1. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
- 2.1.2. Строение и номенклатура
- 2.1.2.1. Номенклатура IUPAC
- 2.1.2.2. Алициклические алканы
- 2.1.2.3. Полициклоалканы
- 2.1.3. ИСТОЧНИКИ ПОЛУЧЕНИЯ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ
- 2.1.4. ФИЗИЧЕСКИЕ СВОЙСТВА
- 2.1.4.1. Ациклические алканы
- 2.1.4.2. Моно- и полициклоалканы
- 2.1.5. СТЕРЕОХИМИЯ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
- 2.1.5.1. Углы и длины связей
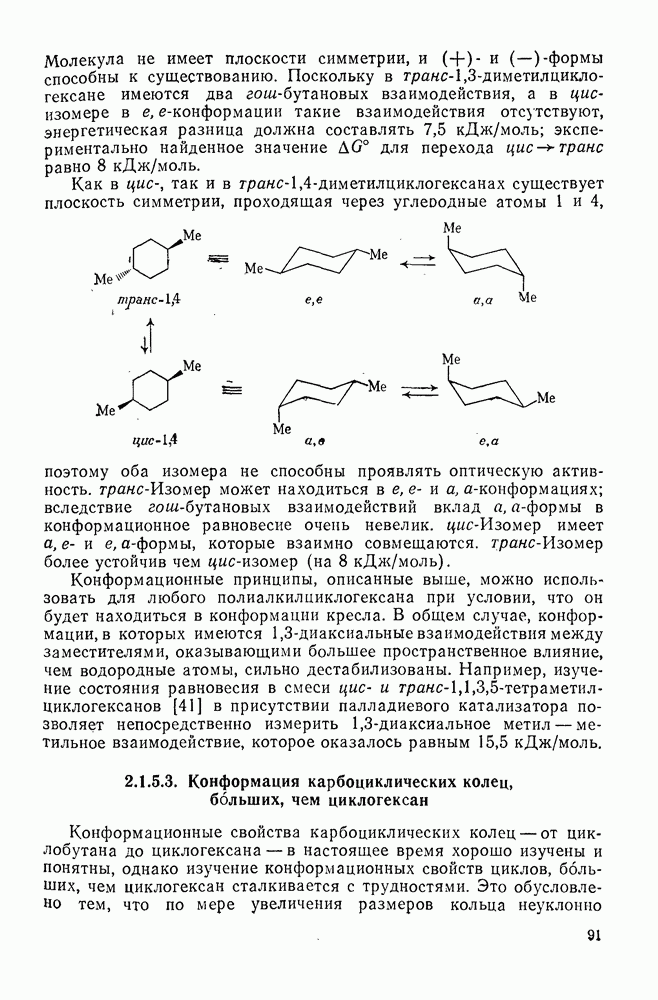
- 2.1.5.2. Алкил- и полиалкилциклогексаны
- 2.1.5.3. Конформация карбоциклических колец, больших, чем циклогексан
- 2.1.6. ТЕРМОХИМИЧЕСКИЕ СВОЙСТВА
- 2.1.6.1. Горение. Алканы и циклоалканы как топливо
- 2.1.6.2. Определение теплот сгорания и термохимические свойства
- 2.1.6.3. Эмпирические методы оценки теплот образования алканов
- 2.1.6.4. Оценка теплот образования алканов на основе энергии связей
- 2.1.6.5. Оценка теплот образования алканов на основе инкрементов групп
- 2.1.6.6. Оценка теплот образования циклических, полициклических и мостиковых алканов на основе инкрементов «скошенных разобщенных» групп и «единственных» наиболее устойчивых конформаций
- 2.1.6.7. Молекулярно-механические расчеты теплот образования и энергии напряжения
- 2.1.6.8. Моно- и полициклоалкаиы
- 2.1.7. ПОЛУЧЕНИЕ АЦИКЛИЧЕСКИХ АЛКАНОВ
- 2.1.7.1. Получение алканов восстановлением олефинов
- 2.1.7.2. Получение алканов из альдегидов и кетонов
- 2.1.7.3. Получение алканов из спиртов и алкилгалогенидов
- 2.1.7.4. Получение алканов из карбоновых кислот
- 2.1.8. СИНТЕЗ МОНО- И ПОЛИЦИКЛОАЛКАНОВ
- 2.1.9. РЕАКЦИИ АЦИКЛИЧЕСКИХ АЛКАНОВ
- 2.1.9.1. Галогенирование
- 2.1.9.2. Нитрование
- 2.1.9.3. Окисление
- 2.1.9.4. Каталитическая изомеризация алканов
- 2.1.9.5. Каталитическое алкилирование алканов
- 2.1.9.6. Реакции крекинга алканов
- 2.1.9.7. Термический крекинг
- 2.1.9.8. Каталитический крекинг
- 2.1.9.9. Каталитический риформинг и дегидроциклизация алканов
- 2.1.10. РЕАКЦИИ ЦИКЛОАЛКАНОВ И ПОЛИЦИКЛОАЛКАНОВ
- 2.2. ОЛЕФИНОВЫЕ И АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
- 2.2.2. ПОЛУЧЕНИЕ ОЛЕФИНОВ
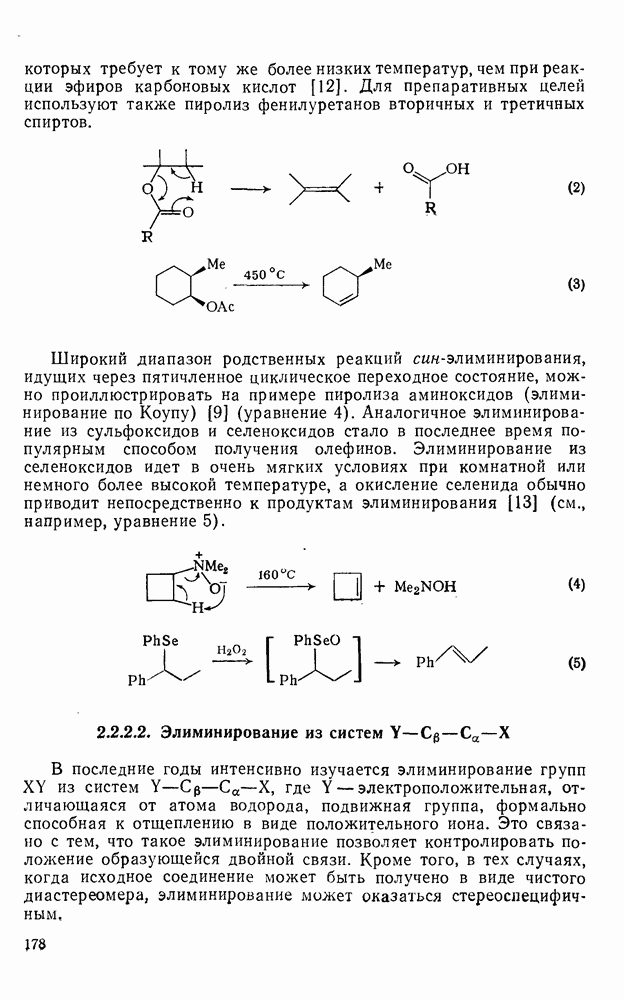
- 2.2.2.1. Элиминирование в системах
- 2.2.2.2. Элиминирование из систем
- 2.2.2.3. Циклоэлиминирование
- 2.2.2.4. Частичное восстановление
- 2.2.2.5. Элиминирование сульфонилгидразонов
- 2.2.2.6. Реакция Виттига и родственные ей реакции
- 2.2.2.7. Различные реакции конденсации
- 2.2.2.8. Электроциклические реакции
- 2.2.2.9. Циклоолигомеризация
- 2.2.2.11. Реакции винильных производных
- 2.2.3. РЕАКЦИИ ОЛЕФИНОВ
- 2.2.3.1. Электрофильное присоединение
- 2.2.3.2. Нуклеофильное присоединение
- 2.2.3.3. Радикальное присоединение
- 2.2.3.4. Циклоприсоединение и родственные реакции
- 2.2.3.5. Окисление
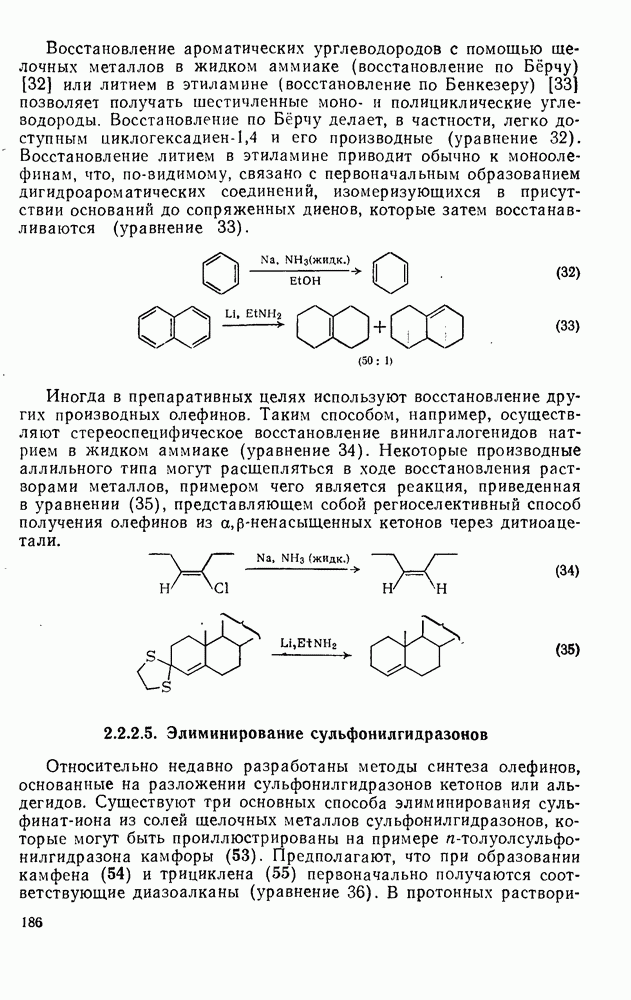
- 2.2.3.6. Восстановление
- 2.2.3.7. Перегруппировки
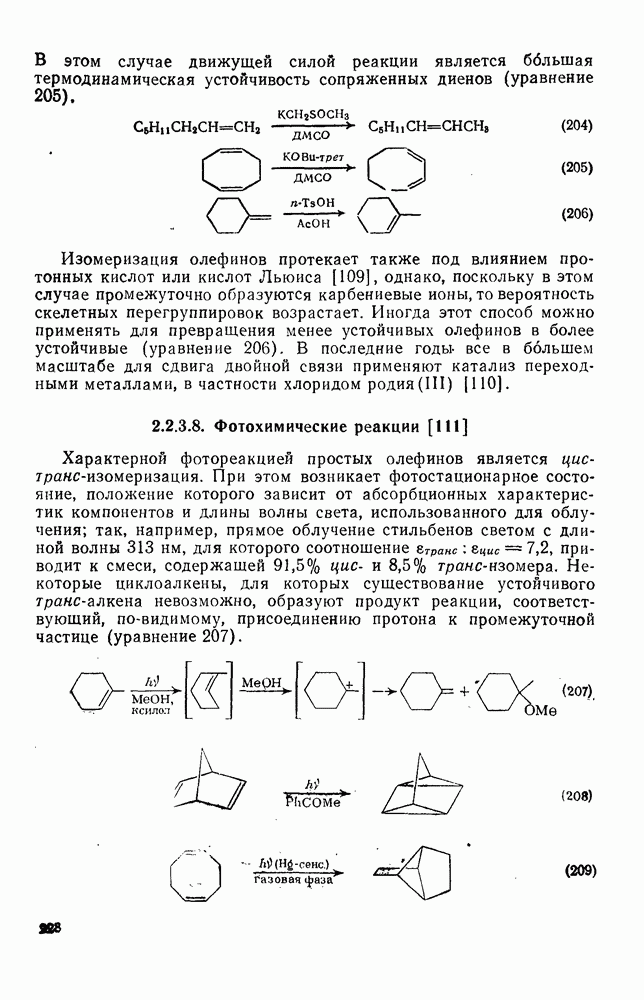
- 2.2.3.8. Фотохимические реакции
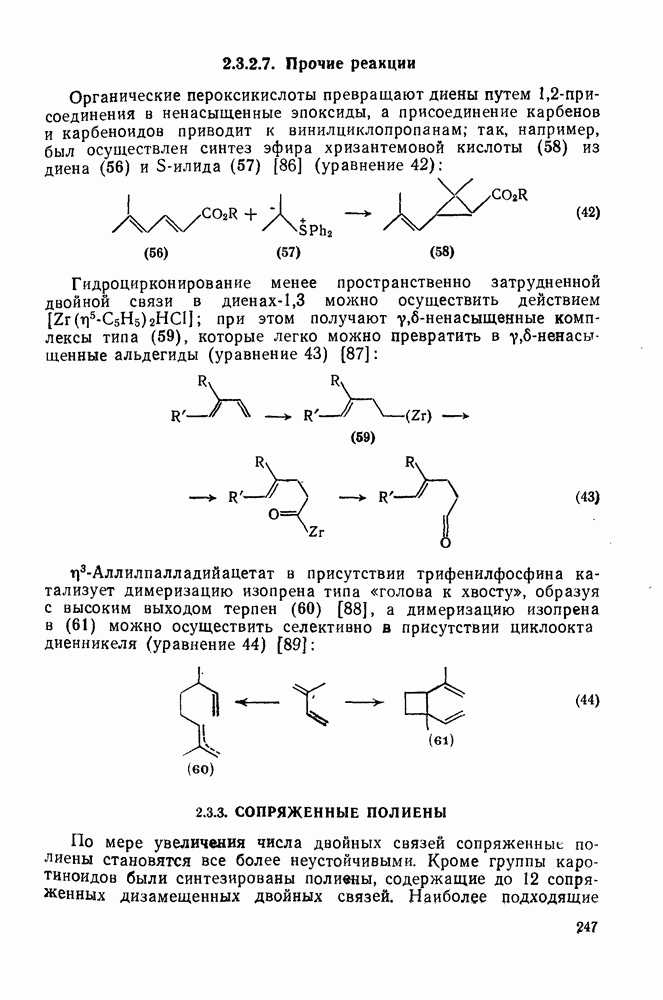
- 2.2.3.9. Прочие реакции
- 2.3. ДИЕНЫ, ПОЛНЕНЫ И АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
- 2.3.1. СОПРЯЖЕННЫЕ ДИЕНЫ И ПОЛНЕНЫ
- 2.3.1.2. Получение сопряженных диенов
- 2.3.2. РЕАКЦИИ СОПРЯЖЕННЫХ ДИЕНОВ
- 2.3.2.2. Восстановление
- 2.3.2.3. Гидроборирование
- 2.3.2.4. Реакция Дильса — Альдера
- 2.3.2.5. Комплексы с карбонилами железа
- 2.3.2.6. Фотохимические термические реакции
- 2.3.2.7. Прочие реакции
- 2.3.3. СОПРЯЖЕННЫЕ ПОЛИЕНЫ
- 2.3.4. ПРИРОДНЫЕ ДИЕНЫ И ПОЛНЕНЫ
- 2.3.5. АЛЛЕНЫ И КУМУЛЕНЫ
- 2.3.5.2. Получение алленов
- 2.3.6. РЕАКЦИИ АЛЛЕНОВ
- 2.3.6.2. Гидрирование
- 2.3.6.3. Реакции алленов в присутствии комплексов металлов
- 2.3.7. КУМУЛЕНЫ
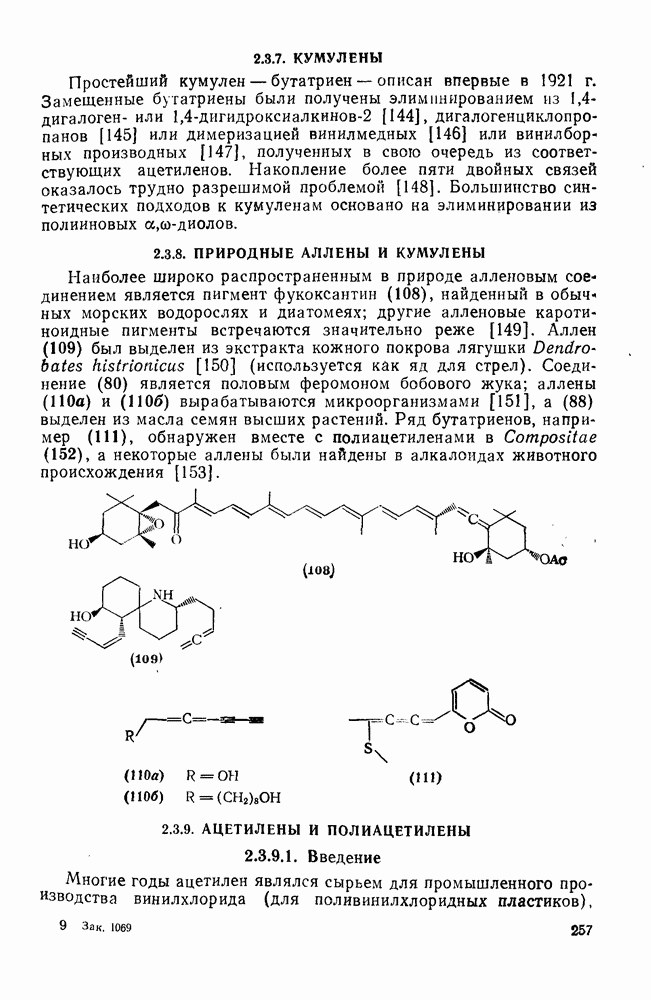
- 2.3.8. ПРИРОДНЫЕ АЛЛЕНЫ И КУМУЛЕНЫ
- 2.3.9. АЦЕТИЛЕНЫ И ПОЛИАЦЕТИЛЕНЫ
- 2.3.9.2. Получение ацетиленов
- 2.3.10. РЕАКЦИИ АЦЕТИЛЕНОВ
- 2.3.10.2. Изомеризация
- 2.3.10.3. Пропаргильные перегруппировки
- 2.3.10.4. Реакции присоединения
- 2.3.10.5. Гидроборирование и гидроалюминирование
- 2.3.10.6. Реакции замещения
- 2.3.10.7. Восстановление
- 2.3.10.8. Окисление
- 2.3.10.9. Циклоприсоединение
- 2.3.10.10. Реакции катализуемые металлами
- 2.3.11. ПОЛИАЦЕТИЛЕНЫ
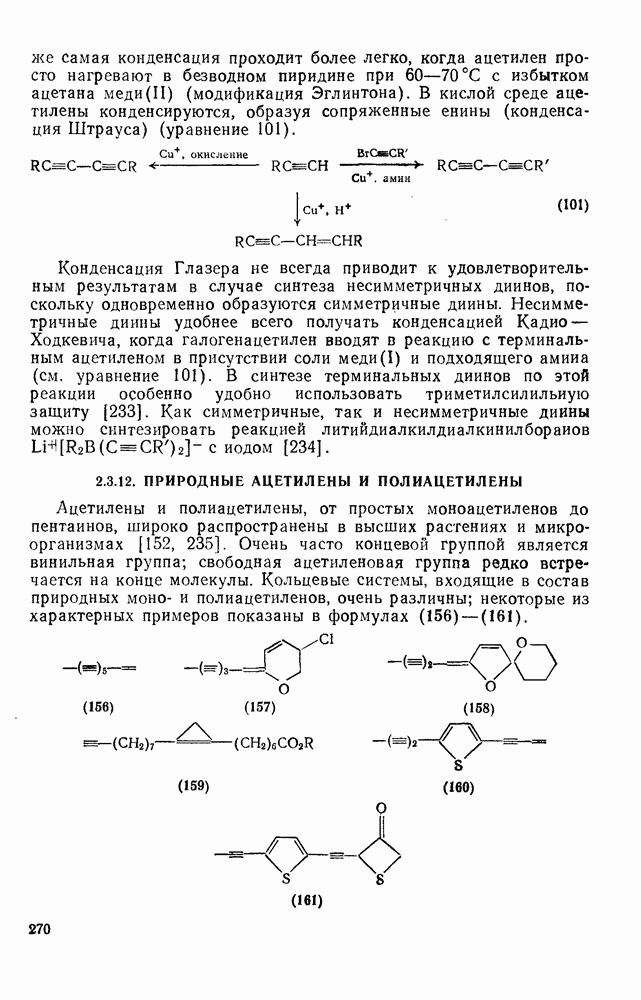
- 2.3.12. ПРИРОДНЫЕ АЦЕТИЛЕНЫ И ПОЛИАЦЕТИЛЕНЫ
- 2.3.13. СОПРЯЖЕННЫЕ ЕНИНЫ
- 2.3.13.1. Получение сопряженных енинов
- 2.3.14. РЕАКЦИИ СОПРЯЖЕННЫХ ЕНИНОВ
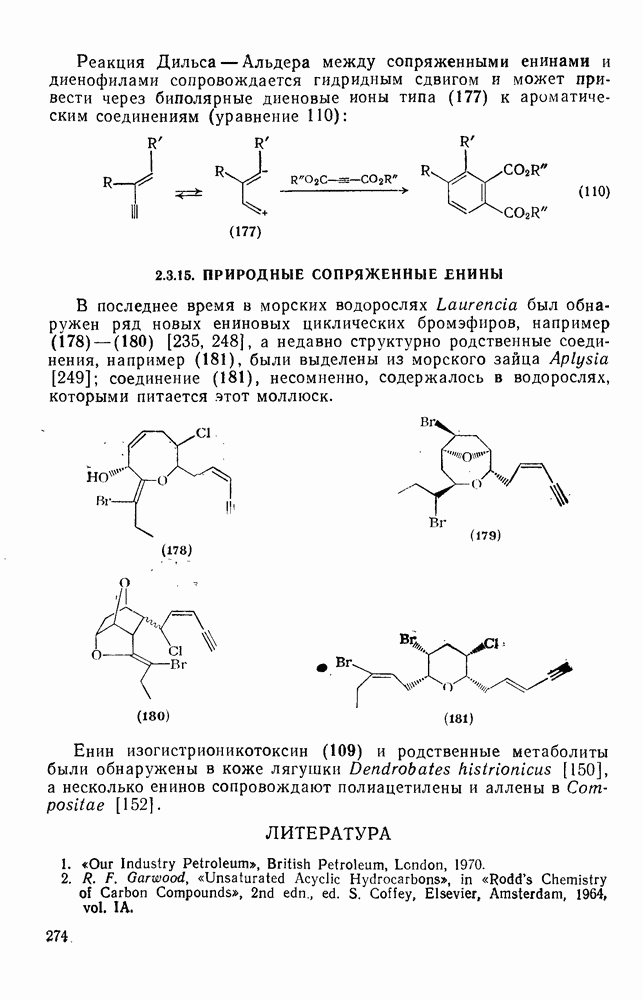
- 2.3.15. ПРИРОДНЫЕ СОПРЯЖЕННЫЕ ЕНИНЫ
- 2.4. АРОМАТИЧНОСТЬ
- 2.4.2. ЭЛЕКТРОННЫЕ ТЕОРИИ СТРОЕНИЯ БЕНЗОЛА
- 2.4.3. КРИТЕРИИ АРОМАТИЧНОСТИ
- 2.4.3.1. Термодинамические свойства
- 2.4.3.2. Структурные особенности
- 2.4.3.3. Магнитные свойства
- 2.4.3.4. Прочие критерии
- 2.4.4. АНТИАРОМАТИЧНОСТЬ
- 2.4.4.1. Термодинамические свойства
- 2.4.4.2. Структурные особенности
- 2.4.4.3. Магнитные свойства
- 2.4.4.4. Прочие свойства
- 2.4.5. ТЕОРЕТИЧЕСКИЕ ОПРЕДЕЛЕНИЯ АРОМАТИЧНОСТИ
- 2.4.5.1. Полуэмпирические расчеты и дьюаровская резонансная энергия
- 2.4.5.2. Расчеты по методу валентных пар и применение резонансного метода
- 2.4.5.3. Локализация связей
- 2.4.5.4. Связь энергетических критериев с критериями локализации связей
- 2.4.6. АРОМАТИЧЕСКИЕ ПЕРЕХОДНЫЕ СОСТОЯНИЯ
- 2.5. АРЕНЫ И ИХ РЕАКЦИИ
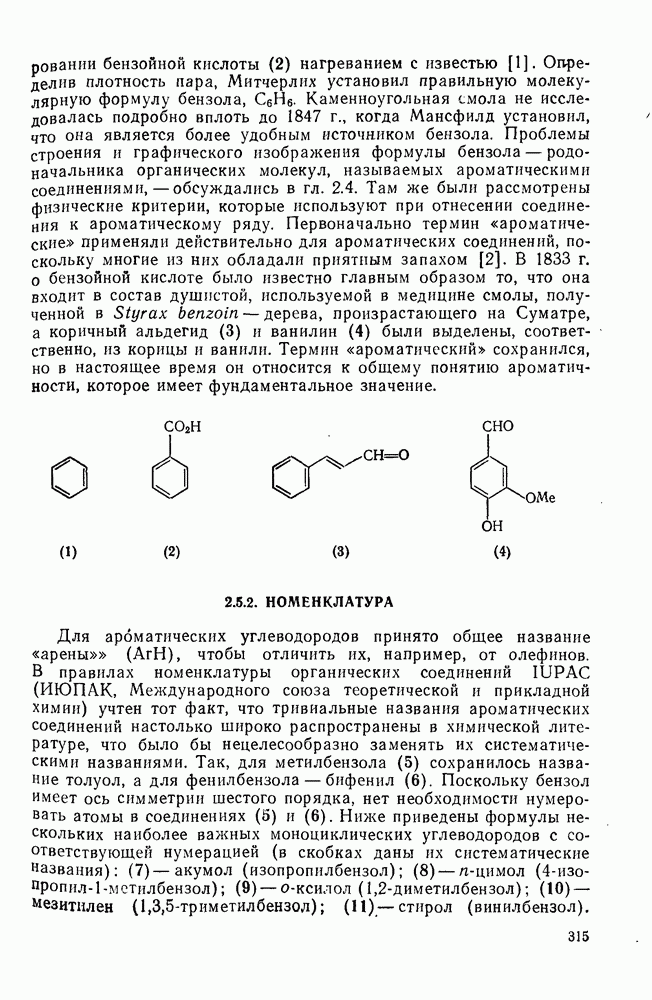
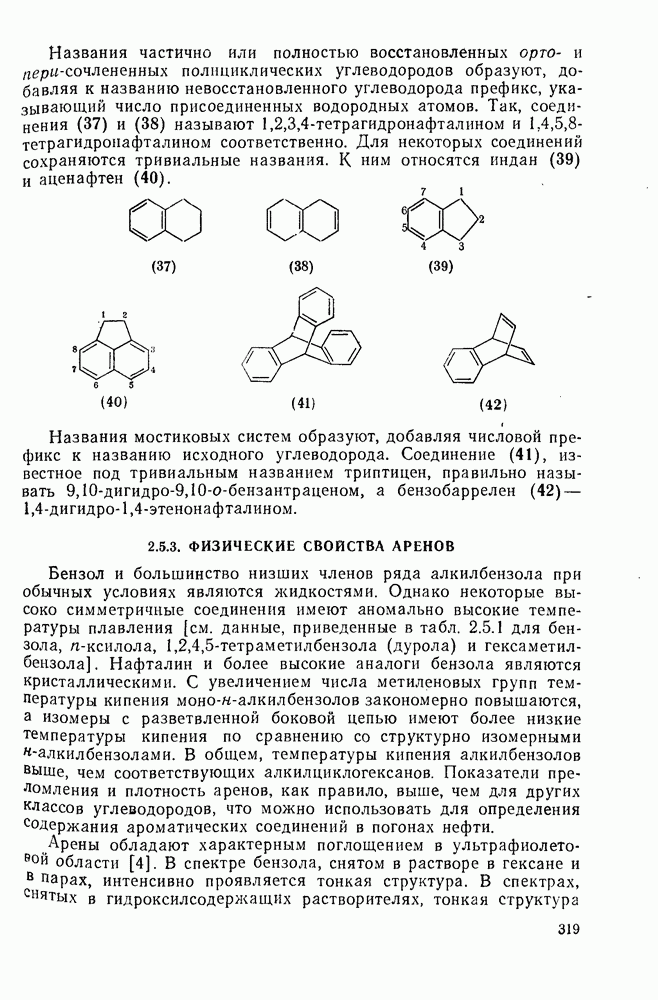
- 2.5.2. НОМЕНКЛАТУРА
- 2.5.3. ФИЗИЧЕСКИЕ СВОЙСТВА АРЕНОВ
- 2.5.4. ПРОМЫШЛЕННОЕ ПРОИЗВОДСТВО АРЕНОВ
- 2.5.5. ЦИКЛОТРИМЕРИЗАЦИЯ АЦЕТИЛЕНОВ
- 2.5.6. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ — ЭЛИМИНИРОВАНИЯ АРЕНОВ
- 2.5.6.1. Механизм ароматического нитрования [15]
- 2.5.6.2. Кинетические изотопные эффекты [21]
- 2.5.6.3. Реакции, включающие ипсо-протонирование
- 2.5.6.4. Металлирование
- 2.5.6.5. Электрофилы IV группы
- 2.5.6.6. Электрофилы V группы
- 2.5.6.7. Электрофилы VI группы [18, 56]
- 2.5.6.8. Электрофилы VII группы [18, 25а, 56]
- 2.5.7. ОРИЕНТАЦИЯ В РЕАКЦИЯХ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ — ЭЛИМИНИРОВАНИЯ
- 2.5.8. РАДИКАЛЬНОЕ ГАЛОГЕНИРОВАНИЕ АРЕНОВ В БОКОВУЮ ЦЕПЬ [96]
- 2.5.9. РЕАКЦИИ ПРИСОЕДИНЕНИЯ К АРЕНАМ
- 2.5.9.1. Восстановление аренов
- 2.5.9.2. Термическое циклоприсоединение к аренам
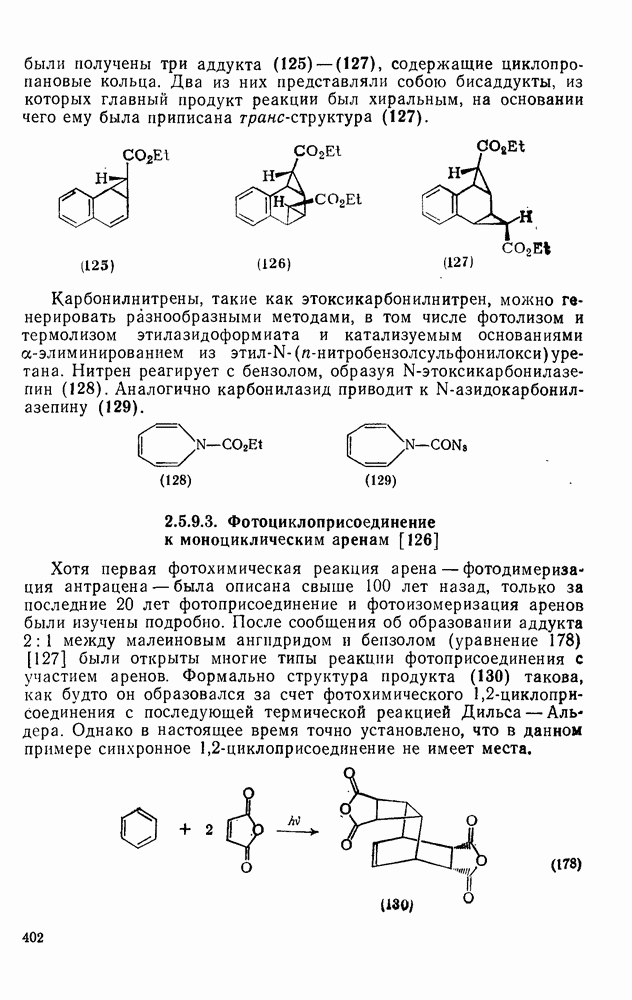
- 2.5.9.3. Фотоциклоприсоединение к моноциклическим аренам [126]
- 2.5.9.4. Фотохимические реакции полициклических аренов
- 2.6.10. ФОТОИЗОМЕРИЗАЦИЯ АРЕНОВ [126б]
- 2.5.11. ОКИСЛЕНИЕ АРЕНОВ [153]
- 2.5.12. РЕАКЦИИ АРЕНОВ С СИНГЛЕТНЫМ КИСЛОРОДОМ [162]
- 2.5.13. ПРИГОТОВЛЕНИЕ БИ- И ПОЛИАРИЛОВ
- 2.5.14. ВНУТРИМОЛЕКУЛЯРНАЯ ФОТОЦИКЛИЗАЦИЯ, ПРИВОДЯЩАЯ К ПОЛИЦИКЛИЧЕСКИМ АРЕНАМ
- 2.5.15. ВНУТРИМОЛЕКУЛЯРНАЯ ЦИКЛИЗАЦИЯ ДИЗАМЕЩЕННЫХ АРЕНОВ
- 2.5.16. ЦИКЛОФАНЫ
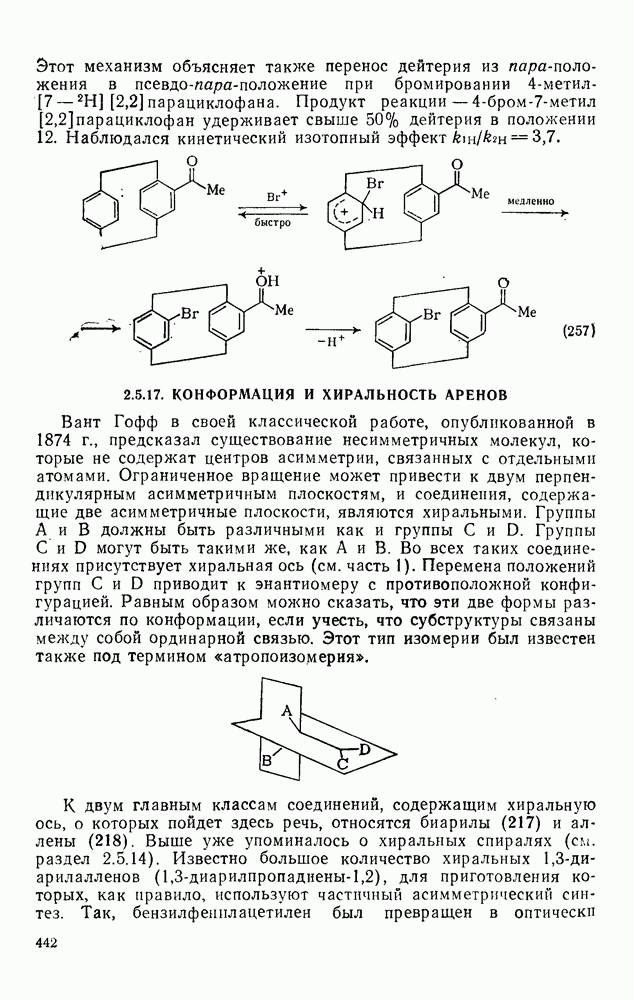
- 2.5.17. КОНФОРМАЦИЯ И ХИРАЛЬНОСТЬ АРЕНОВ
- 2.5.18. АЗУЛЕНЫ И НЕБЕНЗОИДНЫЕ АРЕНЫ
- 2.6. АННУЛЕНЫ И РОДСТВЕННЫЕ СИСТЕМЫ
- 2.6.2. МЕТОДЫ СИНТЕЗА
- 2.6.2.1. Окислительное сочетание терминальных ацетиленов (метод Зондхеймера)
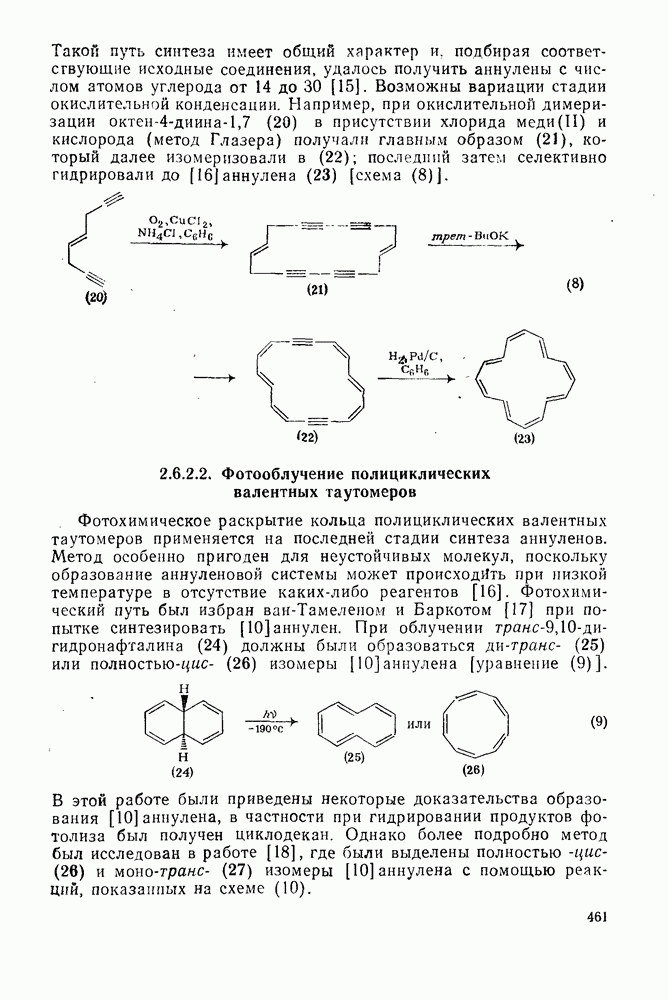
- 2.6.2.2. Фотооблучение полициклических валентных таутомеров
- 2.6.2.3. Валентная таутомерия типа норкарадиен — циклогептатриен (метод Фогеля)
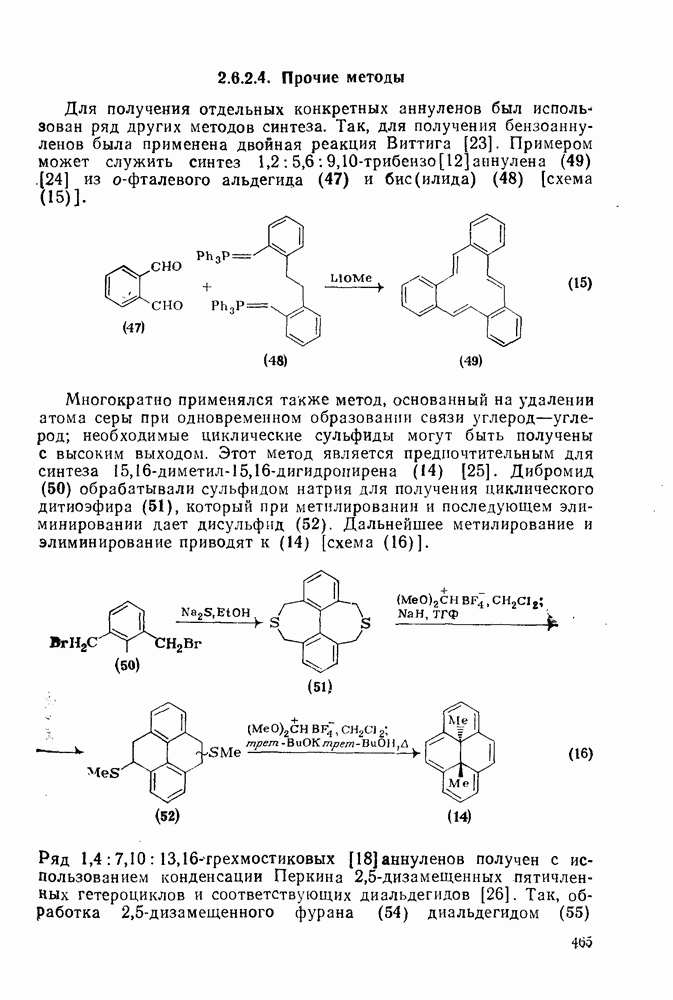
- 2.6.2.4. Прочие методы
- 2.6.3. СВОЙСТВА АННУЛЕНОВ
- 2.6.4. СВОЙСТВА 4n-АННУЛЕНОВ
- 2.6.5. ДЕГИДРОАННУЛЕНЫ
- 2.6.6. АННЕЛИРОВАННЫЕ АННУЛЕНЫ
- 2.6.7. АРОМАТИЧЕСКИЕ И АНТИАРОМАТИЧЕСКИЕ МОНОЦИКЛИЧЕСКИЕ ИОНЫ
- 2.6.8. АРОМАТИЧЕСКИЕ И АНТИАРОМАТИЧЕСКИЕ ПОЛИЦИКЛИЧЕСКИЕ ИОНЫ
- 2.6.9. ГОМОАРОМАТИЧЕСКИЕ СИСТЕМЫ
- 2.7. КАРБОКАТИОНЫ И КАРБАНИОНЫ
- 2.7.1.2. Краткий исторический очерк развития химии карбокатионов
- 2.7.1.3. Методы генерации карбокатионов
- 2.7.1.4. Типы карбокатионов
- 2.7.1.5. Изучение карбокатионов: методы и результаты
- 2.7.1.6. Реакции карбокатионов
- 2.7.2. КАРБАНИОНЫ
- 2.7.2.2. Методы генерации карбанионов
- 2.7.2.3. Типы карбанионов
- 2.7.2.4. Физические свойства карбанионов
- 2.7.5.2. Реакции карбанионов
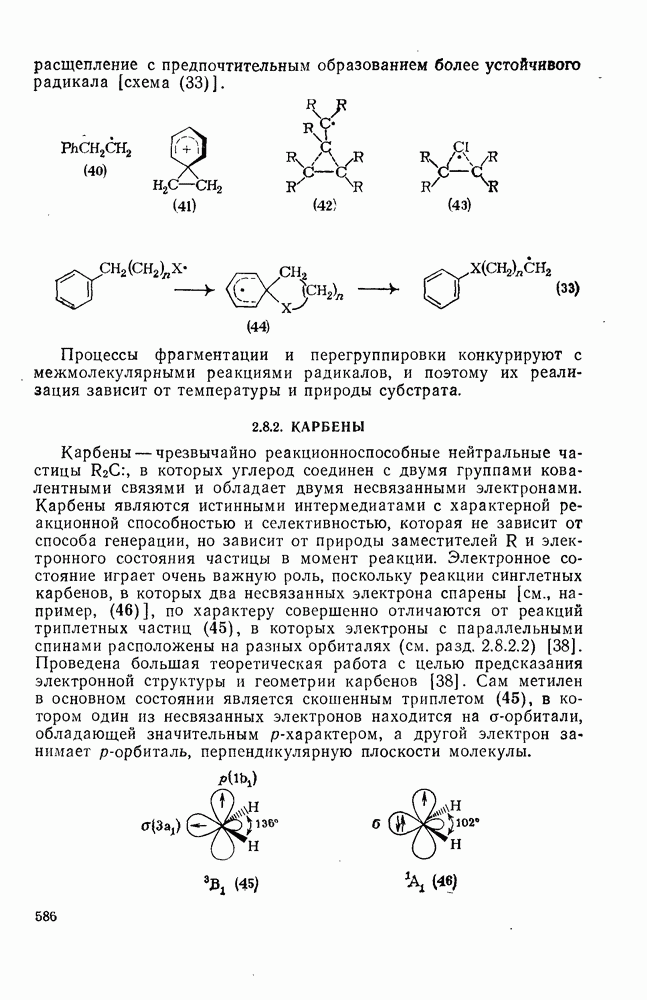
- 2.8. РАДИКАЛЫ, КАРБЕНЫ, АРИНЫ
- 2.8.1. РАДИКАЛЫ
- 2.8.1.1. Структура, устойчивость и реакционная способность радикалов
- 2.8.1.2. Методы генерации и реакции радикалов
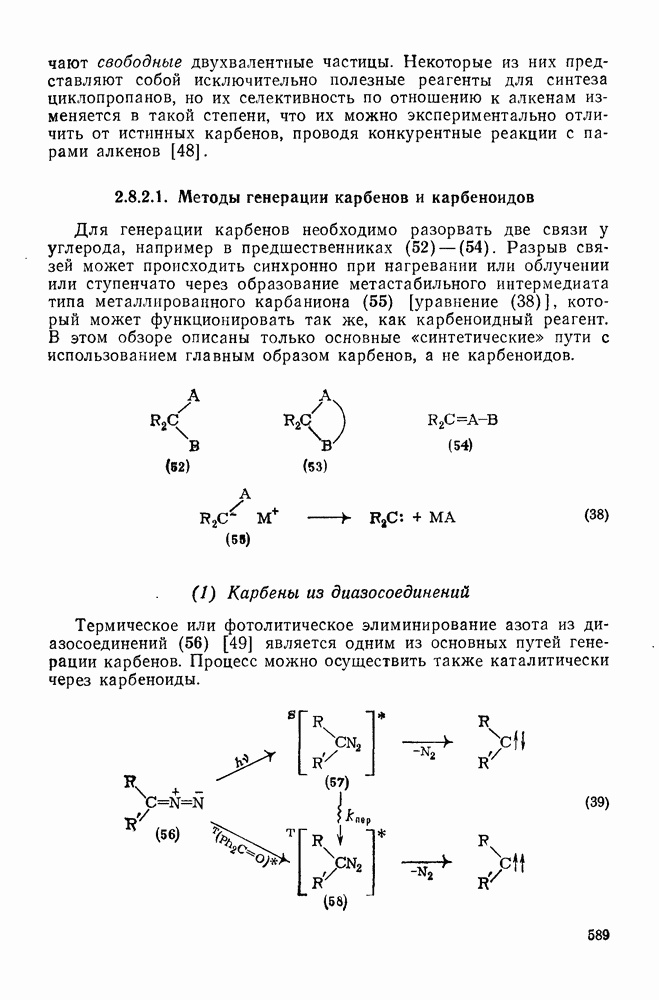
- 2.8.2. КАРБЕНЫ
- 2.8.2.1. Методы генерации карбенов и карбеноидов
- 2.8.2.2. Реакции карбенов
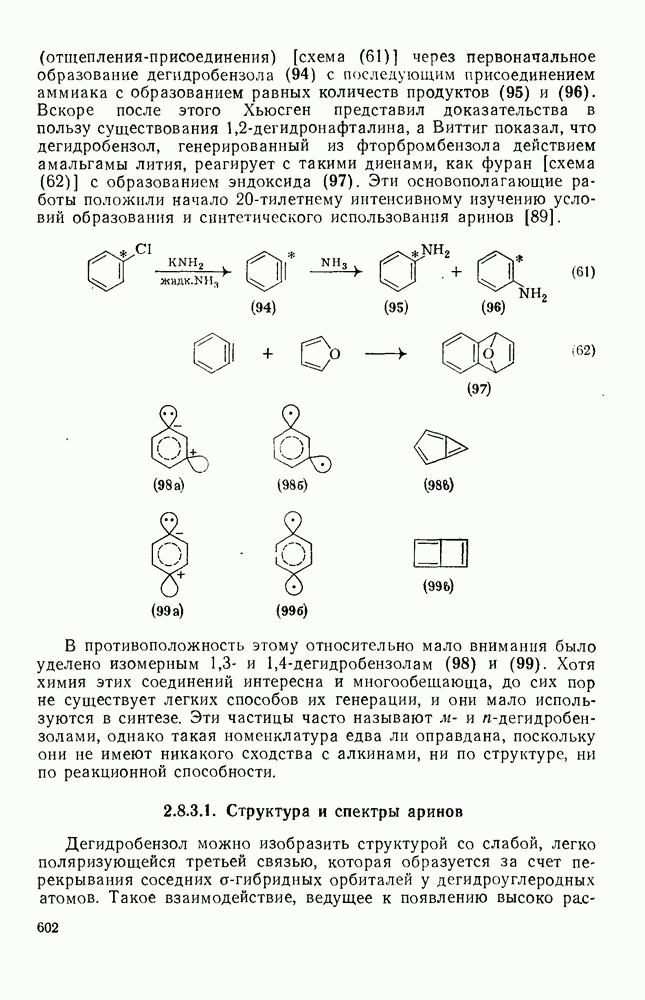
- 2.8.3. АРИНЫ
- 2.8.3.1. Структура и спектры аринов
- 2.8.3.2. Методы генерации аринов
- 2.8.3.3. Реакции аринов
- ЧАСТЬ 3. ГАЛОГЕНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
- 3.2. МЕТОДЫ ГАЛОГЕНИРОВАНИЯ
- 3.2.1. Гомолитическое замещение водорода
- 3.2.1.2. Использование галогенпроизводных в качестве реагентов
- 3.2.2. Гомолитическое замещение функциональных групп
- 3.2.3. Гомолитическое присоединение к ненасыщенным системам
- 3.2.3.1. Присоединение галогеноводородов
- 3.2.3.2. Присоединение галогенов
- 3.2.4. Электрофильное галогенирование
- 3.2.4.1. Замещение у насыщенной связи С-Н
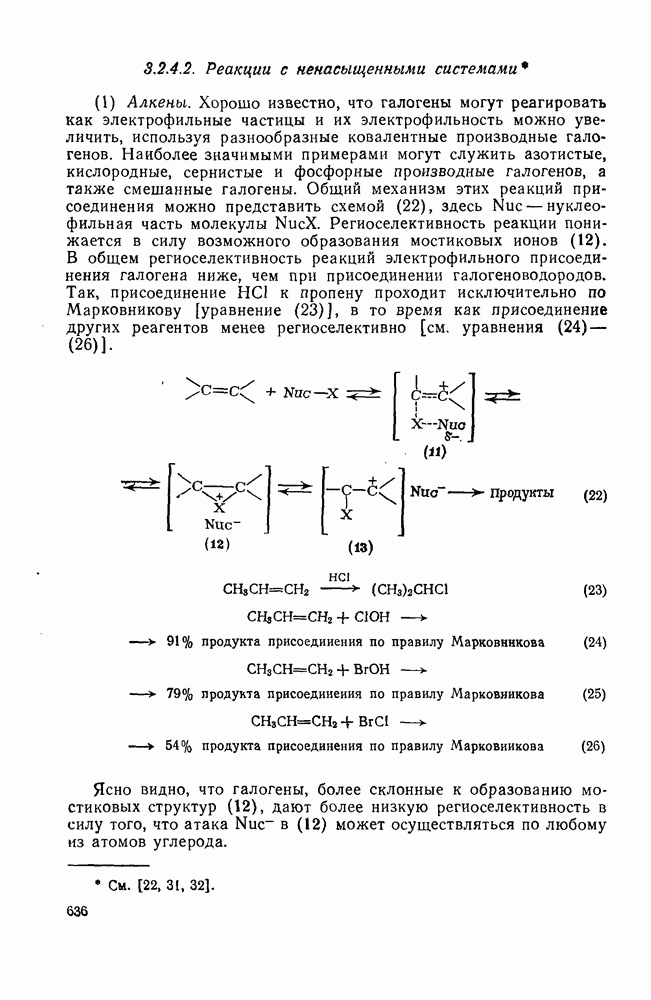
- 3.2.4.2. Реакции с ненасыщенными системами
- 3.2.4.3. Реакции с карбанионами
- 3.2.5. Нуклеофильное галогенирование
- 3.2.5.1. Галогенирование с замещением функциональной группы
- 3.2.5.2. Галогенирование в ароматических системах
- 3.2.5.3. Галогенирование путем обмена галогенов
- 3.2.6. Синтез полигалогенированных соединений
- 3.2.6.1. Синтез полифторированных соединений
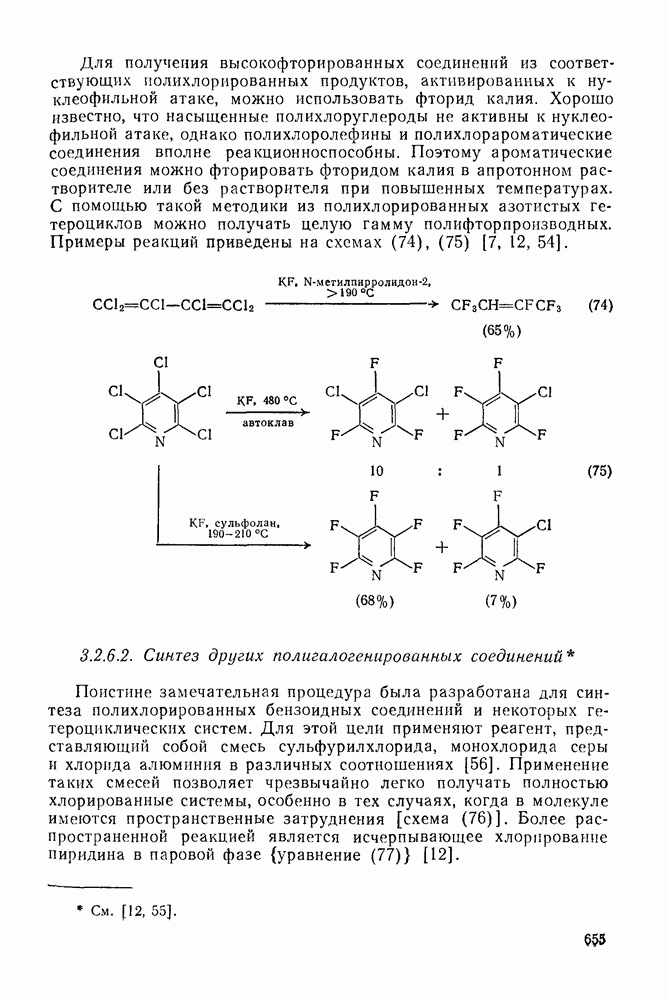
- 3.2.6.2. Синтез других полигалогенированных соединений
- 3.3. ГАЛОГЕНАЛКАНЫ
- 3.3.1. Характеристика связей углерод-галоген
- 3.3.2. Промышленное применение
- 3.3.3. Нуклеофильное замещение галогена
- 3.3.3.1. Реакции SN2 и родственные процессы
- 3.3.3.2. Соучастие соседних групп
- 3.3.3.3. Реакции SN1 и относительно долгоживущие карбениевые ионы
- 3.3.3.4. Галогенониевые ионы
- 3.3.3.5. Галогенсодержащие карбениевые ионы
- 3.3.3.6. Механизм замещения с переносом электрона
- 3.3.4. Восстановление
- 3.3.5. Замещение на металлы
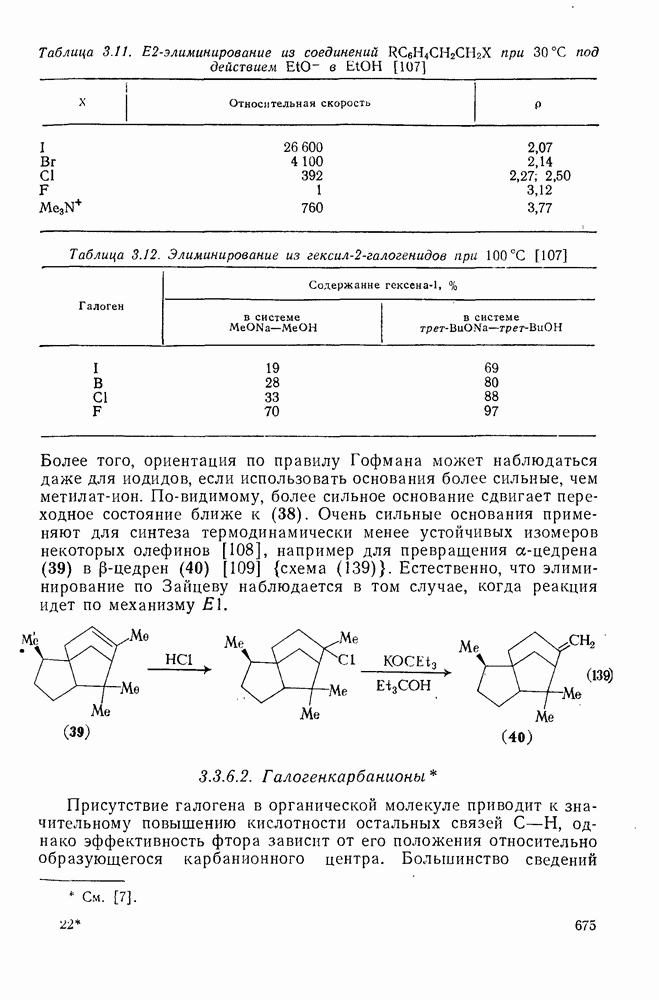
- 3.3.6. Элиминирование
- 3.3.6.1. b-Элиминирование
- 3.3.6.2. Галогенкарбанионы
- 3.3.6.3. Элиминирование через карбанионы
- 3.3.6.4. b-Элиминирование из металлорганических соединений
- 3.3.6.5. a-Элиминирование (генерирование карбенов)
- 3.4. ГАЛОГЕНАЛКЕНЫ
- 3.4.1. Синтез галогеналкенов
- 3.4.2. Нуклеофильная атака
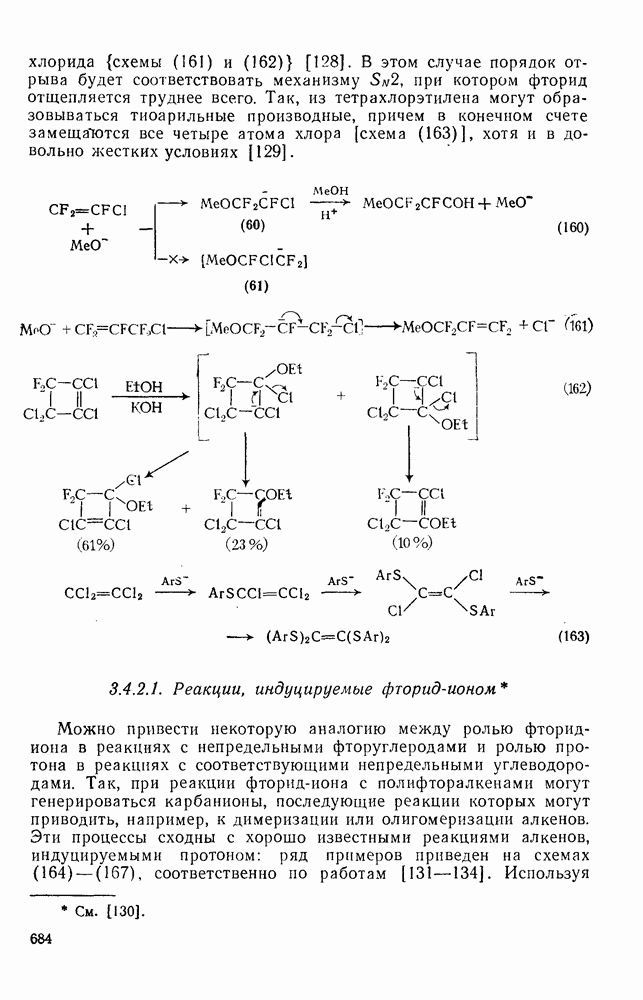
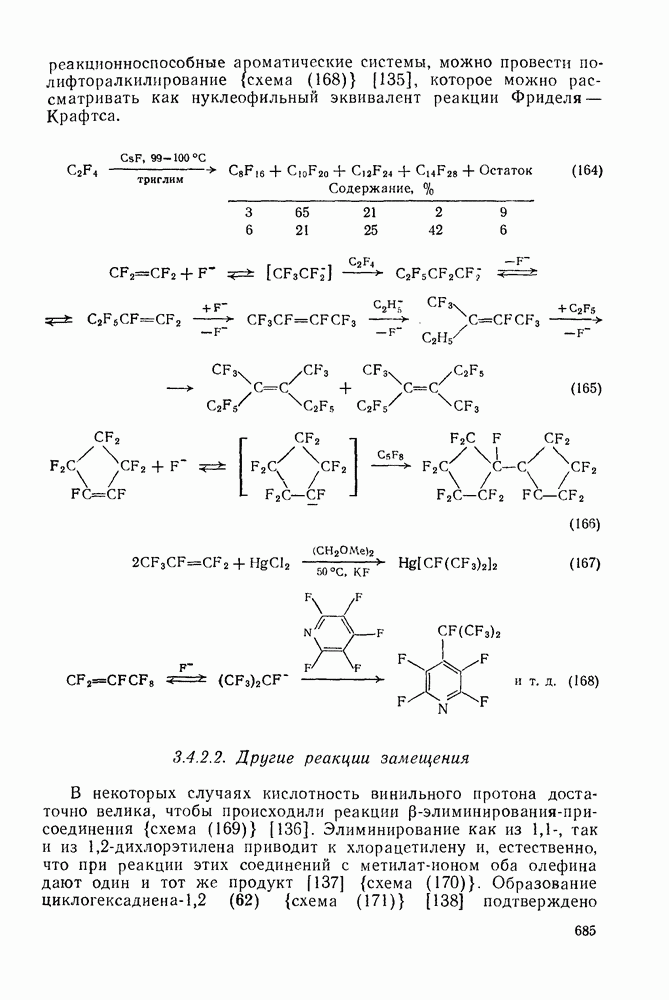
- 3.4.2.1. Реакции, индуцируемые фторид-ионом
- 3.4.2.2. Другие реакции замещения
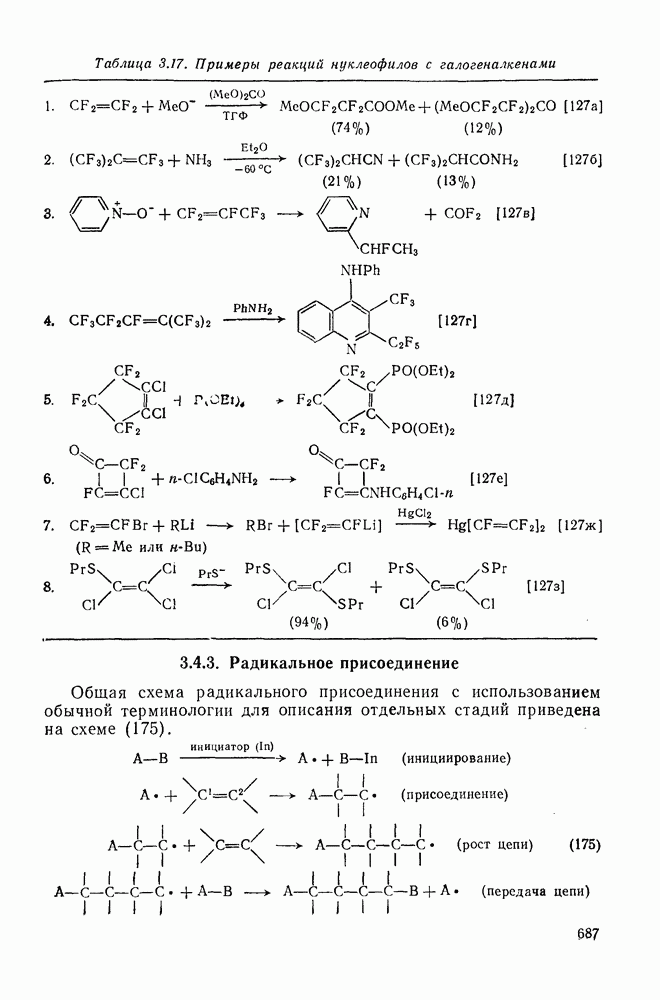
- 3.4.3. Радикальное присоединение
- 3.4.4. Электрофильное присоединение
- 3.4.5. Циклоприсоединение
- 3.4.5.1. [2+2]-Циклоприсоединение
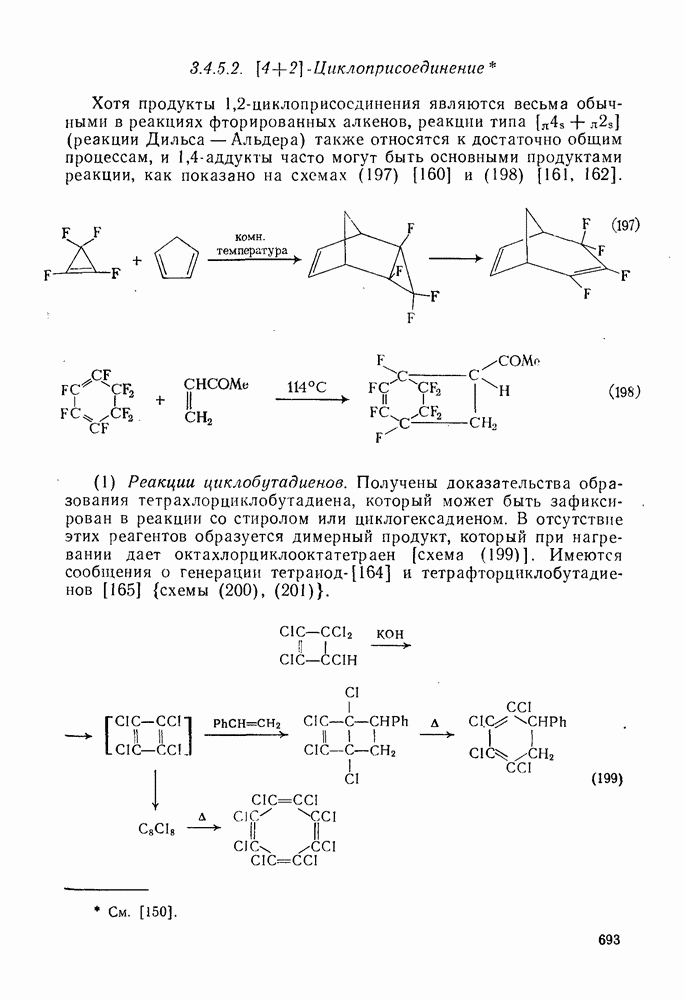
- 3.4.5.2. [4+2]-Циклоприсоединение
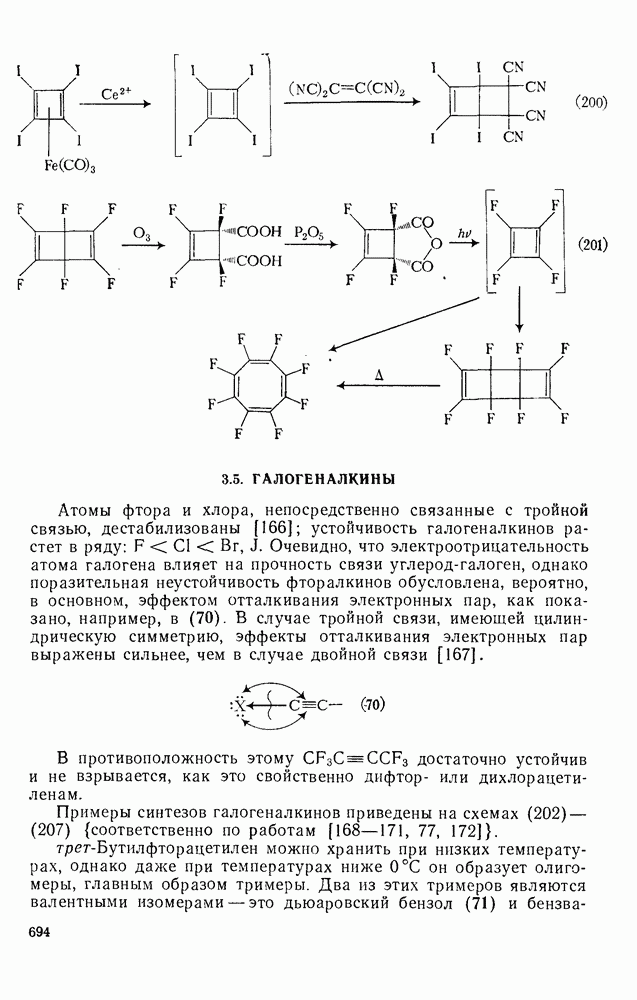
- 3.5. ГАЛОГЕНАЛКИНЫ
- 3.6. ГАЛОГЕНАРЕНЫ
- 3.6.1. Замещение галогена
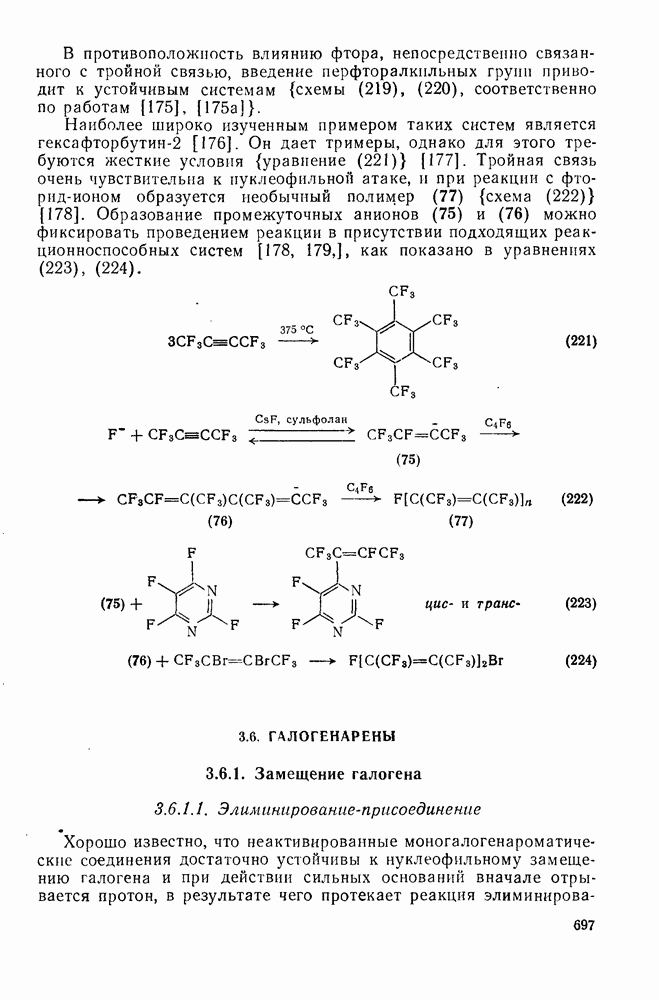
- 3.6.1.2. Присоединение-элиминирование
- 3.6.1.3. Нуклеофильная атака на галоген
- 3.6.1.4. Перенос электрона
- 3.6.2. Перегруппировки
- 3.6.2.1. Перегруппировки под действием кислот Льюиса
- 3.6.2.2. Образование валентных изомеров