| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 70. Внутренняя энергия газа
Свойства одноатомных газов определяются кинетической энергией поступательного движения молекул. Внутренняя энергия атома не сказывается на термодинамике газа. Очевидно, учет внутренней энергии атома может стать нужным лишь в тех случаях, когда газ находится при очень высокой температуре и когда столкновения атомов могут привести к их возбуждению и. ионизации. Об этих процессах в свое время у нас будет подробная речь.
Таким образом, весьма широкую применимость будет иметь формула внутренней энергии одноатомного газа

где  число молекул. Воспользовавшись формулами предыдущего параграфа, получим для I моля идеального одноатомного газа выражение
число молекул. Воспользовавшись формулами предыдущего параграфа, получим для I моля идеального одноатомного газа выражение

Отсюда для теплоемкостей 1 моля одноатомного газа получим по формулам, приведенным в § 60:

и

Прямая пропорциональность температуре внутренней энергии и соответственно постоянство теплоемкостей одноатомного газа имеют место в довольно широком интервале внешних условий.
У многоатомных газов такая простая картина если и имеет место, то в значительно более узком интервале температур. Причина заключается в том, что энергия многоатомной молекулы складывается из энергии поступательного движения, энергии вращения и энергии колебания частей молекулы (т. е. атомов, из которых она построена) друг по отношению к другу. Подсчет средней энергии, приходящейся на молекулу довольно сложным. Оказывается, что энергия молекулы уже не будет линейно зависеть от температуры и соответственно теплоемкость газа уже не будет постоянной, не зависящей от  величиной. Все же обычно удается найти узкий интервал температур, внутри которого теплоемкость газа не зависит от температуры. Это имеет место при таких значениях
величиной. Все же обычно удается найти узкий интервал температур, внутри которого теплоемкость газа не зависит от температуры. Это имеет место при таких значениях
температуры, при которых средняя энергия молекулы еще недостаточна для того, чтобы соударения молекулы могли привести к изменению ее колебательного состояния, и в то же время эта энергия достаточно велика, чтобы не чувствовался дискретный (квантовый) характер энергии вращения. Забегая вперед и отсылая читателя к рис. 266 (стр. 577), можно сказать, что линейный ход энергии с температурой и постоянство теплоемкости будут иметь место в том случае, если величина  характеризующая по порядку величины энергию поступательного движения молекулы, существенно больше расстояния между вращательными уровнями энергии и меньше расстояния между колебательными уровнями энергии.
характеризующая по порядку величины энергию поступательного движения молекулы, существенно больше расстояния между вращательными уровнями энергии и меньше расстояния между колебательными уровнями энергии.
Если такой интервал существует, то энергия моля газа и его теплоемкости выражаются следующими простыми формулами:

Возрастание внутренней энергии и  вдвое по отношению к одноатомному газу можно толковать следующим образом. У многоатомной молекулы шесть степеней свободы, в то время как у одноатомной — три. Увеличение вдвое числа степеней свободы влечет за собой увеличение вдвое внутренней энергии. Конечно, в этом утверждении нет ничего само собой разумеющегося. Однако мы находим подтверждение этой точке зрения, рассматривая газ двухатомных молекул.
вдвое по отношению к одноатомному газу можно толковать следующим образом. У многоатомной молекулы шесть степеней свободы, в то время как у одноатомной — три. Увеличение вдвое числа степеней свободы влечет за собой увеличение вдвое внутренней энергии. Конечно, в этом утверждении нет ничего само собой разумеющегося. Однако мы находим подтверждение этой точке зрения, рассматривая газ двухатомных молекул.

Рис. 84.
Поскольку двухатомная молекула — это система из двух материальных точек, то она обладает пятью степенями свободы (см. стр. 36). Если действительно внутренняя энергия пропорциональна числу степеней свободы, то для газа двухатомных молекул должны иметь место формулы

Опыт показывает, что в участке температур, где теплоемкость остается неизменной, эти формулы хорошо выполняются. Внутренняя энергия одного моля двухатомного газа при комнатной температуре 300 К будет 
Типичный ход кривой теплоемкости в широком интервале температур иллюстрируется рис. 84.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ЧАСТЬ I. МЕХАНИЧЕСКОЕ И ТЕПЛОВОЕ ДВИЖЕНИЕ
- Уравнения движения материальной точки.
- Средняя скорость.
- Истинная скорость.
- Векторное ускорение.
- § 2. Силы
- Гравитационные силы.
- Электромагнитные силы.
- Ядерные силы.
- Силы «слабого» взаимодействия.
- Поле сил.
- § 3. Основной закон механики
- Законы Ньютона.
- Относительность движения.
- Законы механики в неинерциальной системе координат.
- § 4. Приложение основного закона механики к ускоренному прямолинейному движению
- Горизонтальное движение под действием постоянной силы.
- Вертикально движущийся лифт.
- Тяга свободно подвешенного груза.
- § 5. Приложение основного закона механики к движению по окружности
- § 6. Влияние вращения Земли на механические явления
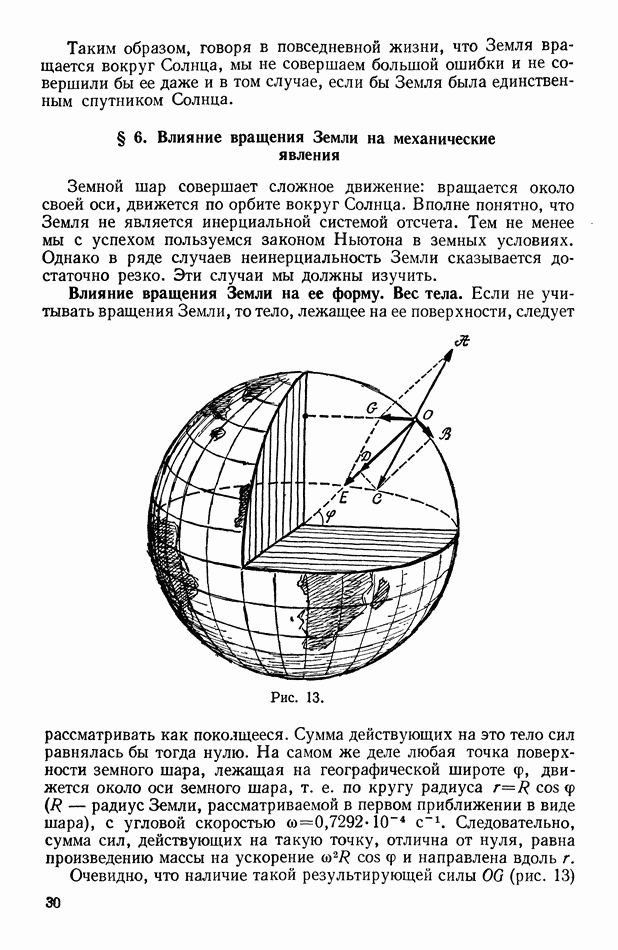
- Влияние вращения Земли на ее форму. Вес тела.
- Влияние вращения Земли на движение тел по земной поверхности.
- § 7. Какие данные необходимы для решения механической задачи?
- § 8. Коэффициенты пропорциональности в формулах физики и размерности физических величин
- ГЛАВА 2. МЕХАНИЧЕСКАЯ ЭНЕРГИЯ
- § 9. Работа
- § 10. Кинетическая энергия
- § 11. Потенциальная энергия
- § 12. Закон сохранения механической энергии
- § 13. Потенциальные кривые. Равновесие
- ГЛАВА 3. ИМПУЛЬС
- § 14. Сохранение импульса
- § 15. Центр инерции
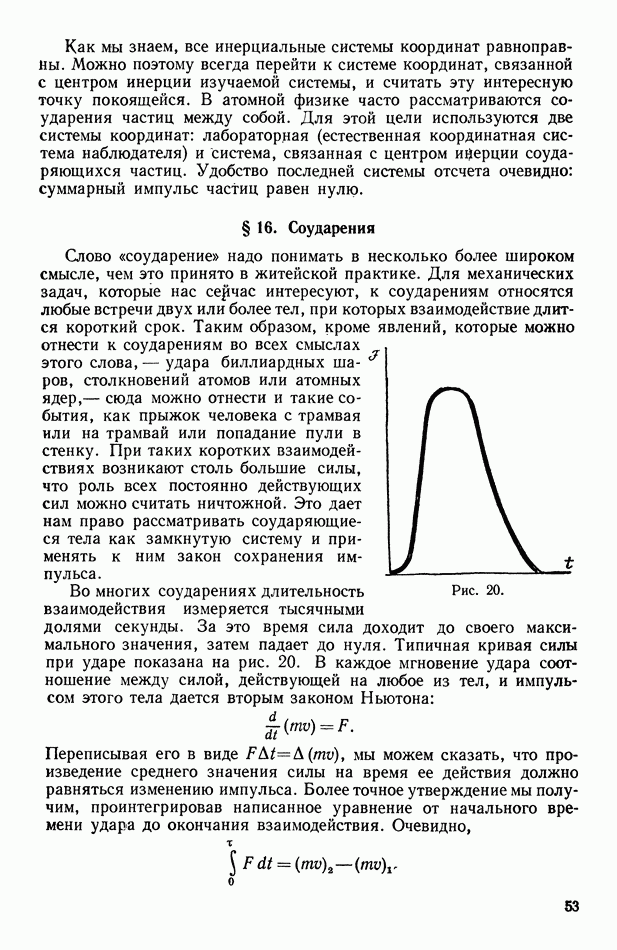
- § 16. Соударения
- § 17. Явления отдачи
- ГЛАВА 4. ВРАЩЕНИЕ ТВЕРДОГО ТЕЛА
- § 18. Кинетическая энергия вращения
- § 19. Момент инерции
- § 20. Работа вращения и основное уравнение вращения
- § 21. Момент импульса
- § 22. Свободные оси вращения
- § 23. Гироскопы
- ГЛАВА 5. КОЛЕБАНИЯ
- § 24. Малые отклонения от равновесия
- § 25. Частные случаи колебаний
- § 26. Превращения энергии. Затухающие колебания
- § 27. Вынужденные колебания
- § 28. Автоколебания
- § 29. Сложение колебаний одного направления
- § 30. Спектр колебания
- § 31. Сложение взаимно перпендикулярных колебаний
- ГЛАВА 6. БЕГУЩИЕ ВОЛНЫ
- § 32. Распространение деформации
- § 33. Возникновение волнового движения
- § 34. Волны давления и скорости колебания
- § 35. Поток энергии
- § 36. Затухание упругих волн
- § 37. Интерференция волн
- § 38. Принцип Гюйгенса — Френеля. Отражение и преломление волн
- § 39. Коэффициент отражения
- § 40. Явление Доплера
- ГЛАВА 7. СТОЯЧИЕ ВОЛНЫ
- § 41. Наложение двух волн, бегущих в противоположные стороны
- § 42. Собственные колебания стержней
- § 43. Собственные колебания двумерных и трехмерных систем
- § 44. Вынужденные колебания стержней и пластинок
- § 45. Колебания пьезоэлектриков
- ГЛАВА 8. ВОПРОСЫ АКУСТИКИ
- § 46. Объективная и субъективная характеристики звука
- § 47. Сила и громкость звука
- § 48. Архитектурная акустика
- § 49. Атмосферная акустика
- § 50. Действие ультразвука
- ГЛАВА 9. ТЕМПЕРАТУРА И ТЕПЛОТА
- § 51. Тепловое равновесие
- § 52. Внутренняя энергия
- § 53. Первое начало термодинамики
- § 54. Энергия микроскопических систем
- § 55. Уравнение состояния
- § 56. Уравнение газового состояния
- § 57. Уравнения состояния реальных газов
- ГЛАВА 10. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
- § 58. Графическое изображение процессов
- § 59. Работа. Циклы
- § 60. Процессы изменения состояния газов
- Изобарический процесс.
- Изотермический процесс.
- Адиабатический процесс.
- Измерение теплоемкостей газов.
- § 61. Процесс Джоуля — Томсона
- ГЛАВА 11. ЭНТРОПИЯ
- § 62. Принцип существования энтропии
- § 63. Принцип возрастания энтропии
- § 64. Принцип действия тепловой машины
- § 65. Цикл Карно. Максимальный к. п. д.
- § 66. Второе начало термодинамики
- ГЛАВА 12. КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
- § 68. Длина свободного пробега
- § 69. Давление газа. Средняя квадратичная скорость молекул
- § 70. Внутренняя энергия газа
- § 71. Статистическое распределение
- § 72. Закон Больцмана
- § 73. Распределение частиц по высоте в поле тяжести
- § 74. Распределение молекул по скоростям
- § 75. Измерение скоростей молекул газа
- § 76. Вероятность состояния
- § 77. Необратимые процессы с молекулярной точки зрения
- § 78. Флуктуации. Границы применения второго начала
- ГЛАВА 13. ПРОЦЕССЫ ПЕРЕХОДА К РАВНОВЕСИЮ
- § 79. Диффузия
- § 80. Теплопроводность и вязкость
- § 81. Быстрота выравнивания
- § 82. Стационарные процессы
- § 83. Движение в вязкой среде
- § 84. Коэффициенты диффузии, вязкости и теплопроводности для газов
- § 85. Ультраразреженные газы
- ЧАСТЬ II. ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ
- § 86. Векторные характеристики электрического поля: напряженность и смещение
- § 87. Диэлектрическая проницаемость
- § 88. Законы электрического поля
- § 89. Вычисление полей простейших систем
- Система точечных зарядов.
- Универсальные формулы потенциала.
- Поле сферического конденсатора.
- Поле равномерно заряженной сферы.
- Поле с цилиндрической симметрией.
- Однородные поля.
- Поле на поверхности металла.
- Электрическое изображение.
- § 90. Электрическая энергия
- Энергия конденсатора.
- Энергия поля
- Энергия взаимодействия.
- § 91. Радиус электрона и границы классической электродинамики
- § 92. Электрические силы
- § 93. Дипольный момент системы зарядов
- § 94. Поляризация изотропного диэлектрика
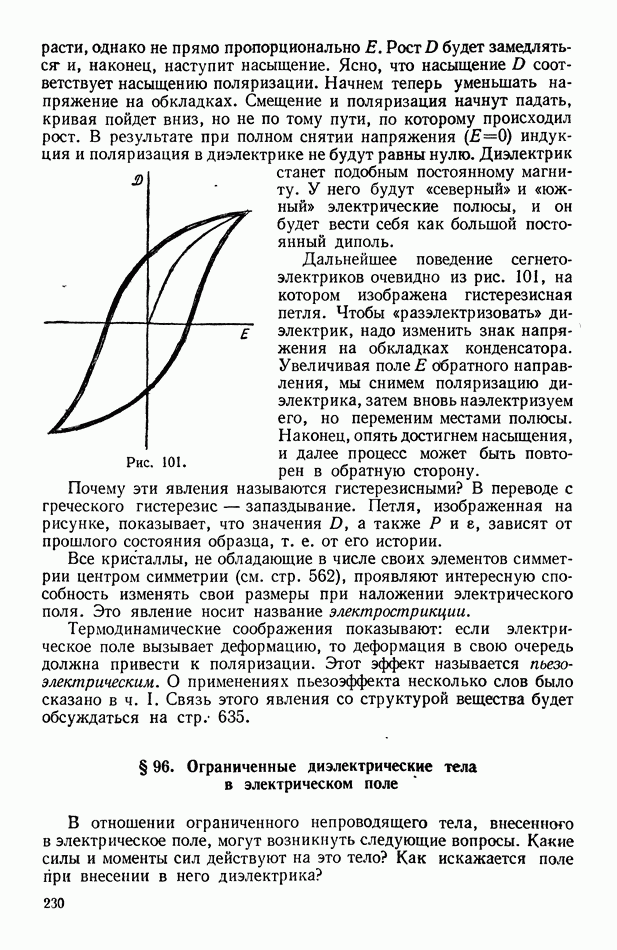
- § 95. Поляризация кристаллических веществ
- § 96. Ограниченные диэлектрические тела в электрическом поле
- ГЛАВА 15. МАГНИТНОЕ ПОЛЕ
- § 97. Магнитный момент
- § 98. Сила Ампера
- § 99. Сила, действующая на движущийся заряд
- § 100. Магнитное поле, создаваемое постоянными магнитами
- § 101. Напряженность магнитного поля
- § 102. Взаимодействия токов и магнитов
- § 103. Эквивалентность токов и магнитов
- § 104. Вихревой характер магнитного поля
- § 105. Закон электромагнитной индукции и сила Лоренца
- § 106. Измерения магнитного поля методом индукционного толчка
- § 107. Ограниченные тела в магнитном поле
- § 108. Связь между магнитной проницаемостью и восприимчивостью
- § 109. Искажение магнитного поля при внесении в него магнетика
- § 110. Магнитный гистерезис
- ГЛАВА 16. ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ. УРАВНЕНИЯ МАКСВЕЛЛА
- § 111. Обобщение закона электромагнитной индукции
- § 112. Ток смещения
- § 113. Картина электромагнитного поля
- ГЛАВА 17. ЭНЕРГЕТИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЭЛЕКТРОМАГНИТНОМ ПОЛЕ
- § 114. Превращения в цепи постоянного тока
- § 115. Превращения в замкнутой цепи переменного тока
- § 116. Магнитная энергия поля
- § 117. Электрические колебания
- § 118. Электромагнитная энергия
- § 119. Импульс и давление электромагнитного поля
- ГЛАВА 18. ЭЛЕКТРОМАГНИТНОЕ ИЗЛУЧЕНИЕ
- § 120. Элементарный диполь
- § 121. Антенна как электрический диполь
- § 122. Излучение диполя
- § 123. Электромагнитный спектр
- § 124. Квантовая природа излучения
- ГЛАВА 19. РАСПРОСТРАНЕНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- § 126. Поведение электромагнитной волны на границе двух сред
- § 127. Естественный и поляризованный свет. Поляризация при отражении
- § 128. Распространение световых волн в среде с градиентом показателя преломления
- § 129. Распространение радиоволн
- § 130. Радиолокация
- ГЛАВА 20. ИНТЕРФЕРЕНЦИОННЫЕ ЯВЛЕНИЯ
- § 131. Сложение волн от двух источников
- § 132. Когерентность
- § 133. Интерференция в пластинке
- § 134. Полосы равной толщины и полосы равного наклона
- § 135. Практические применения интерференции
- ГЛАВА 21. РАССЕЯНИЕ
- § 136. Вторичное излучение
- § 137. Дифракция волн на отверстиях
- § 138. Система беспорядочно расположенных рассеивателей
- § 139. Поведение сплошной однородной среды
- § 140. Рассеяние в неоднородной среде
- § 141. Дифракционная решетка
- § 142. Направленные излучатели радиоволн
- § 142а. Голография
- ГЛАВА 22. ДИФРАКЦИЯ РЕНТГЕНОВСКИХ ЛУЧЕЙ НА КРИСТАЛЛЕ
- § 143. Кристалл как дифракционная решетка
- § 144. Определение параметров элементарной ячейки кристалла
- § 145. Интенсивность дифракционных лучей
- § 146. Методы рентгеновского анализа
- ГЛАВА 23. ДВОЙНОЕ ЛУЧЕПРЕЛОМЛЕНИЕ
- § 147. Анизотропия поляризуемости
- § 148. Раснространение света в одноосных кристаллах
- § 149. Поляризаторы. Исследование поляризационного состояния света
- § 150. Кристаллическая пластинка между «скрещенными» николями
- § 151. Двойное лучепреломление, вызванное внешним воздействием
- § 152. Оптическая активность
- § 153. Принципы теории оптической активности
- ГЛАВА 24. ТЕОРИЯ ОТНОСИТЕЛЬНОСТИ
- § 155. Опытные подтверждения принципа постоянства скорости света
- § 156. Время в теории относительности
- § 157. Масса
- § 158. Энергия
- § 159. Дефект массы
- § 160. Принцип эквивалентности и понятие об общей теории относительности
- ГЛАВА 25. КВАНТОВАЯ ПРИРОДА ПОЛЯ
- § 161. Фотон
- § 162. Фотоэлектрический эффект
- § 163. Флуктуации светового потока
- § 164. Закон Кирхгофа
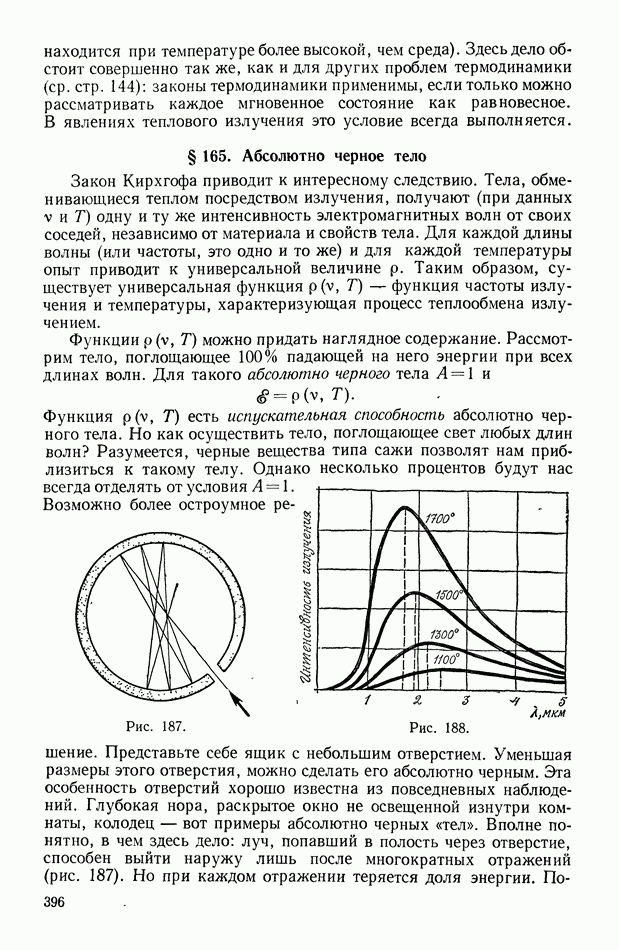
- § 165. Абсолютно черное тело
- § 166. Теория теплового излучения
- § 166а. Стимулированное излучение
- § 166б, Люминесценция
- ЧАСТЬ III. СТРОЕНИЕ И СВОЙСТВА ВЕЩЕСТВА
- § 167. Движение заряженной частицы в электрическом и магнитном полях
- § 168. Получение пучков заряженных частиц
- § 169. Электронные линзы
- § 170. Электронный микроскоп
- § 171. Электронные и ионные проекторы
- § 172. Электронно-лучевая трубка
- § 173. Масс-спектрограф
- § 174. Ускорители заряженных частиц
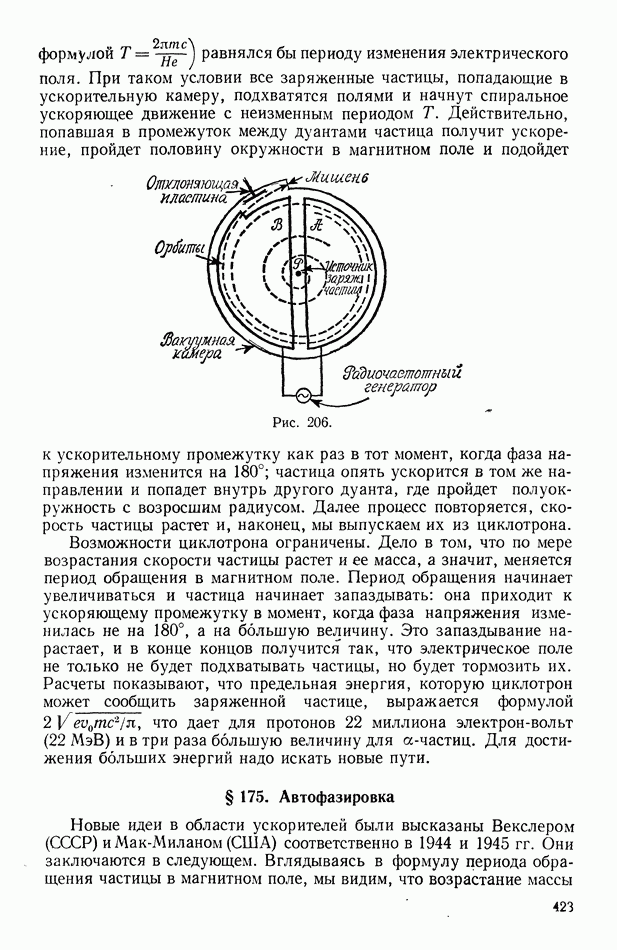
- § 175. Автофазировка
- § 176. Синхрофазотрон. Синхротрон
- § 177. Ионизованный газ
- § 178. Электрический разряд в газе
- § 178а. Плазма
- Вещество в состоянии плазмы.
- Плазма в магнитном поле.
- Проблемы устойчивости.
- ГЛАВА 27. ВОЛНОВЫЕ СВОЙСТВА МИКРОЧАСТИЦ
- § 179. Дифракция электронов
- § 180. Основные идеи квантовой механики
- § 181. Принцип неопределенности
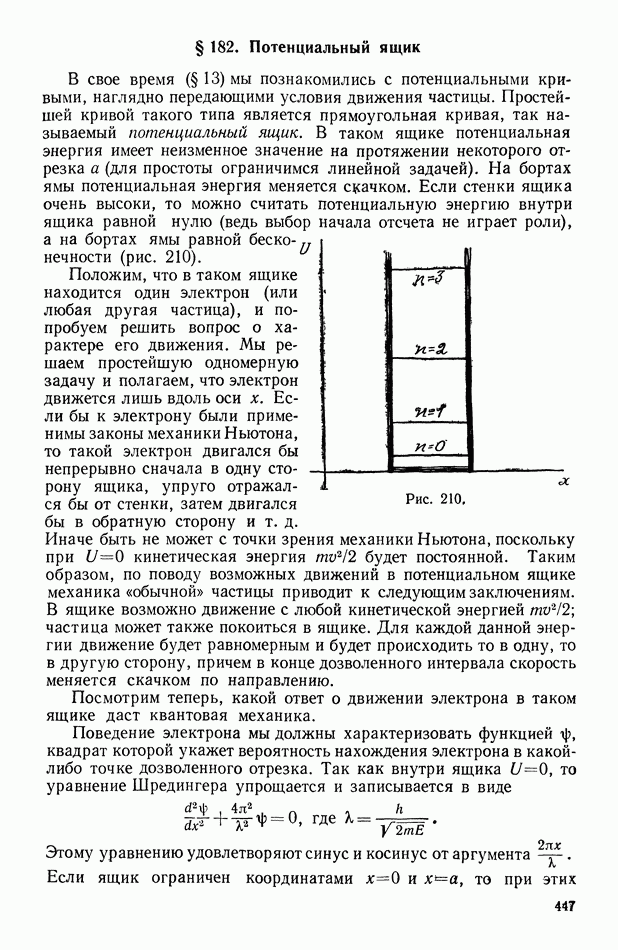
- § 182. Потенциальный ящик
- § 183. Что дает решение уравнения Шредингера
- § 184. Туннельный переход
- ГЛАВА 28. СТРОЕНИЕ АТОМА
- § 185. Энергетические уровни атома водорода
- § 186. Квантовые числа
- § 187. Электронное облако для s- и p-состояний
- § 188. Принцип Паули
- § 189. Отклонение атомного пучка в магнитном поле
- § 190. Спин электрона
- § 191. Магнитные моменты атомов
- § 192. Периодический закон Менделеева
- § 193. Ионизационные потенциалы
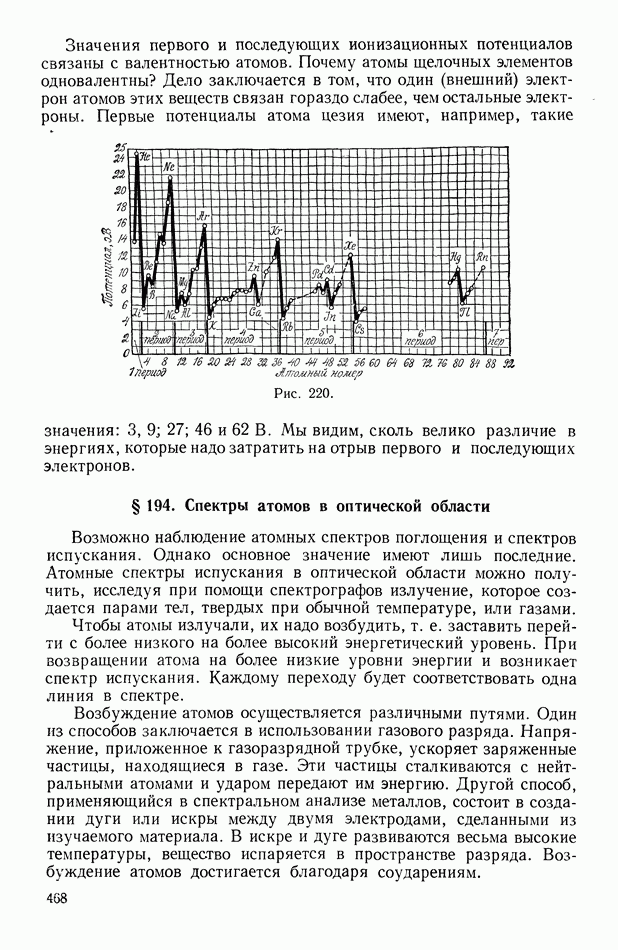
- § 194. Спектры атомов в оптической области
- § 195. Атомные рентгеновские спектры
- ГЛАВА 29. МОЛЕКУЛА
- § 196. Химическая связь
- § 197. Геометрия молекул
- § 198. Электронная оболочка молекулы
- § 199. Энергетические уровни молекул
- § 200. Вращательный спектр молекул
- § 201. Инфракрасный колебательно-вращательный спектр
- Колебания многоатомной молекулы.
- § 202. Комбинационное рассеяние света
- § 203. Электронный спектр поглощения
- § 204. Магнитный резонанс
- § 205. Квадрупольный резонанс
- § 206. Газовые лазеры
- ГЛАВА 30. АТОМНОЕ ЯДРО
- § 207. Экспериментальные методы ядерной физики
- § 208. Частицы, входящие в состав ядра
- § 209. Масса и энергия атомного ядра
- § 210. Спин и магнитный момент ядра
- § 211. Силы взаимодействия нуклонов
- § 212. Нуклоны в ядре
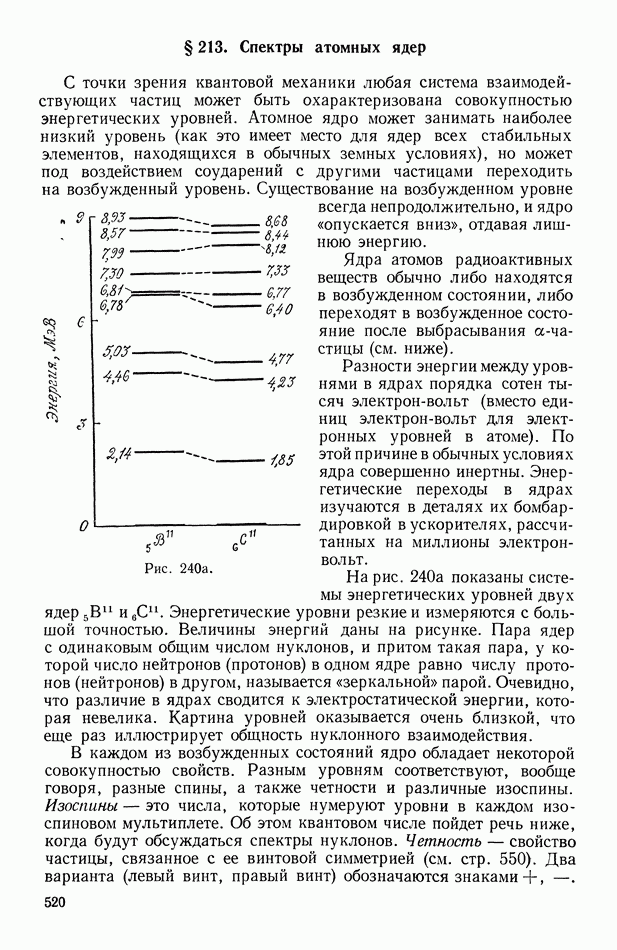
- § 213. Спектры атомных ядер
- § 214. Нейтрино бета-распада
- § 215. Общие закономерности химических и ядерных превращений
- § 216. Радиоактивность
- § 217. Ядерные реакции
- § 217а. Реакции деления тяжелых ядер
- § 217б. Цепная реакция
- § 217в. Принципы действия ядерного реактора
- § 217г. Искусственные радиоактивные продукты
- § 218. Термоядерные реакции
- ГЛАВА 31. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- § 219. Термин «элементарная» частица
- § 220. Взаимодействие быстродвижущихся электронов
- § 221. Мезонная теория взаимодействия нуклонов
- § 222. Мезоны
- § 223. Релятивистская теория электрона
- § 224. Рождение и аннигиляция пар частиц
- § 225. Частицы и античастицы
- § 226. Асимметрия элементарных частиц
- § 226а. Барионный спектр
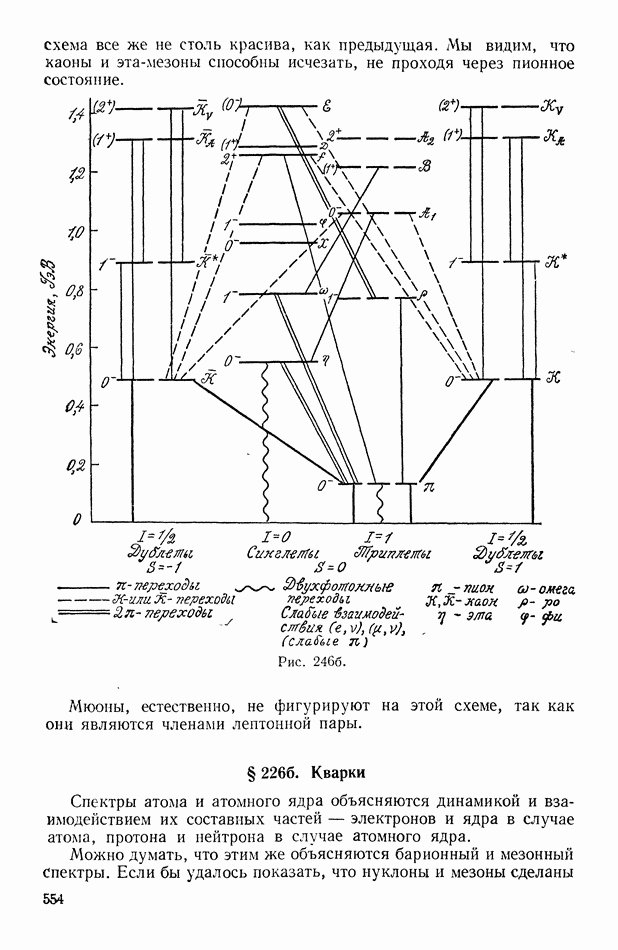
- § 2266. Кварки
- ГЛАВА 32. АТОМНОЕ СТРОЕНИЕ ТЕЛ
- § 227. Поликристаллическое вещество и монокристаллы
- § 228. Пространственная решетка
- § 229. Выбор ячейки. Симметрия кристалла
- § 230. Упаковка частиц в кристалле
- § 231. Молекулярный кристалл
- § 232. Плотные упаковки шаров
- § 233. Примеры кристаллических структур
- § 234. Тепловые колебания в кристалле
- § 235. Тепловые волны
- § 236. Тепловое расширение
- § 237. Дефекты кристалла
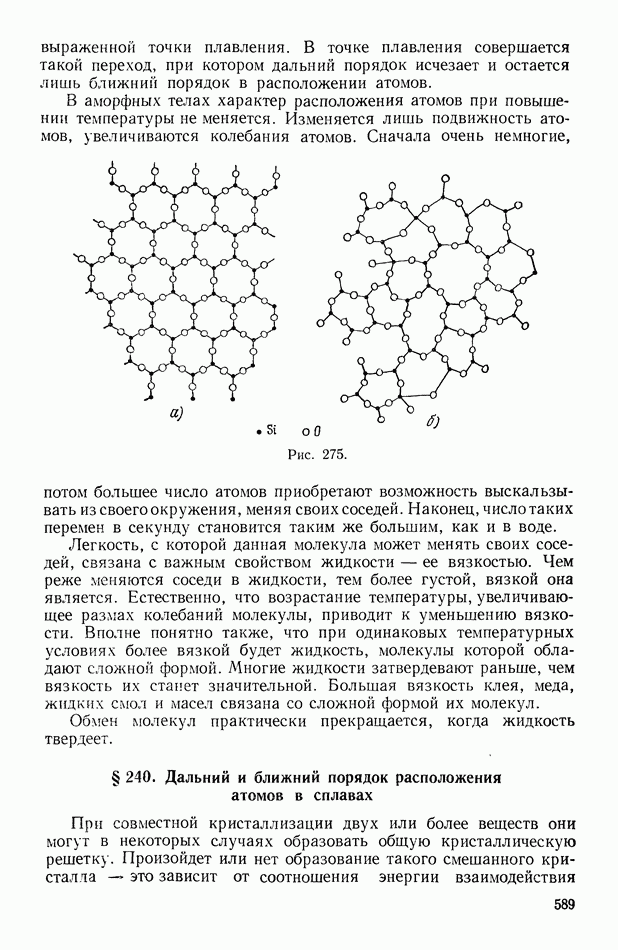
- § 238. Ближний порядок. Жидкости
- § 239. Аморфные тела
- § 240. Дальний и ближний порядок расположения атомов в сплавах
- § 241. Жидкие кристаллы
- § 242. Полимерные вещества
- § 242а. Биологические макромолекулы
- ГЛАВА 33. ФАЗОВЫЕ ПРЕВРАЩЕНИЯ
- § 244. Фазовые превращения
- § 244а. Диаграмма состояния и свойства гелия
- § 245. Условия устойчивого состояния фазы
- § 246. Метастабильные состояния
- § 247. Превращения газ жидкость
- § 248. Сжижение газов
- § 249. Превращения газ кристалл
- § 250. Превращения жидкость кристалл
- § 251. Превращения кристалл-кристалл
- § 252. Диффузия в твердых телах
- ГЛАВА 34. ДЕФОРМАЦИЯ ТЕЛ
- § 254. Пластические свойства
- § 255. Предел прочности
- § 256. Механические свойства поликристаллического материала
- § 257. Влияние поверхностно-активных веществ на деформацию
- § 258. Разрушение материалов под действием потока частиц
- ГЛАВА 35. ДИЭЛЕКТРИКИ
- § 259. Связь между диэлектрической проницаемостью и поляризуемостью молекулы
- § 260. Поляризация полярных и неполярных молекул
- § 261. Аддитивность молекулярной рефракции
- § 262. Пиро- и пьезоэлектрики
- § 262а. Сегнетоэлектрики
- ГЛАВА 36. МАГНЕТИКИ
- § 263. Три класса магнетиков
- § 264. Диамагнетизм
- § 265. Парамагнетизм
- § 266. Ферромагнетизм
- ГЛАВА 37. ЭЛЕКТРОННОЕ СТРОЕНИЕ И СВОЙСТВА ТЕЛ
- § 267. Свободные электроны
- § 268. Энергетические уровни в твердом теле
- § 269. Электронный газ
- § 270. Проводимость
- § 271. Сверхпроводимость
- § 272. Полупроводники
- § 273. Эмиссия электронов
- § 274. Фотоэлектрический эффект
- § 275. Запирающие слои
- § 276. Контактная разность потенциалов
- § 276a. Электролюминесценция полупроводников
- § 277. Распределение зарядов в неравномерно нагретом теле
- § 278. Термоэлектродвижущая сила
- § 279. Выделение тепла в электрических цепях
- § 280. Применения термоэлектрического эффекта