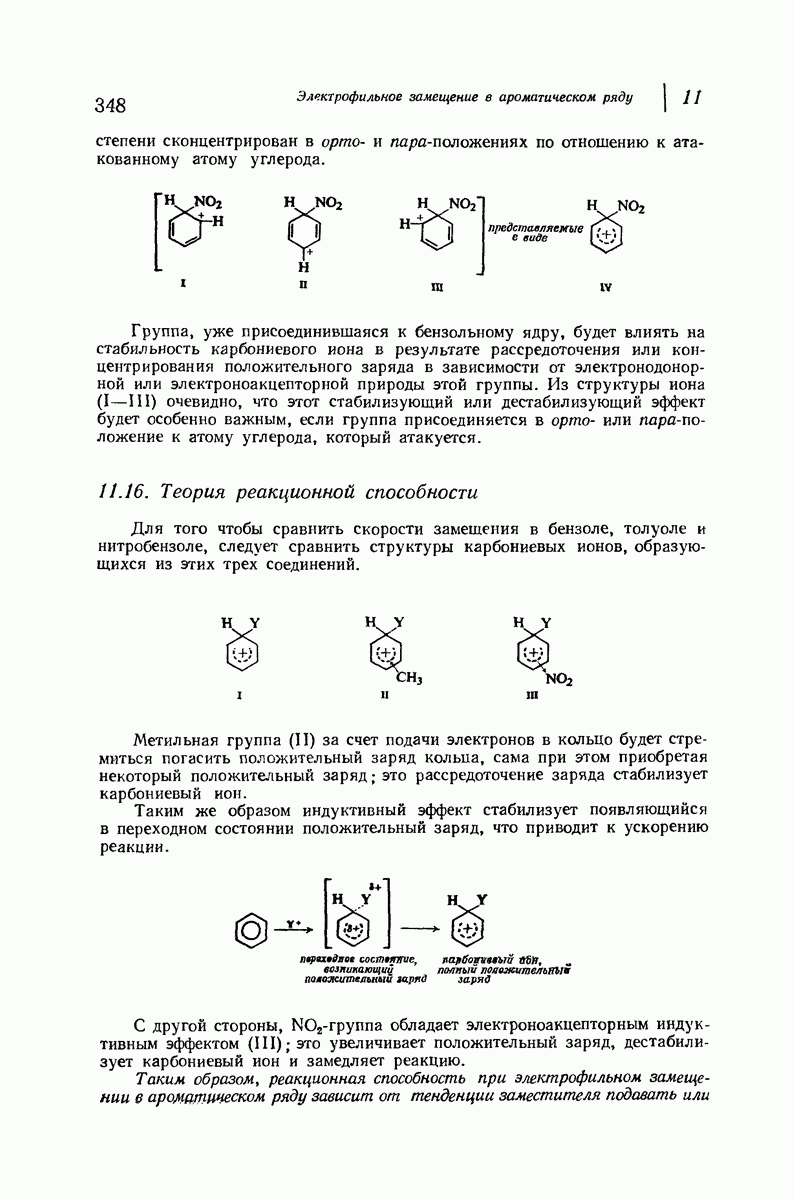
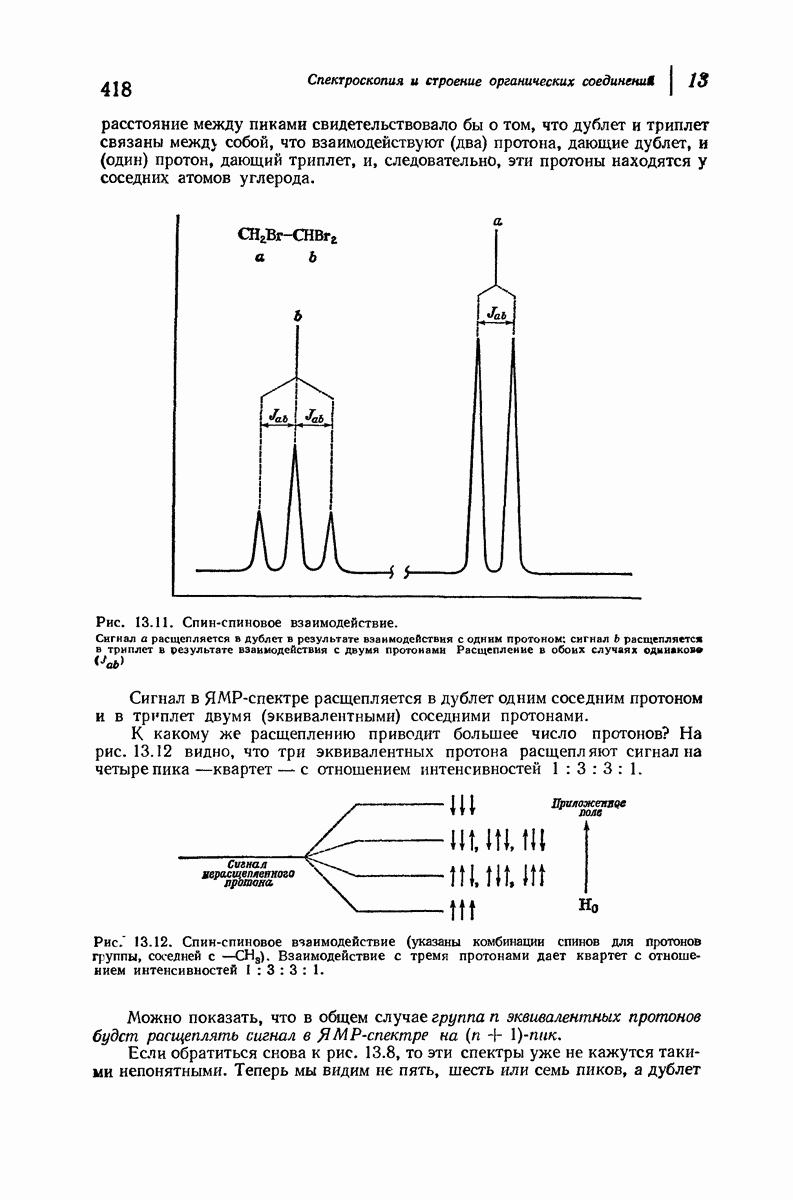
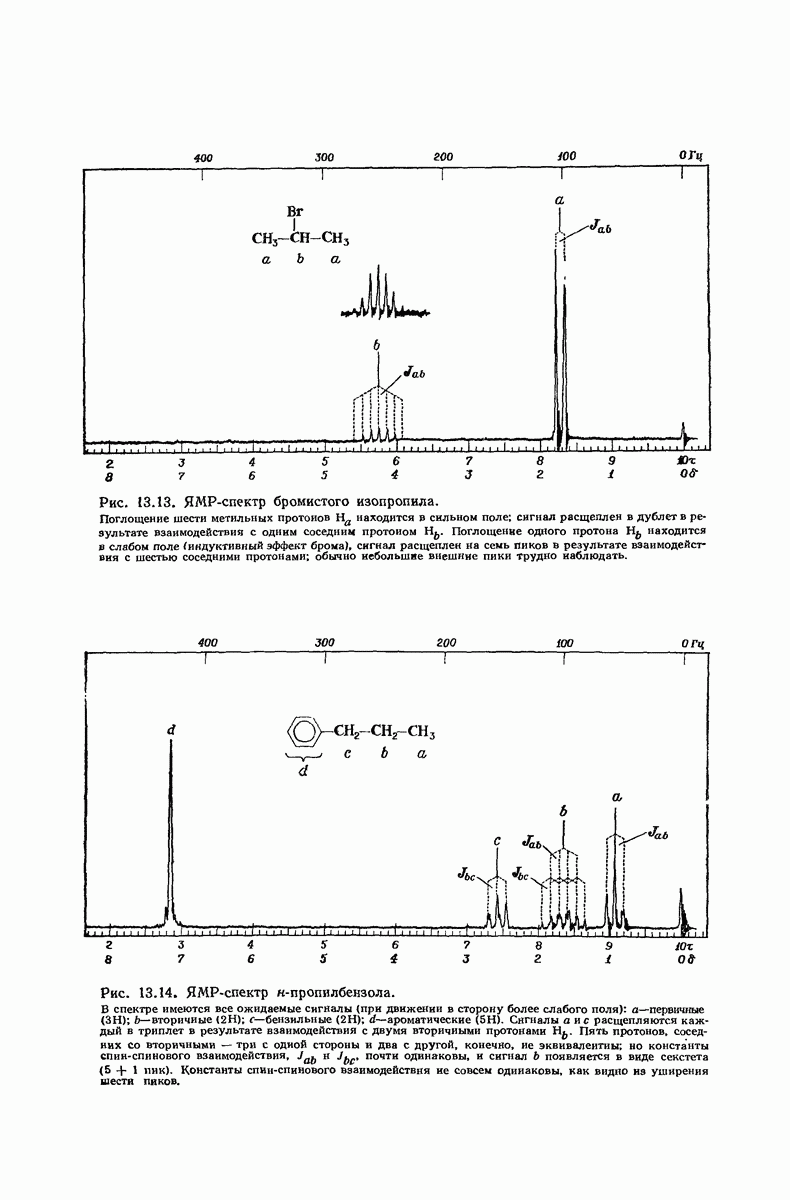
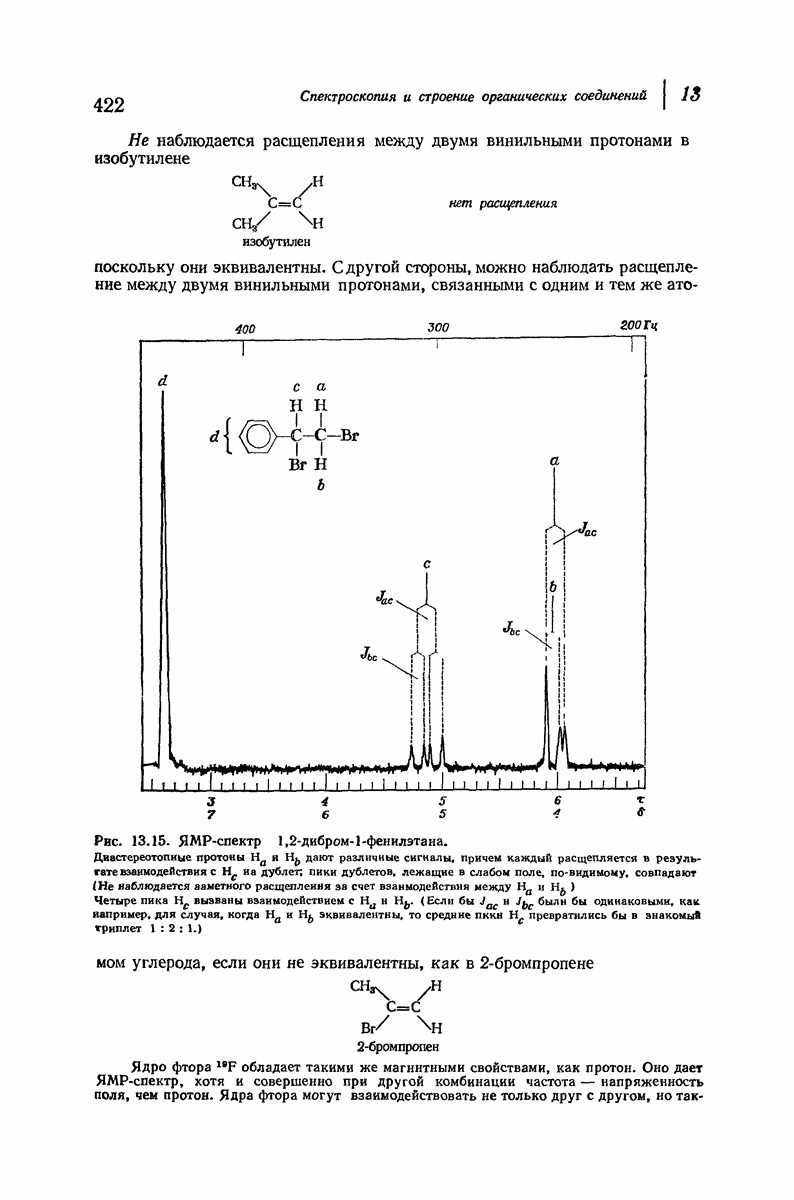
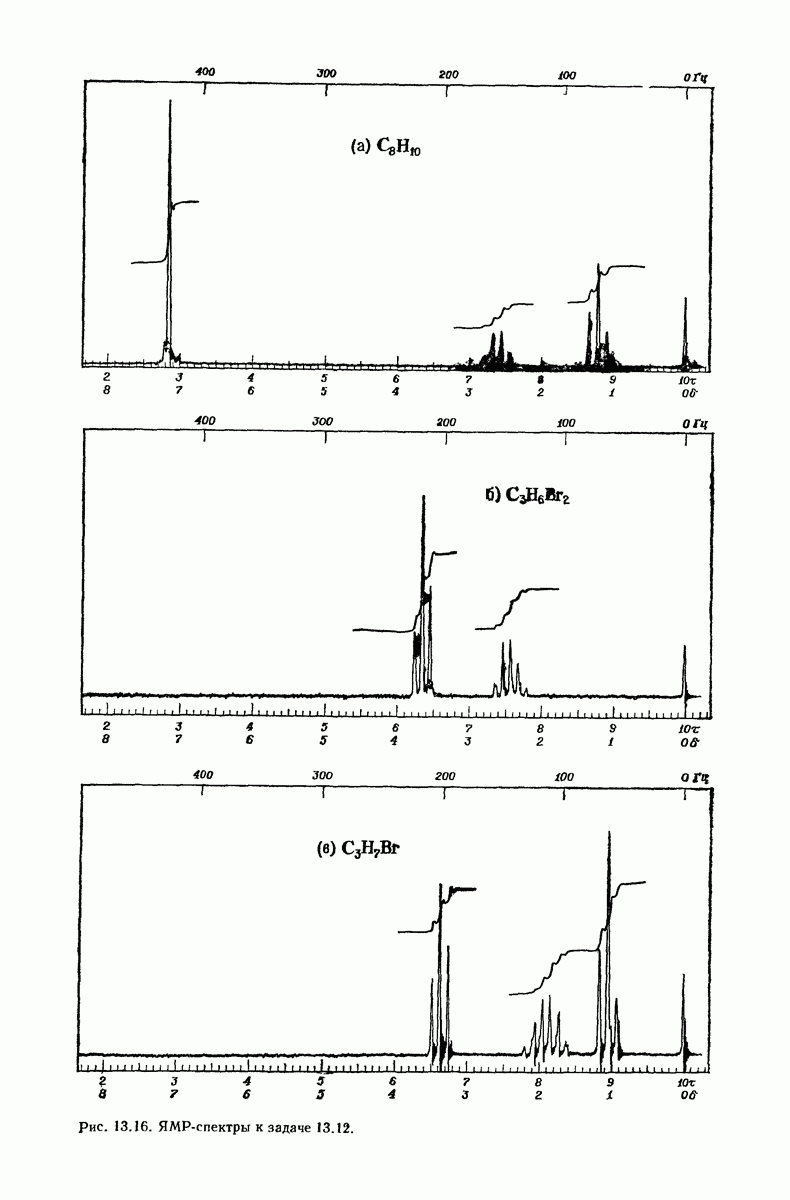
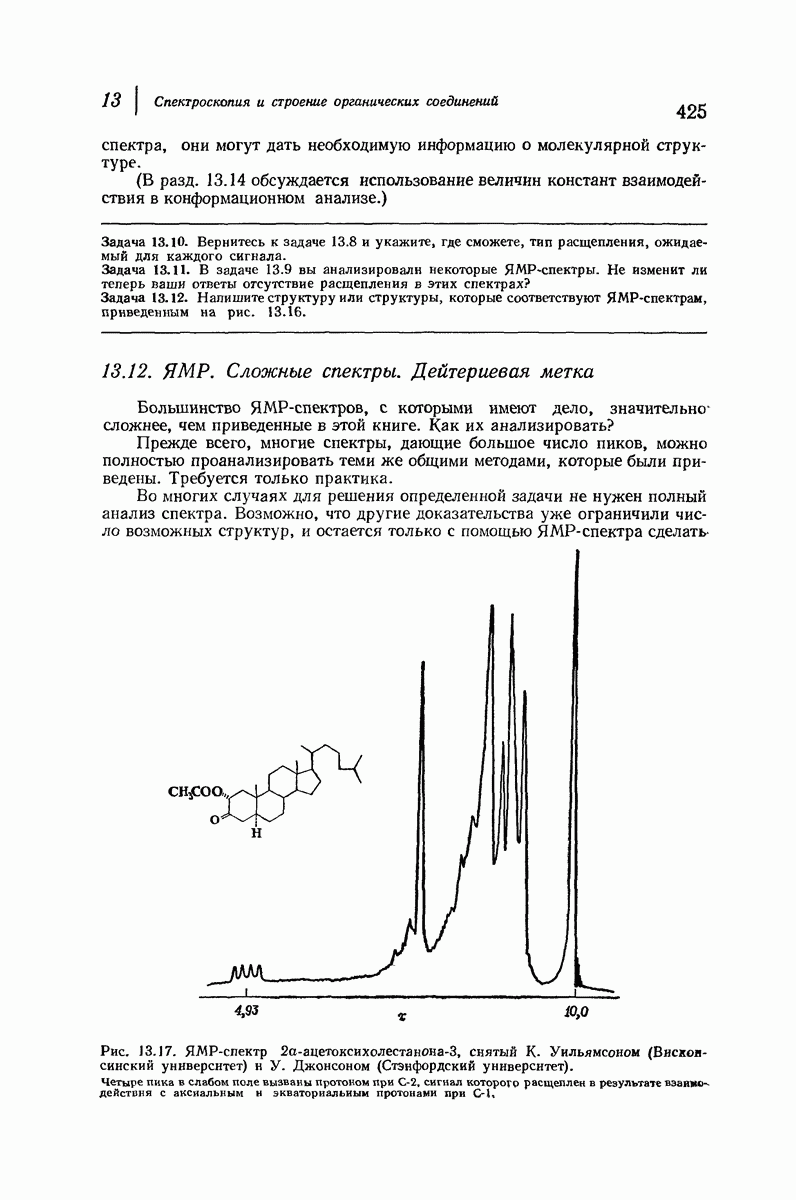
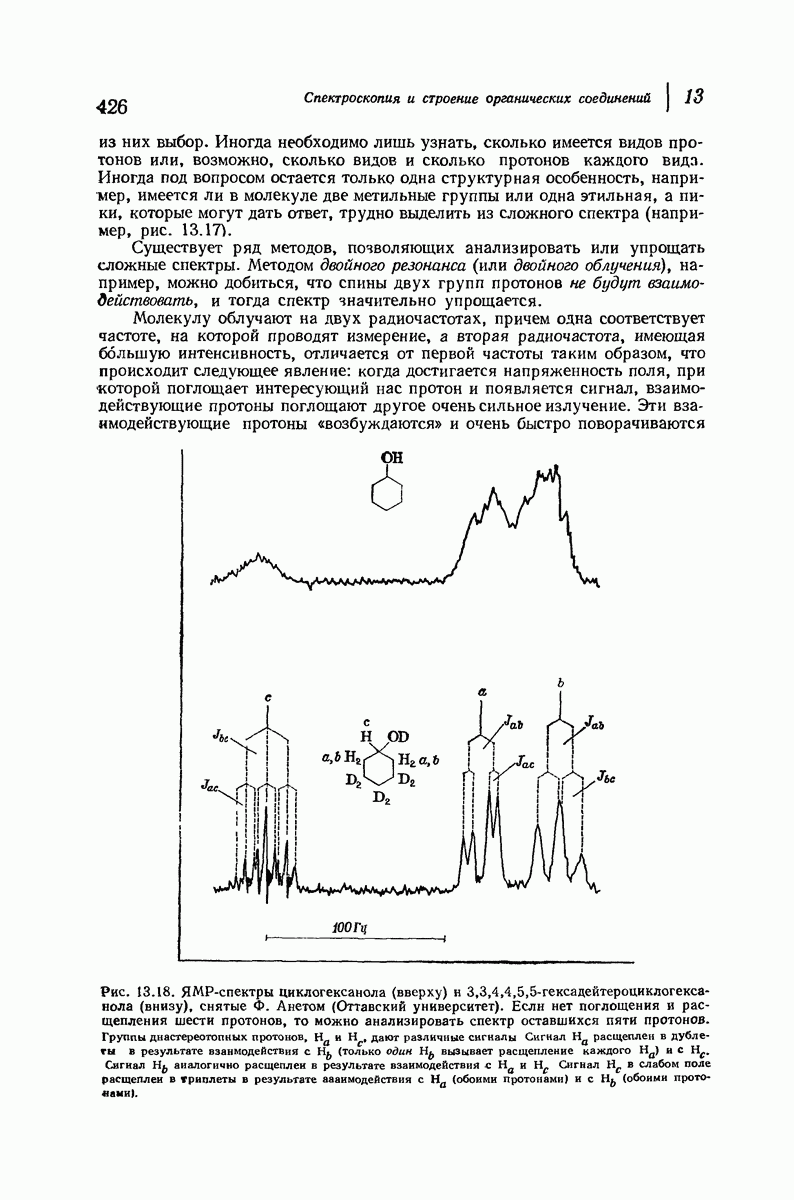
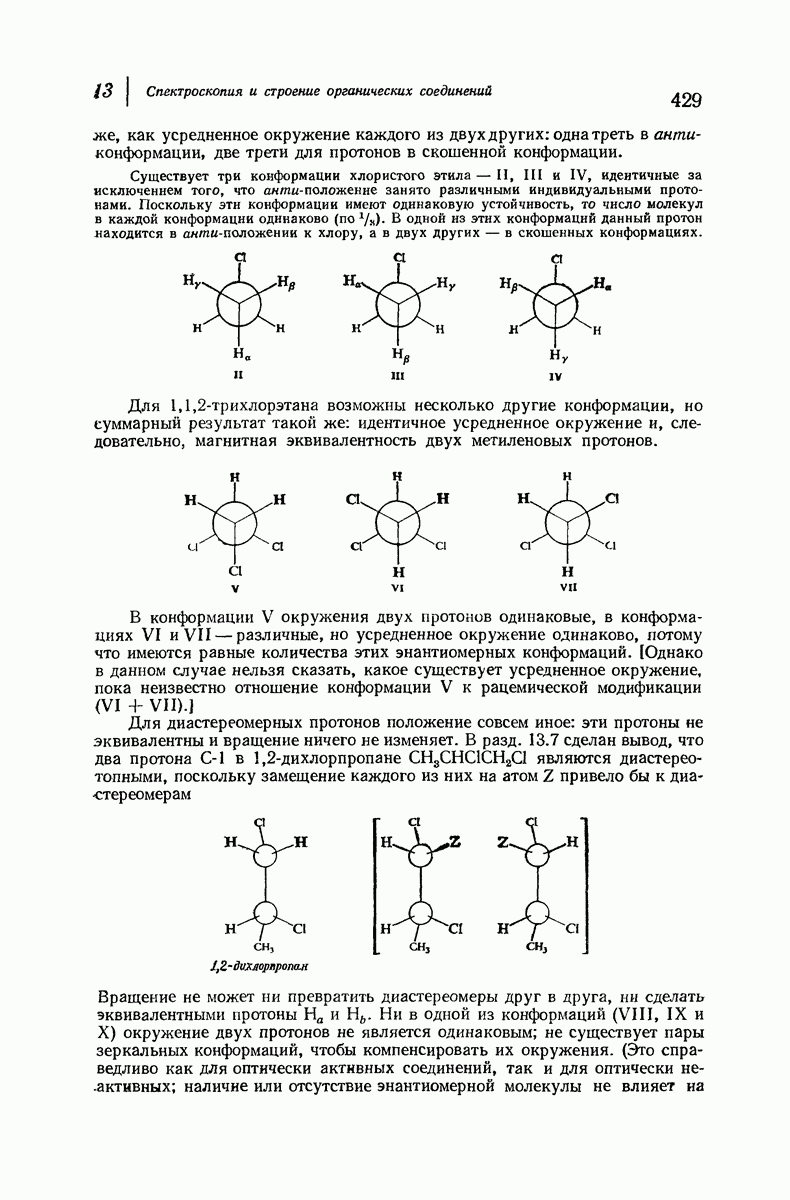
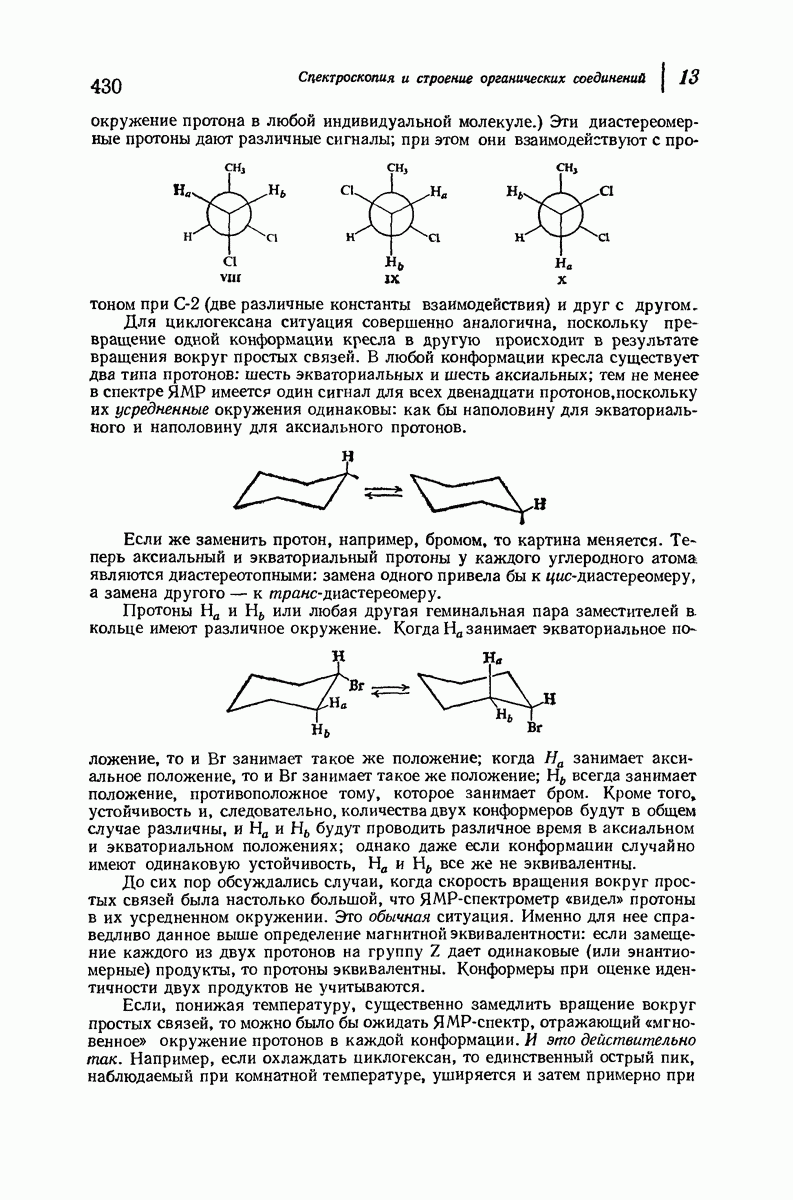
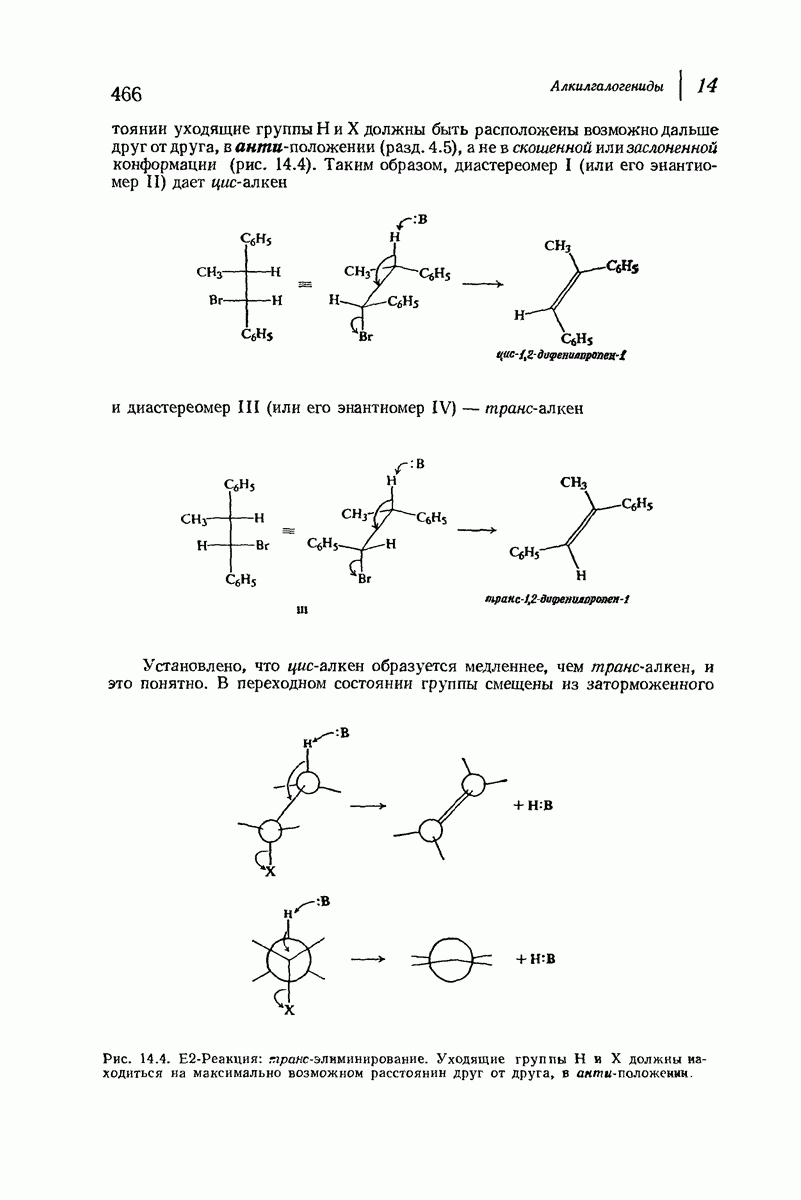
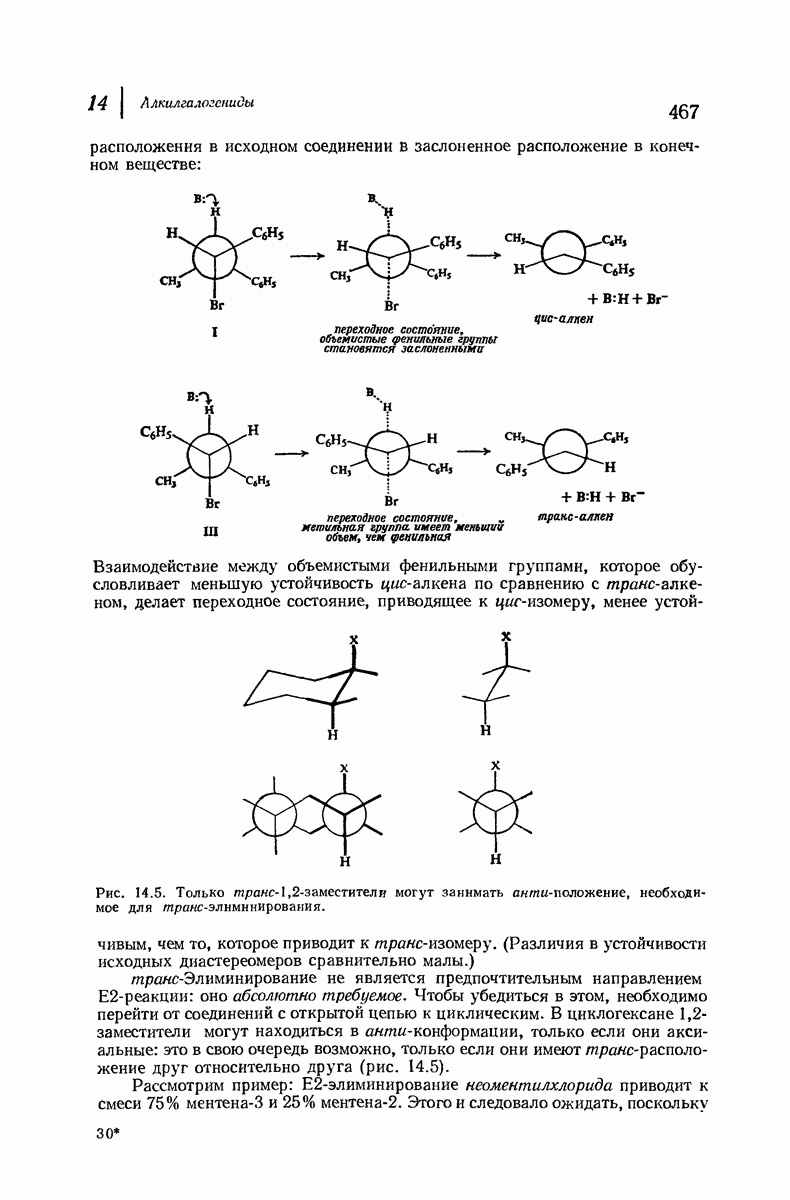
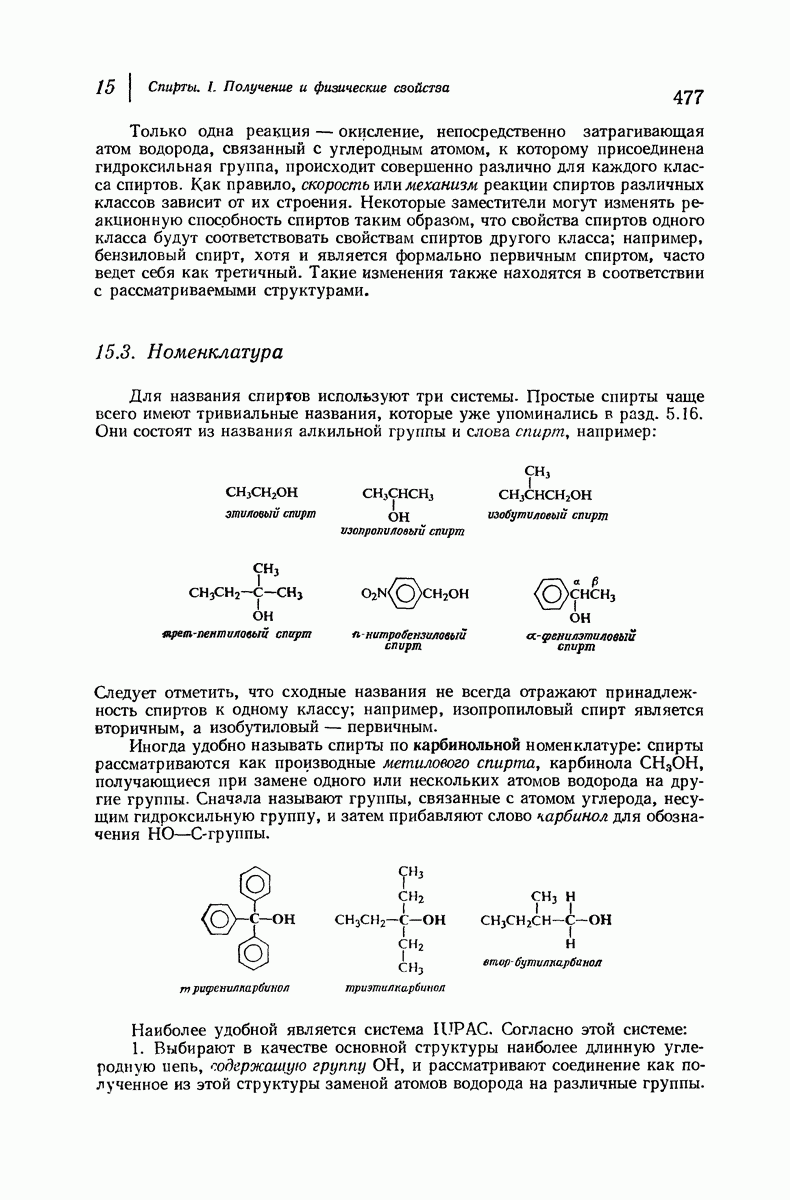
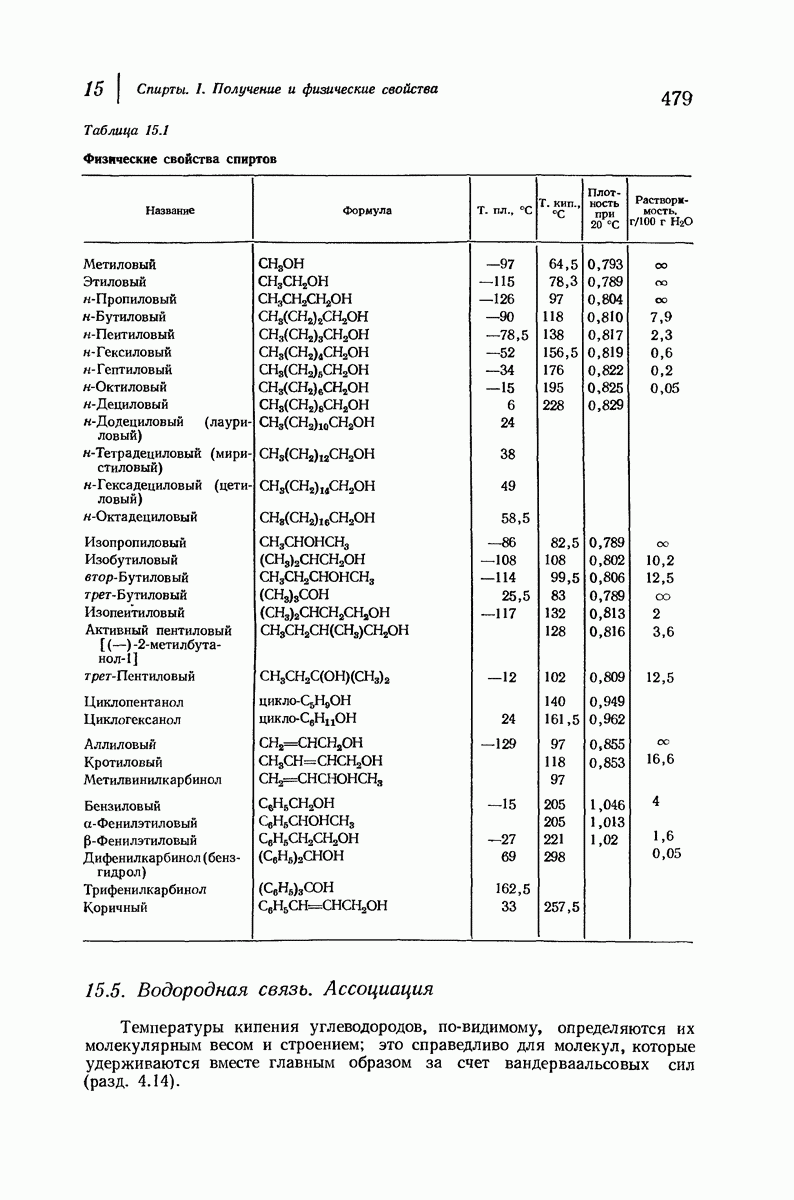
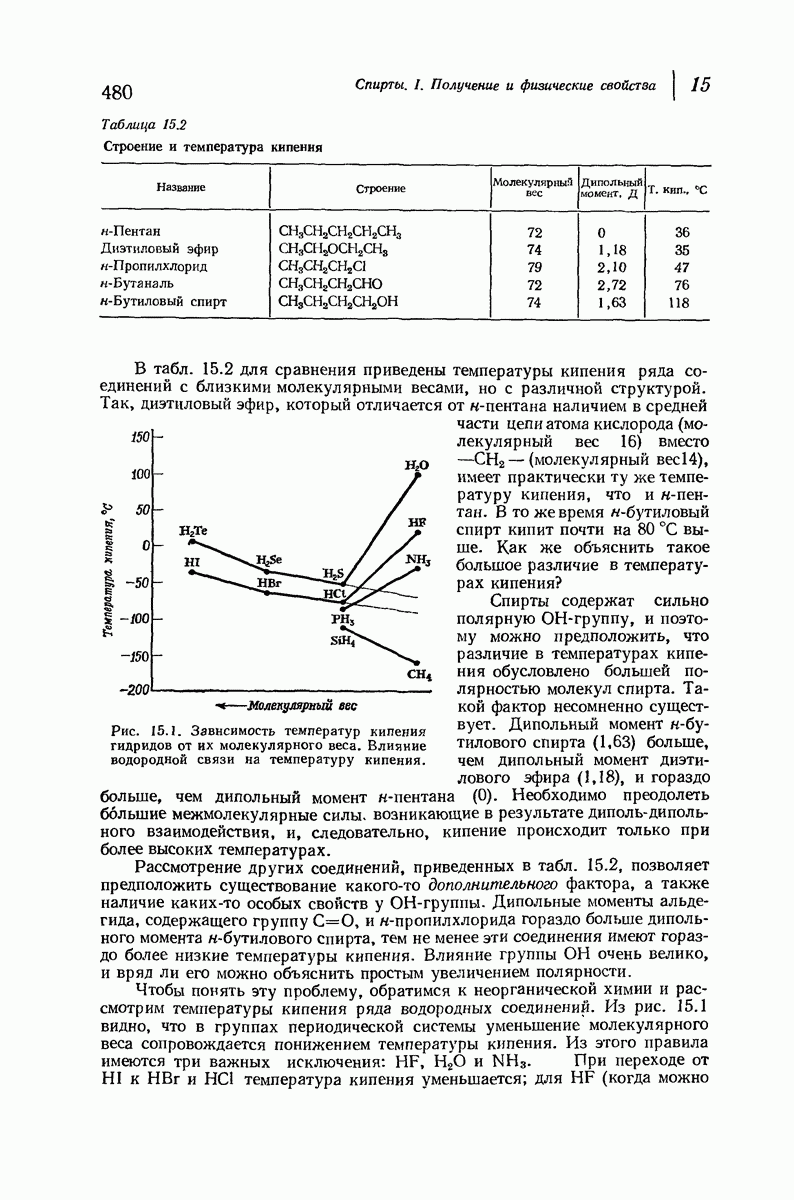
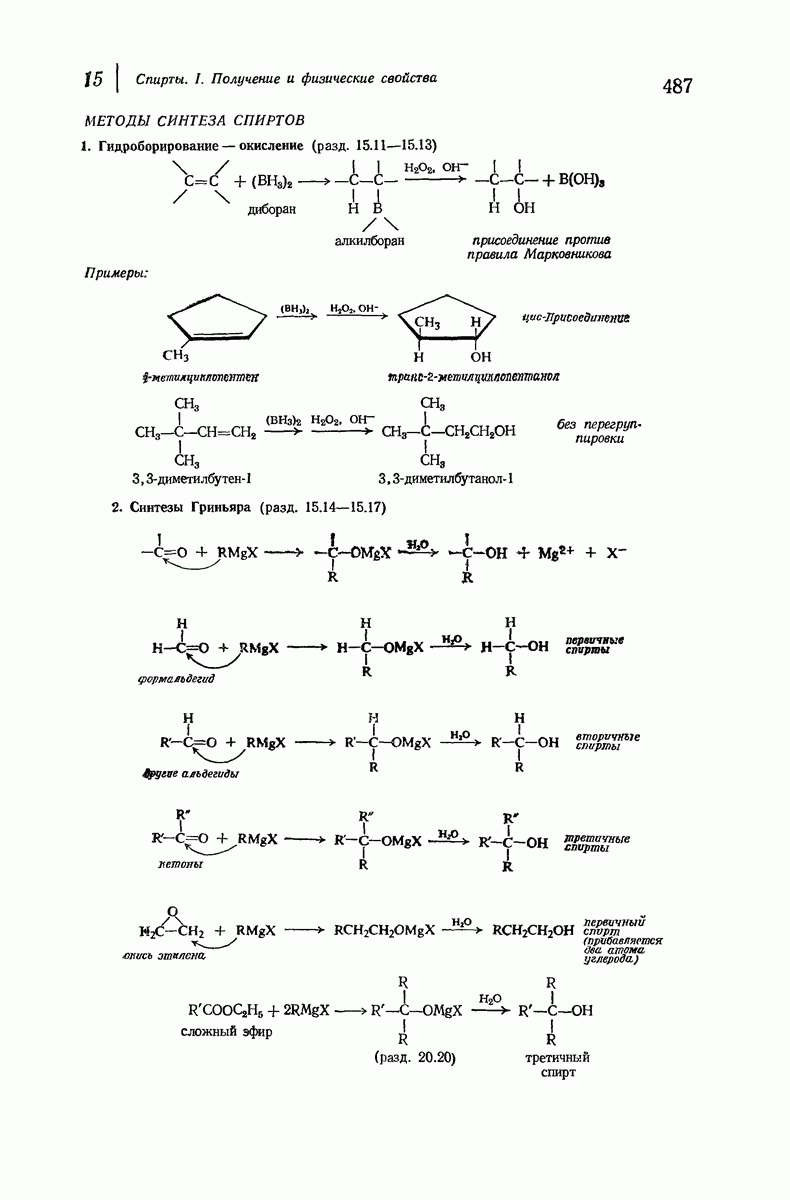
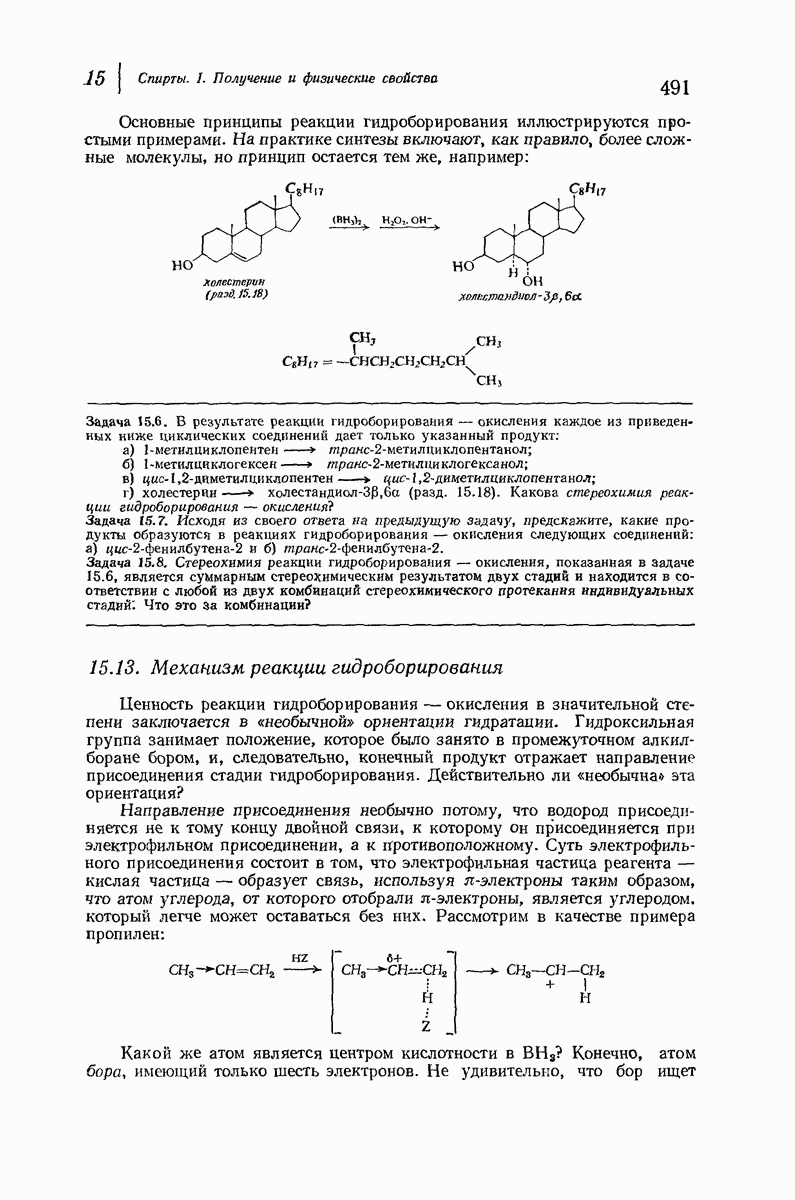
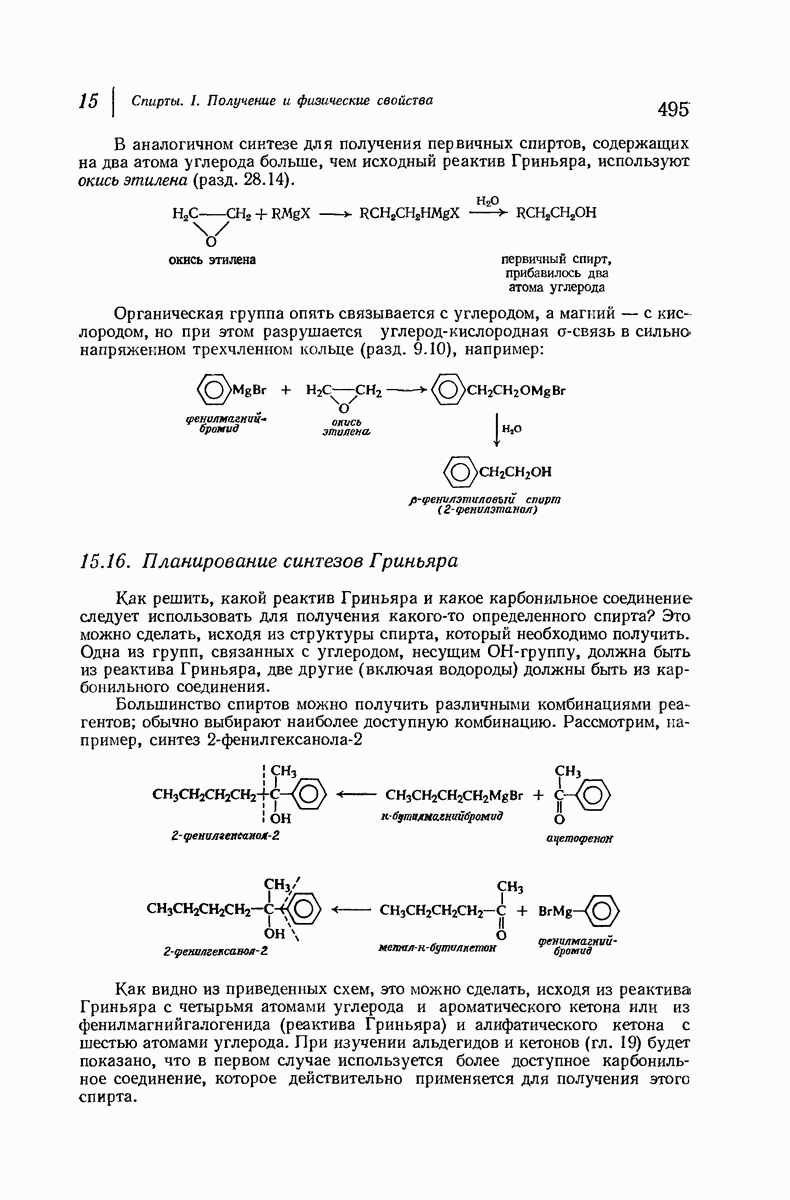
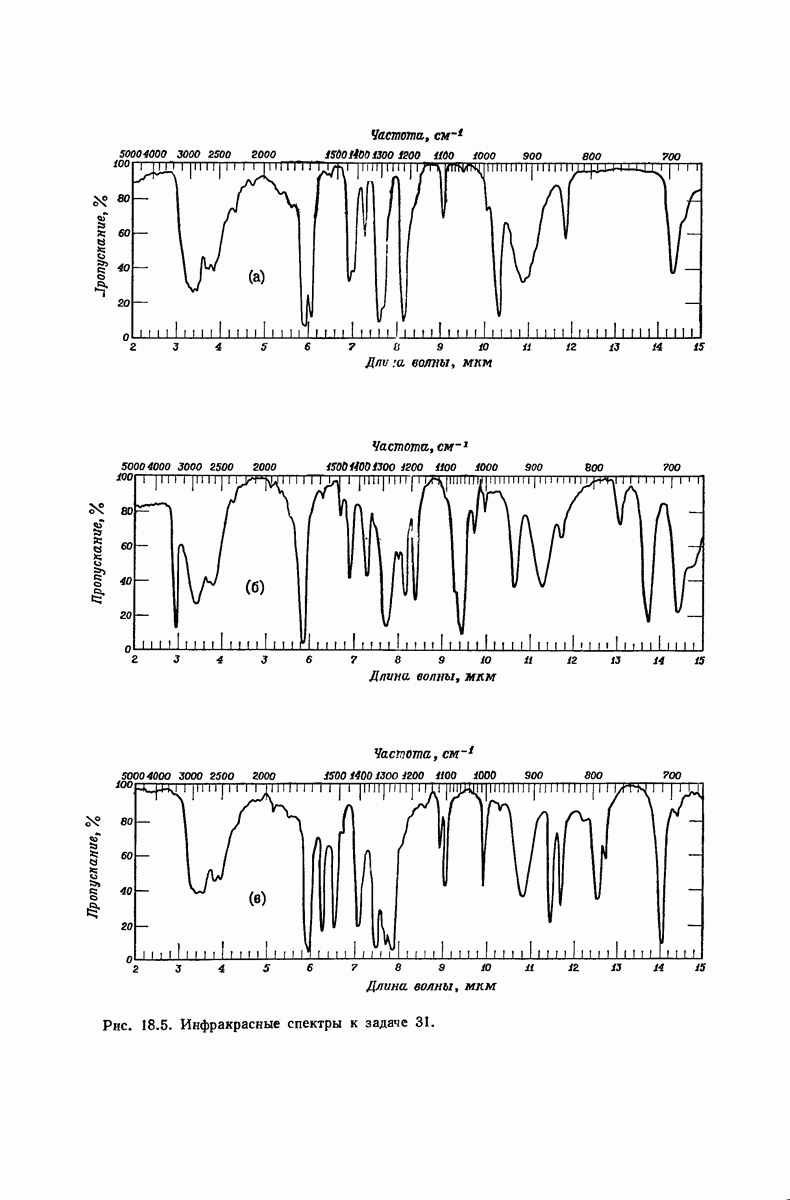
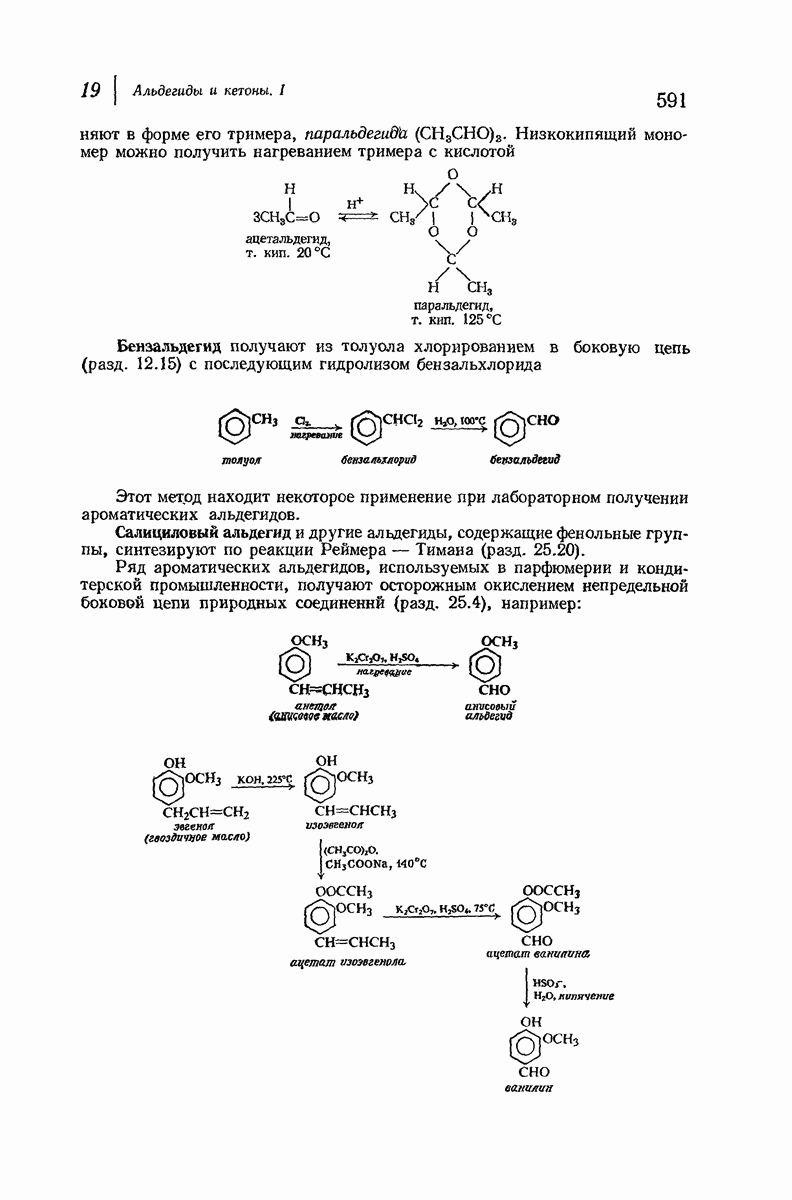
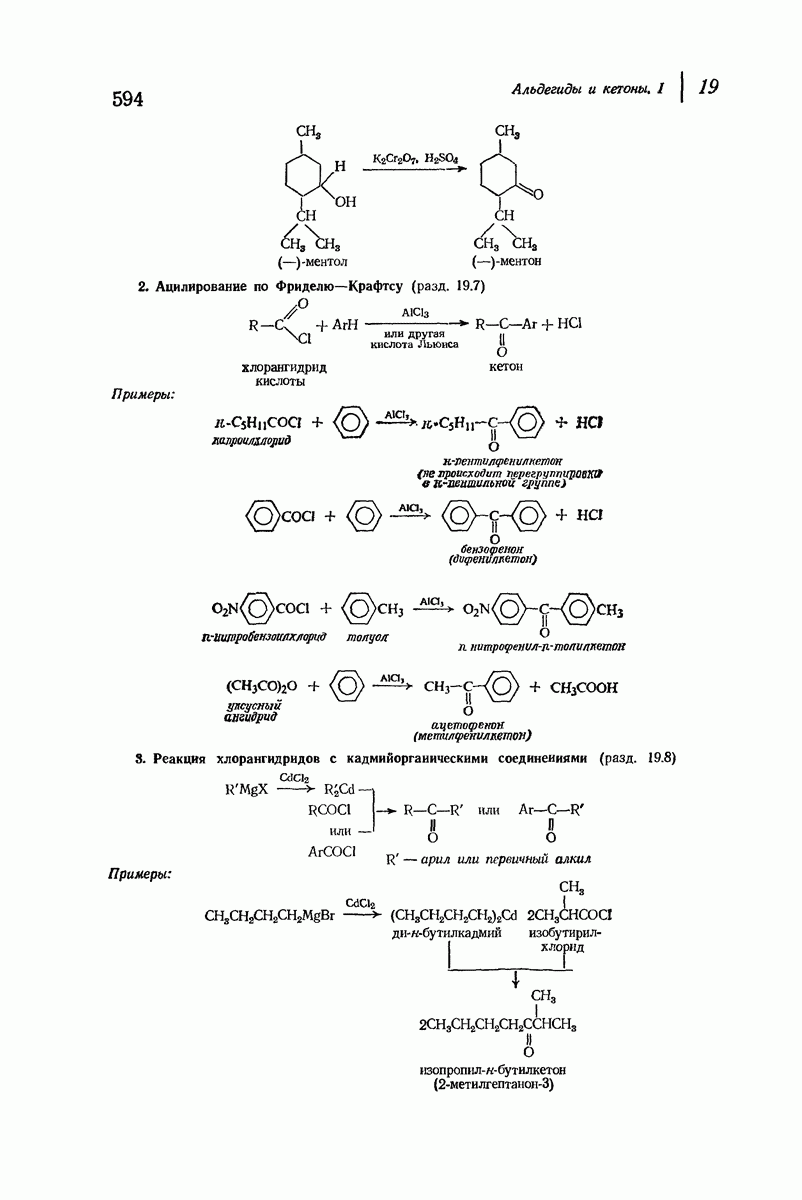
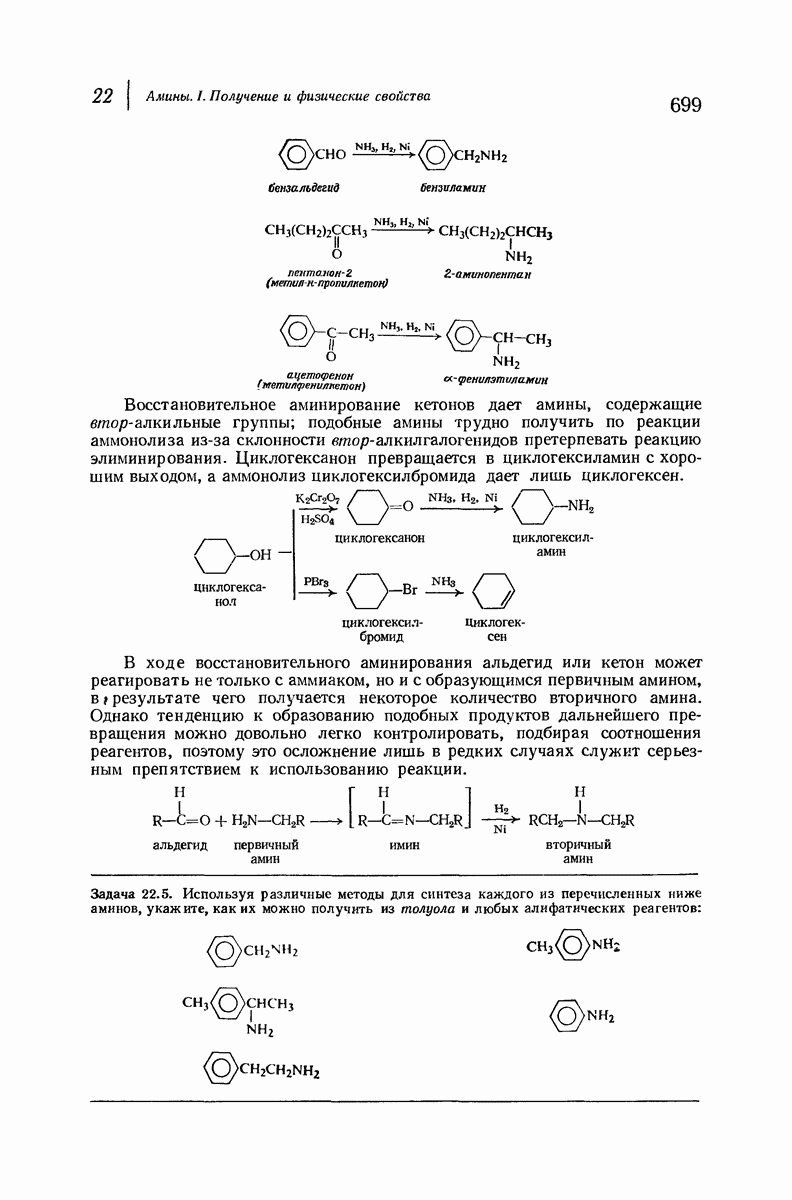
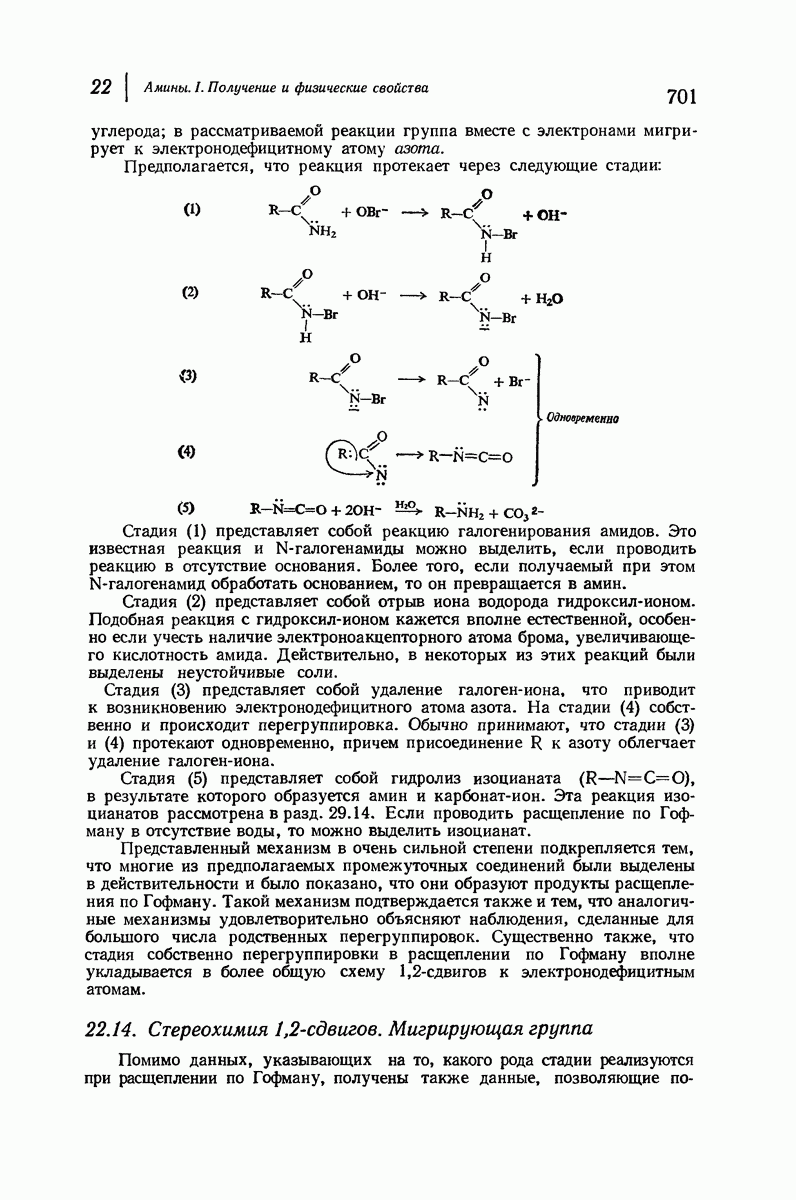
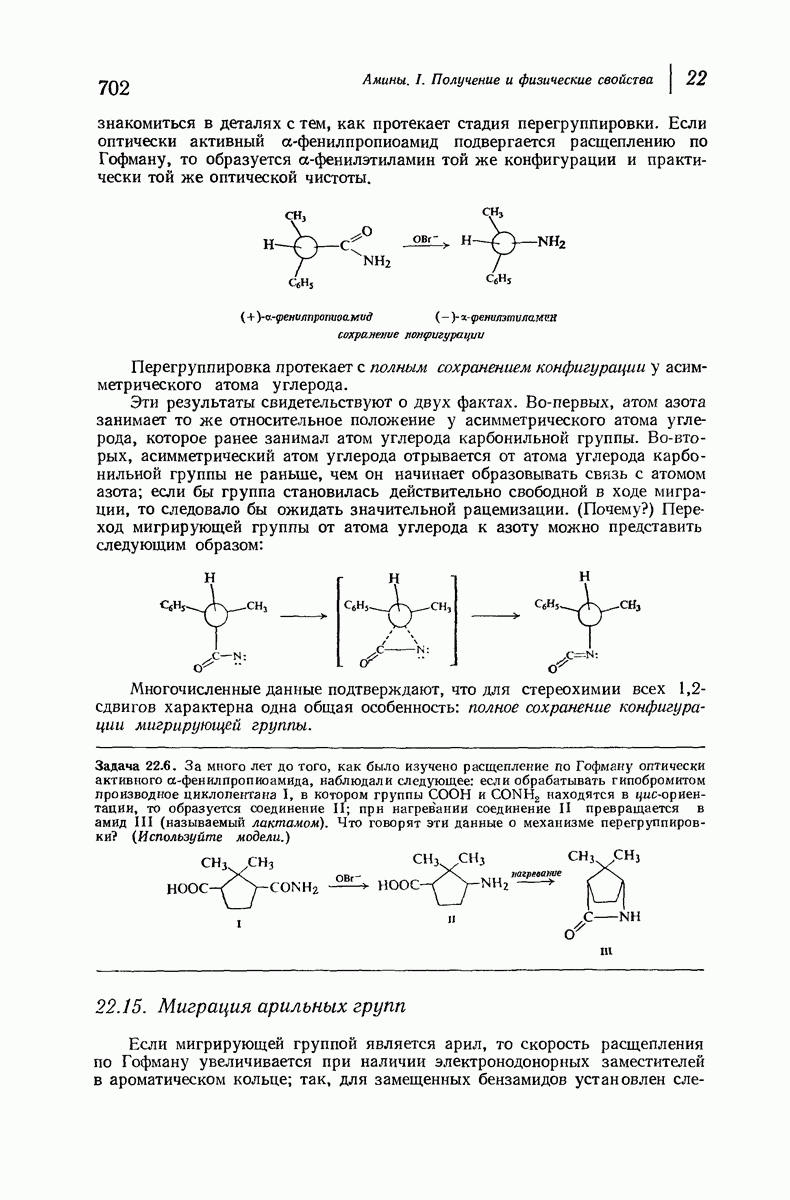
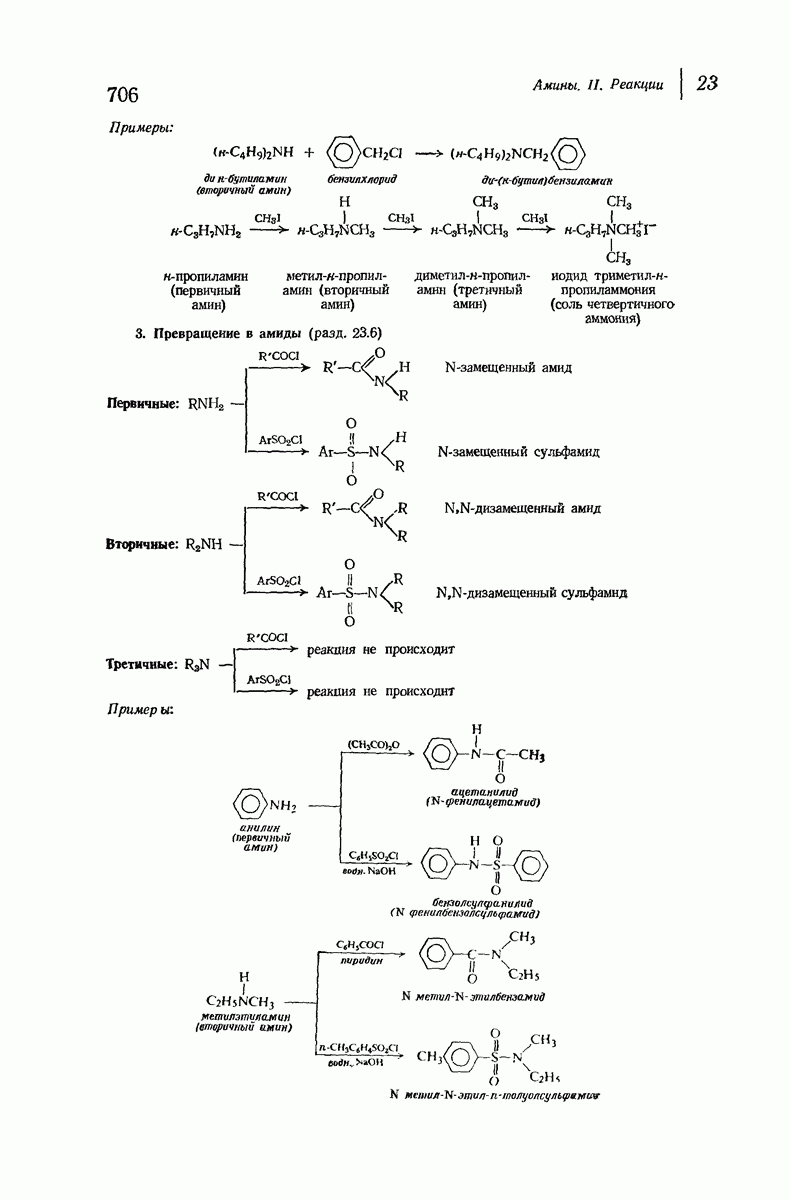
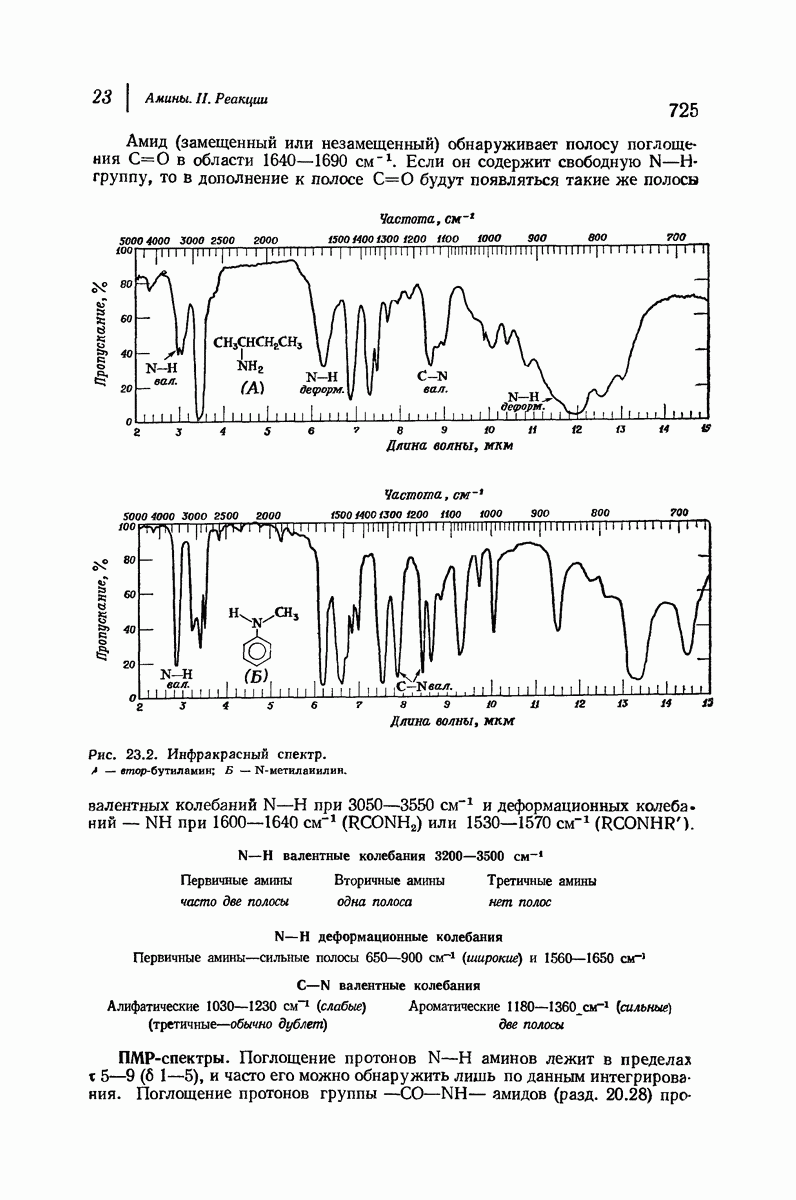
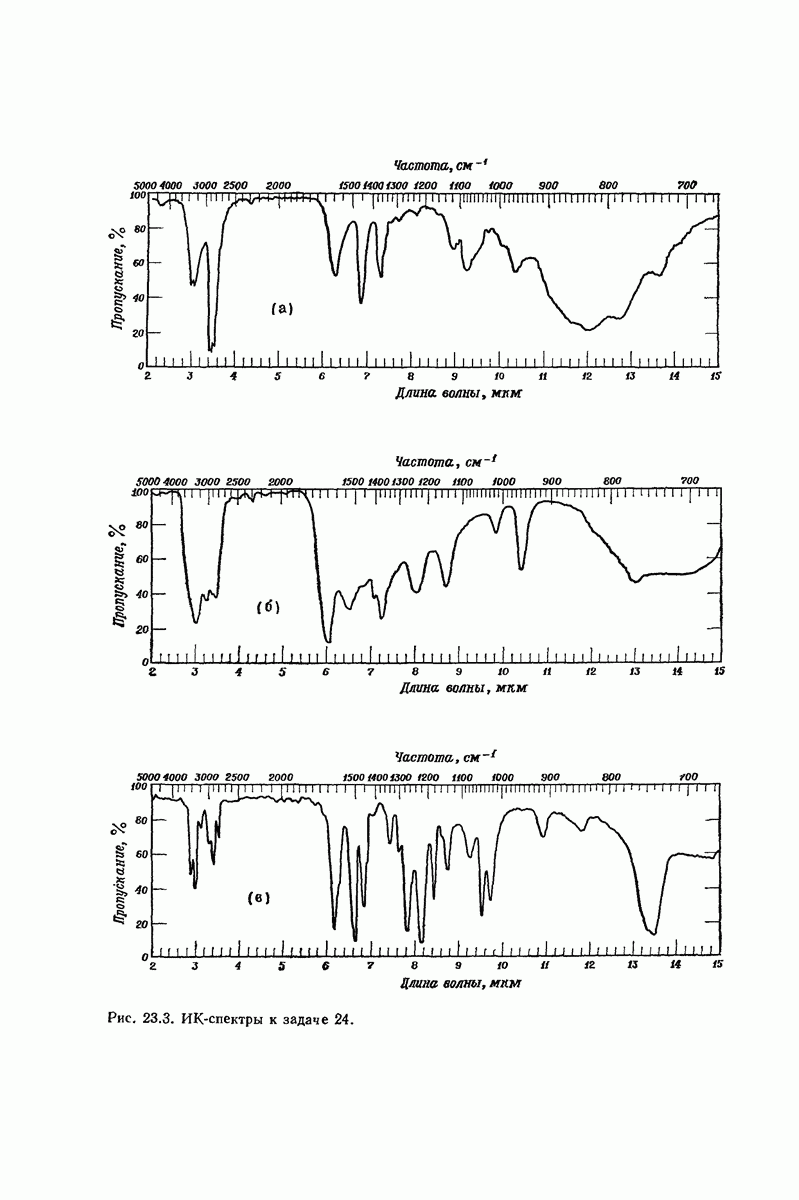
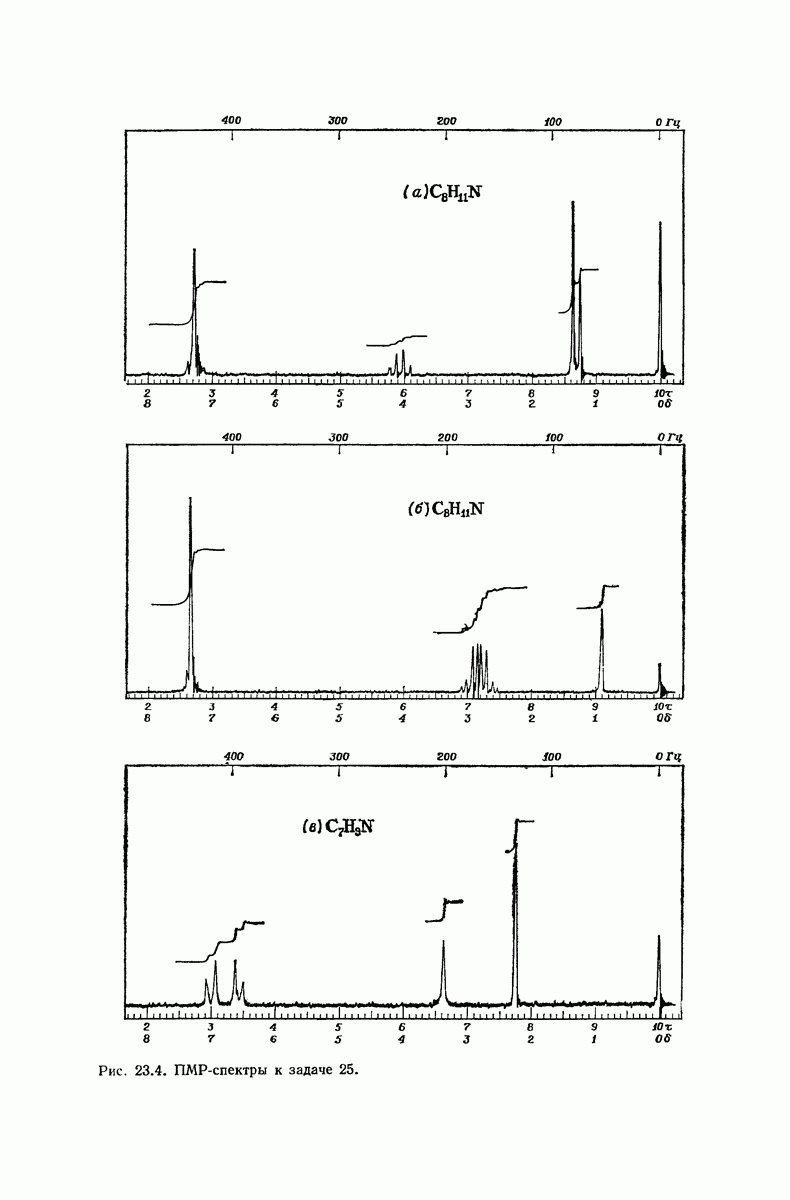
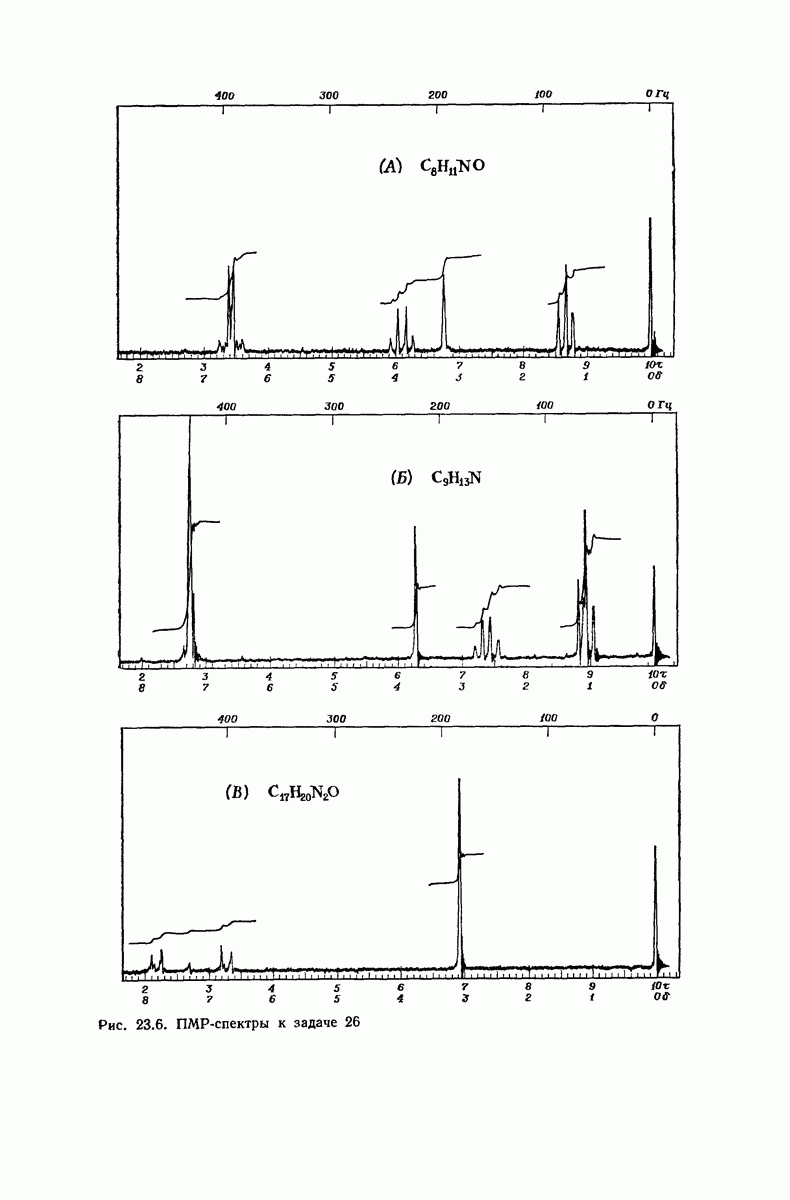
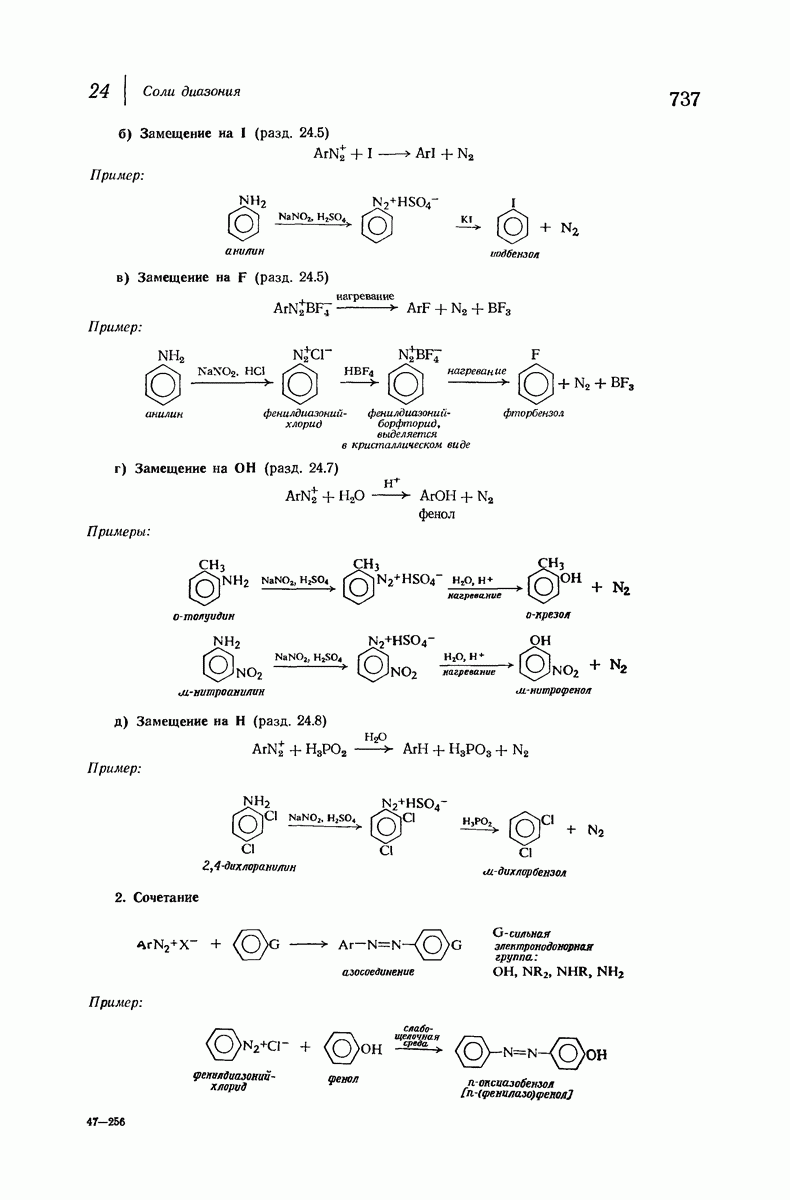
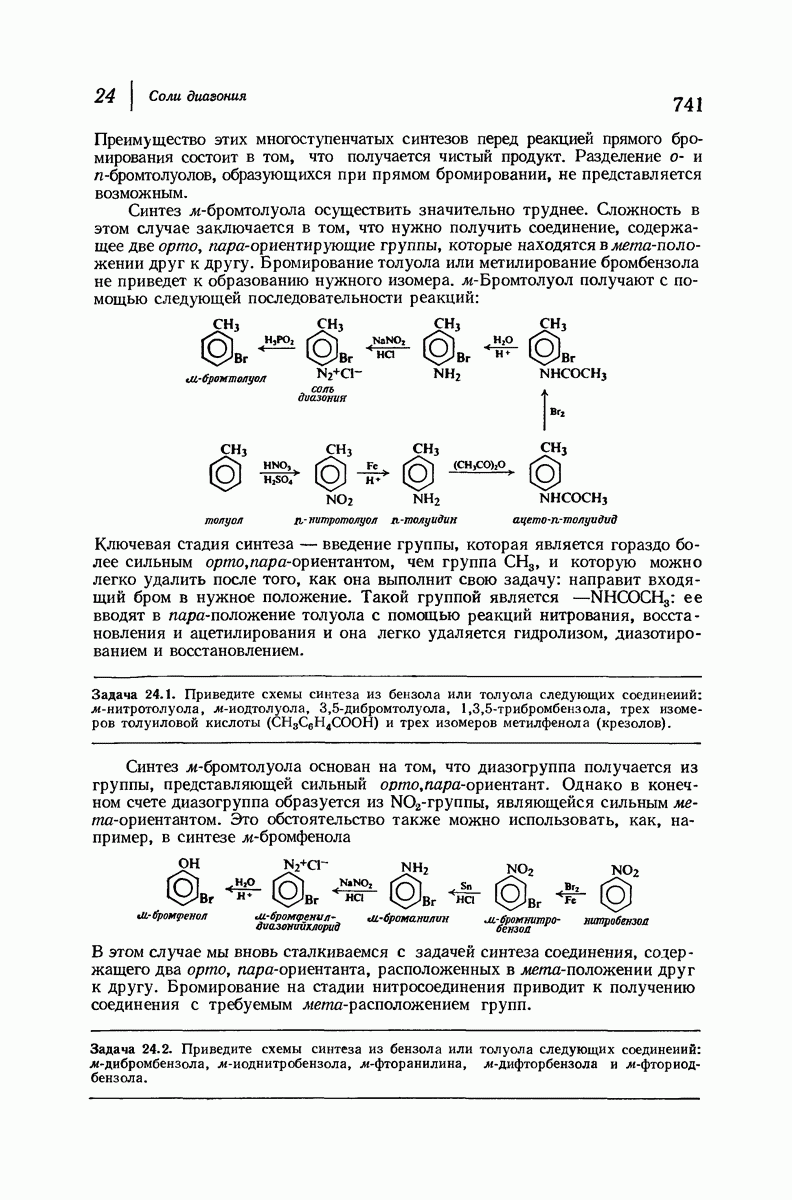
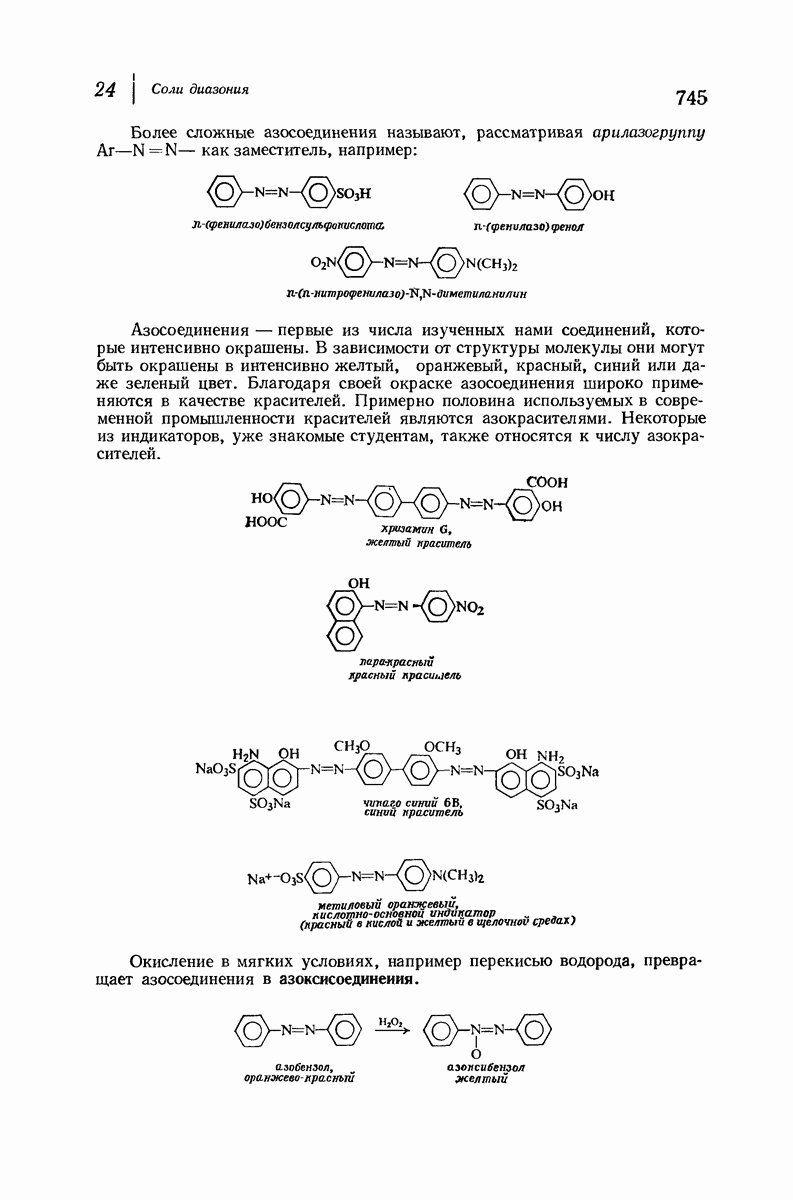
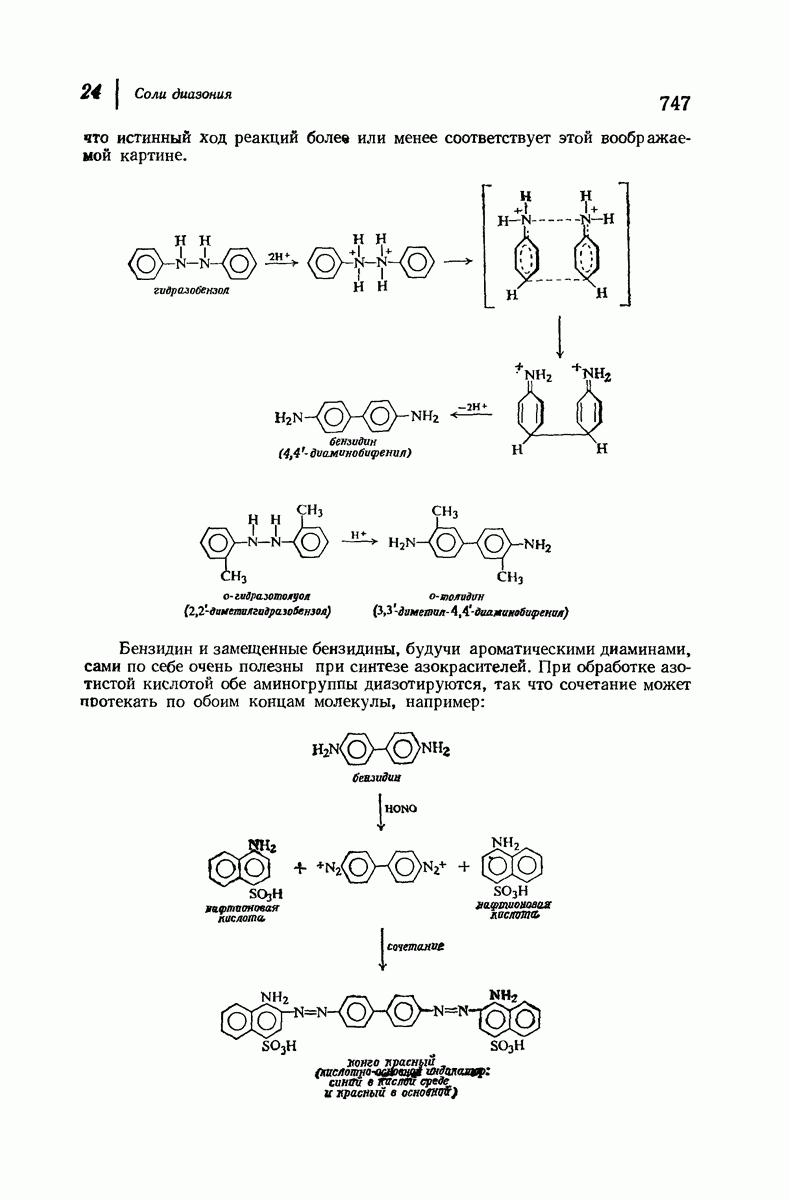
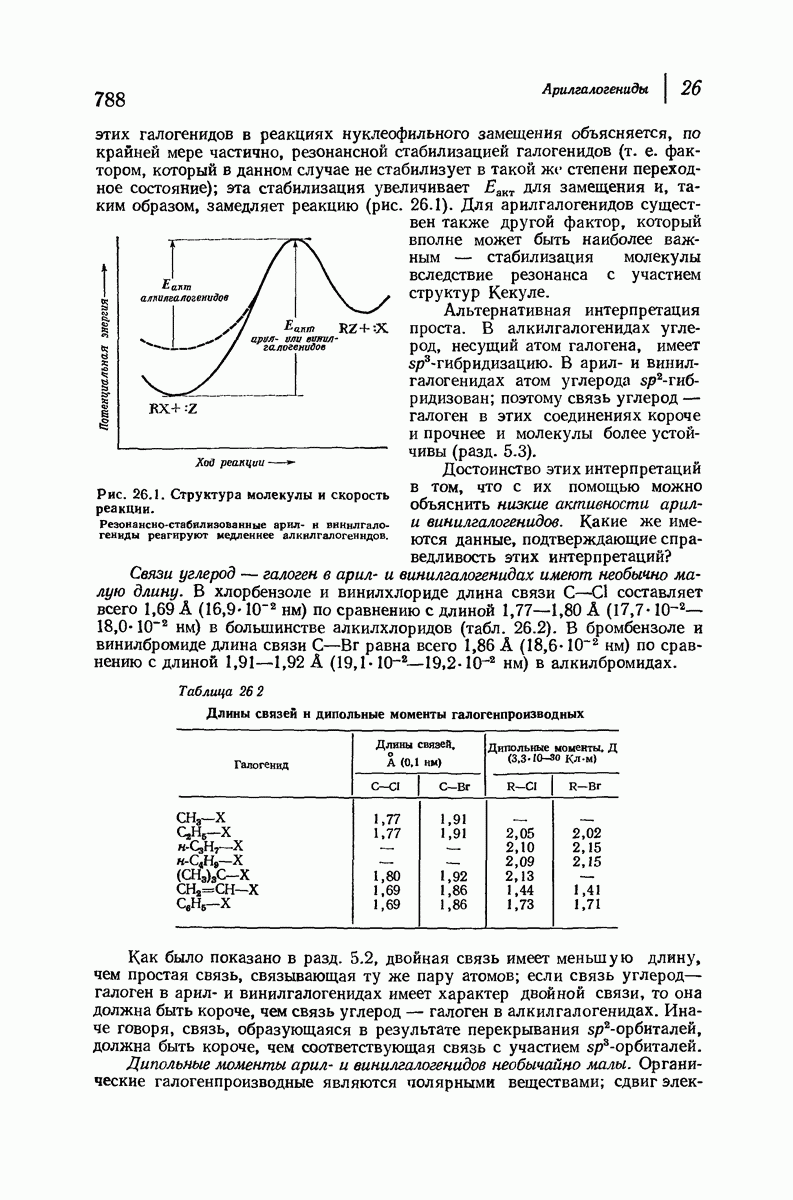
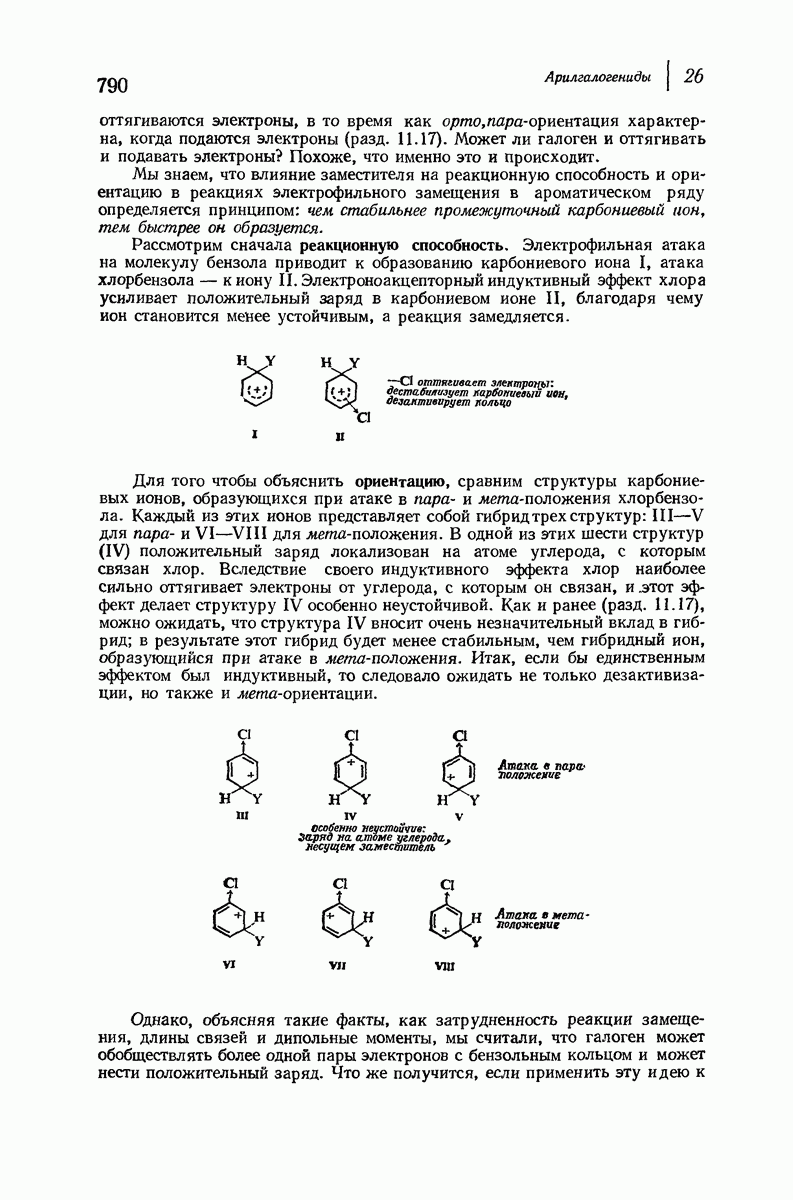
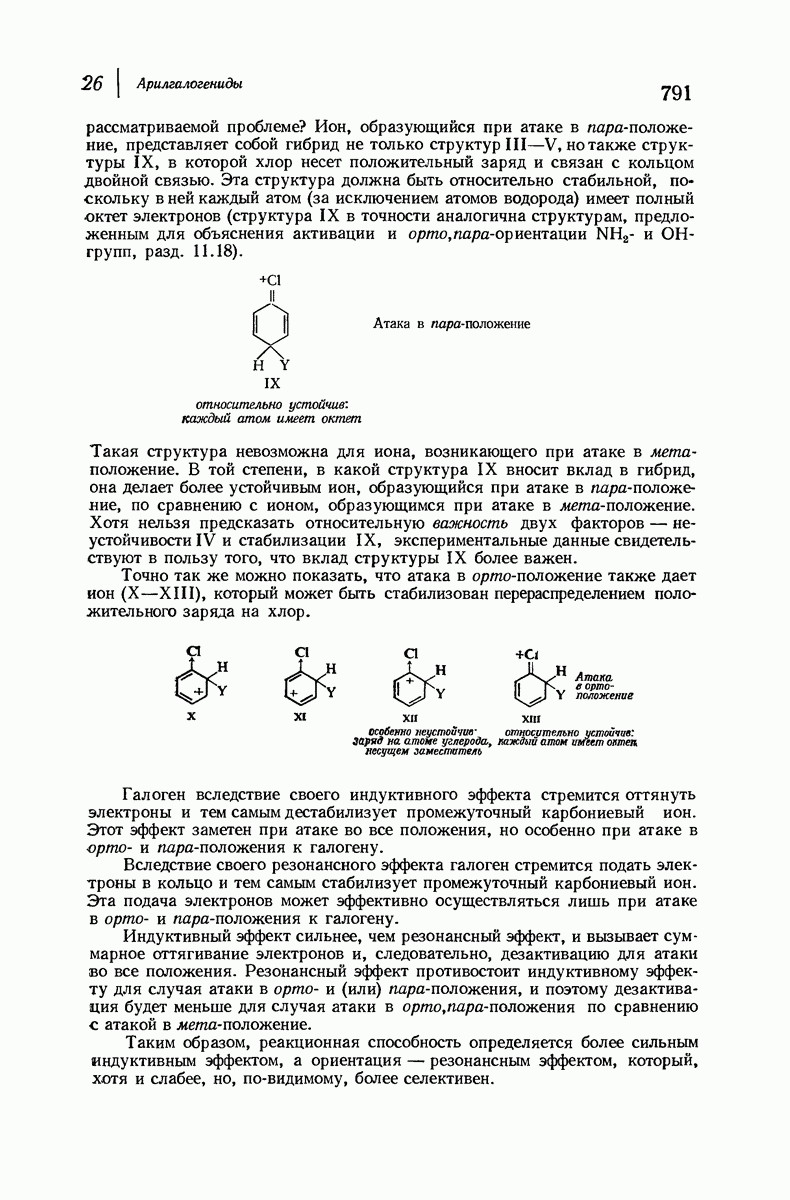
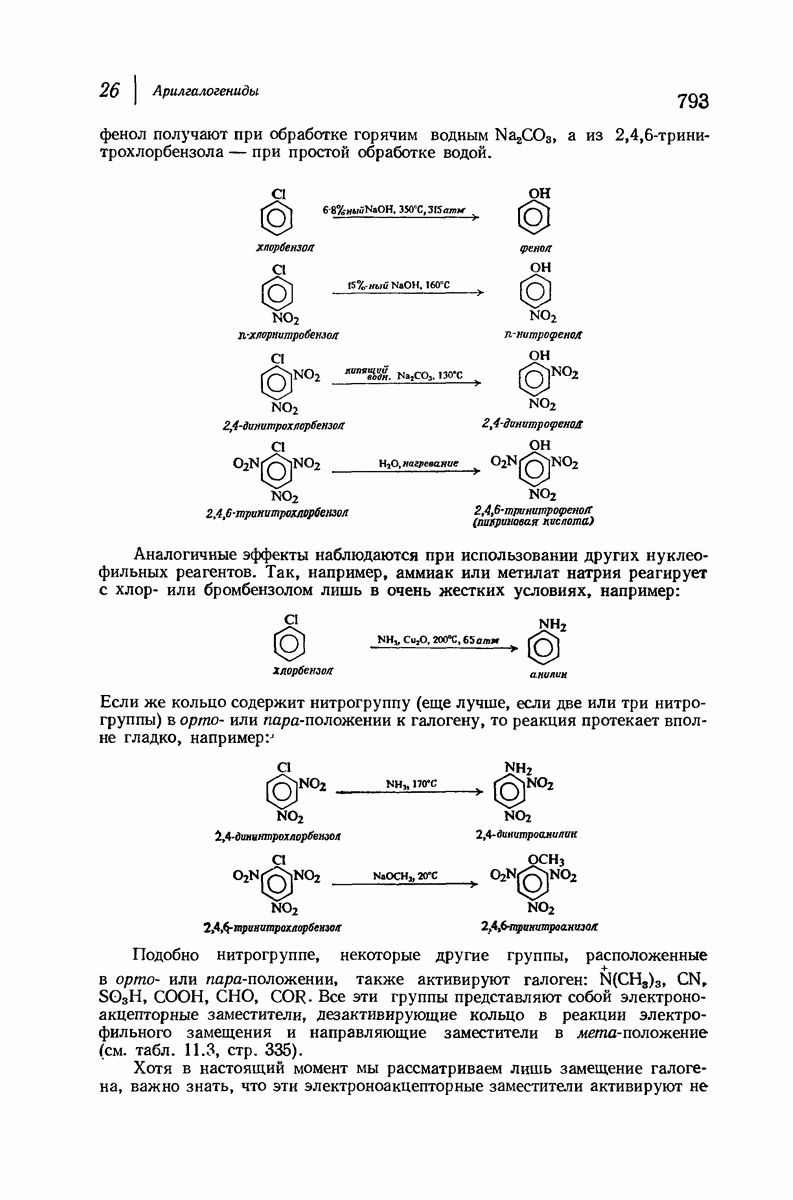
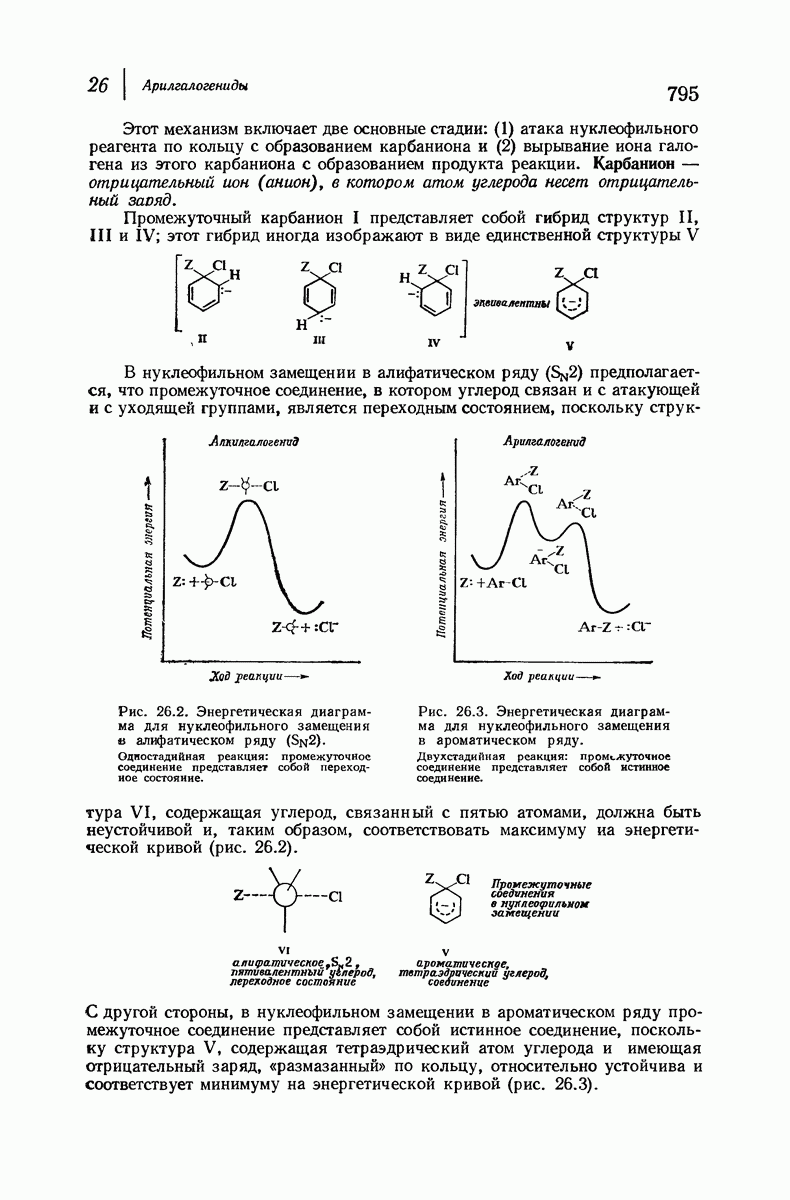
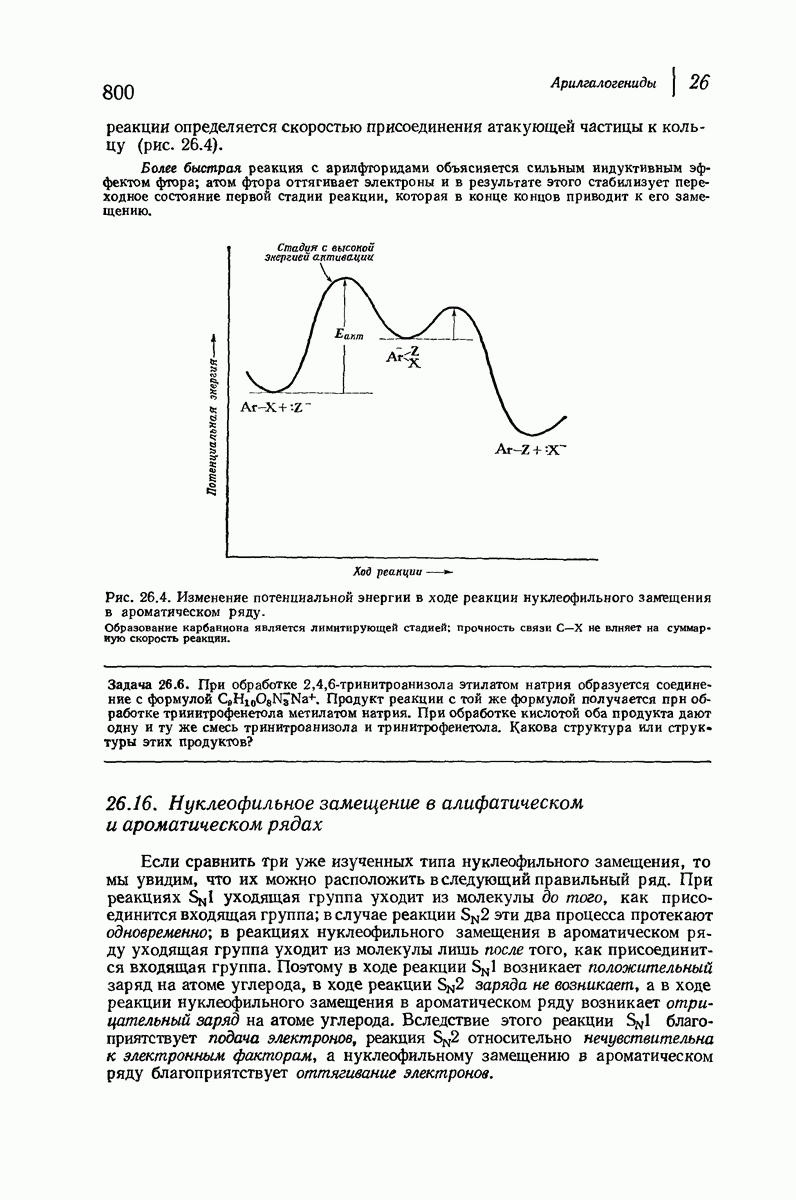
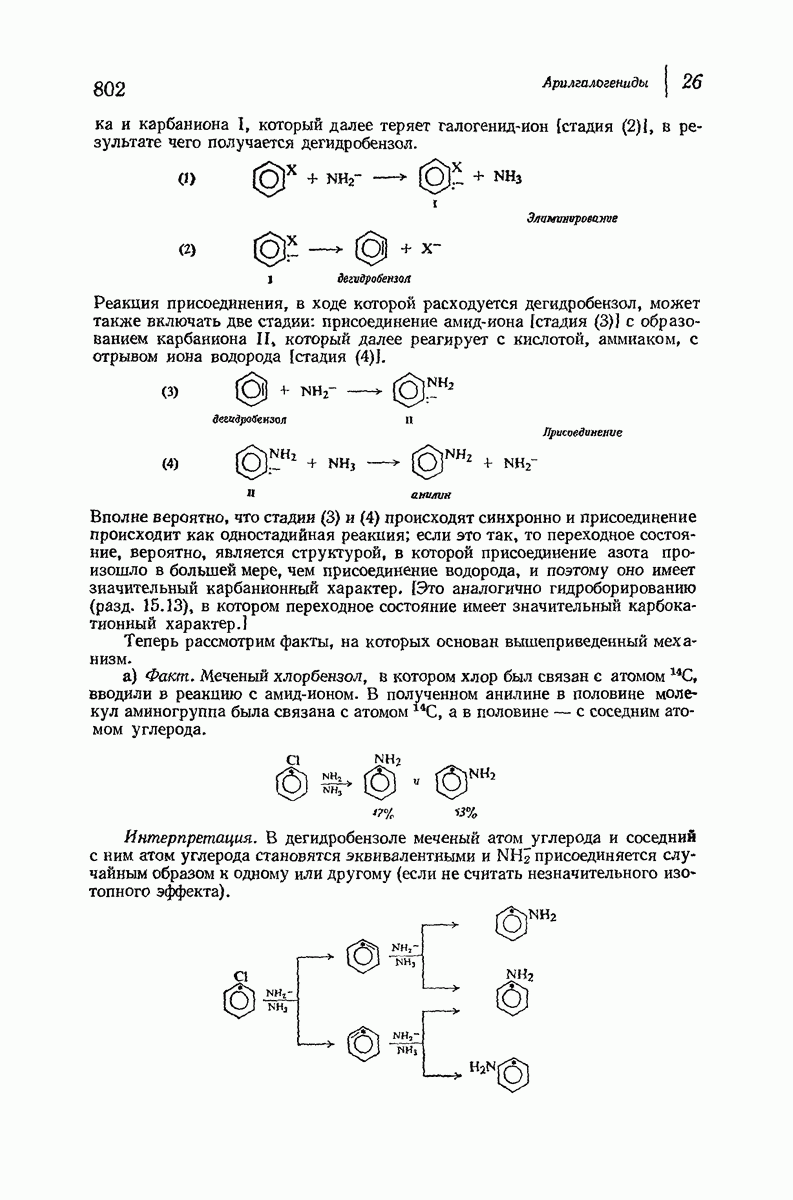
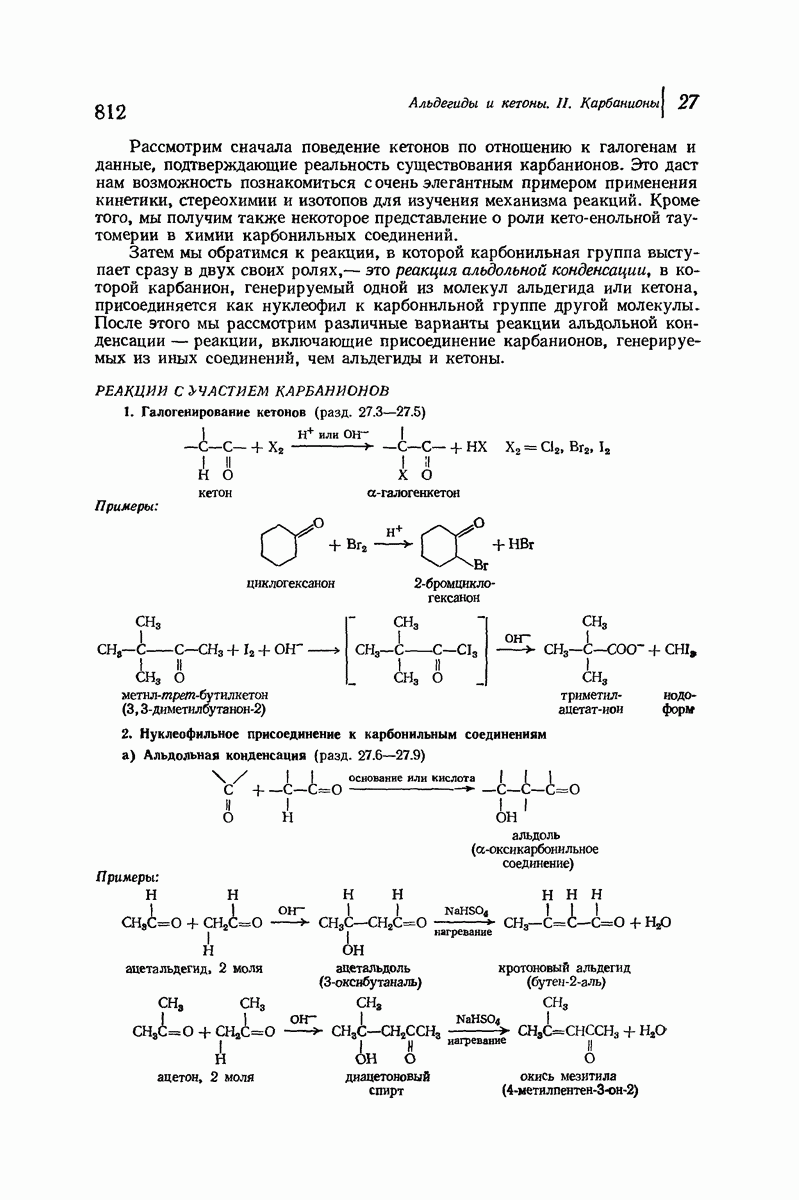
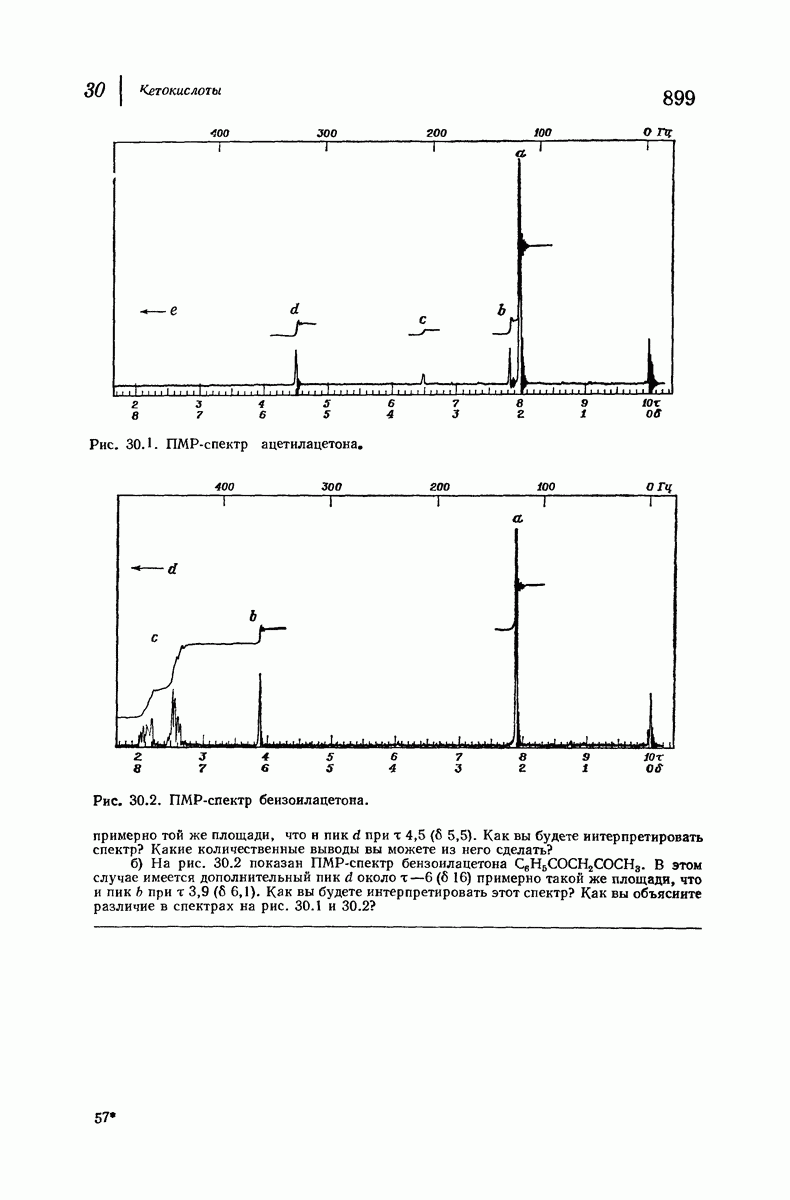
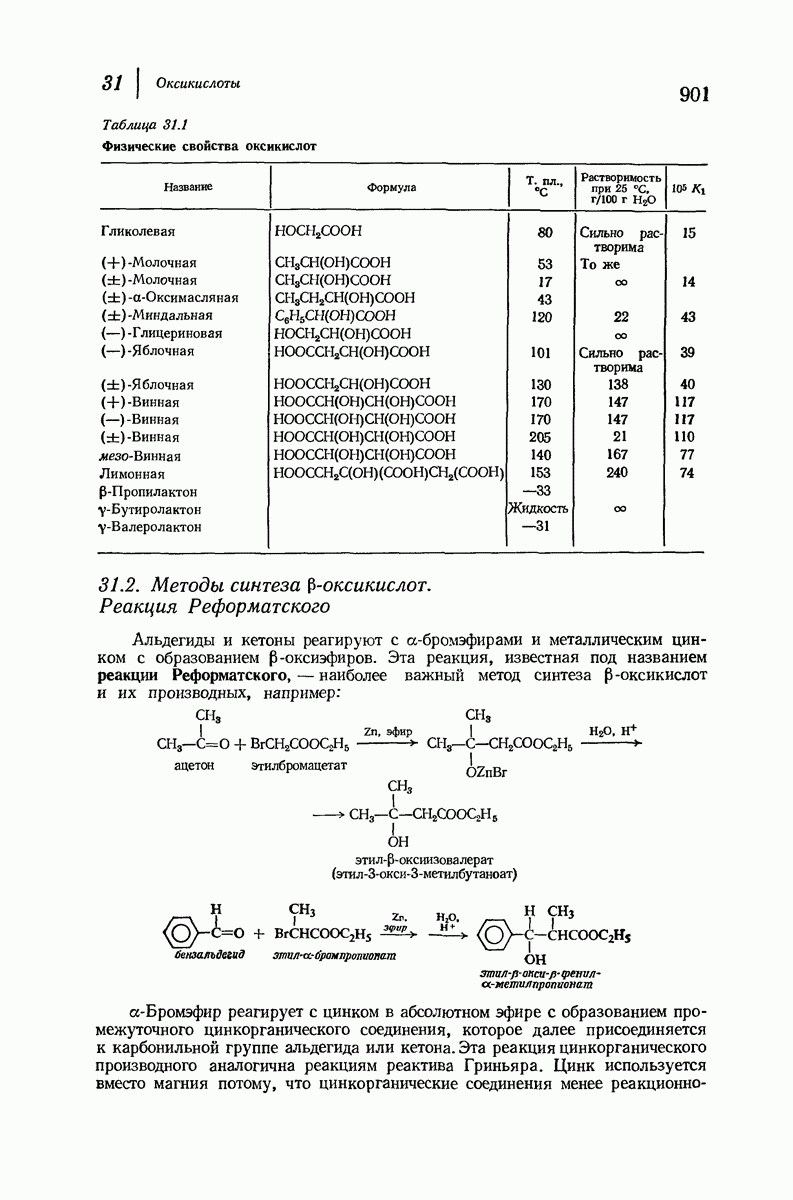
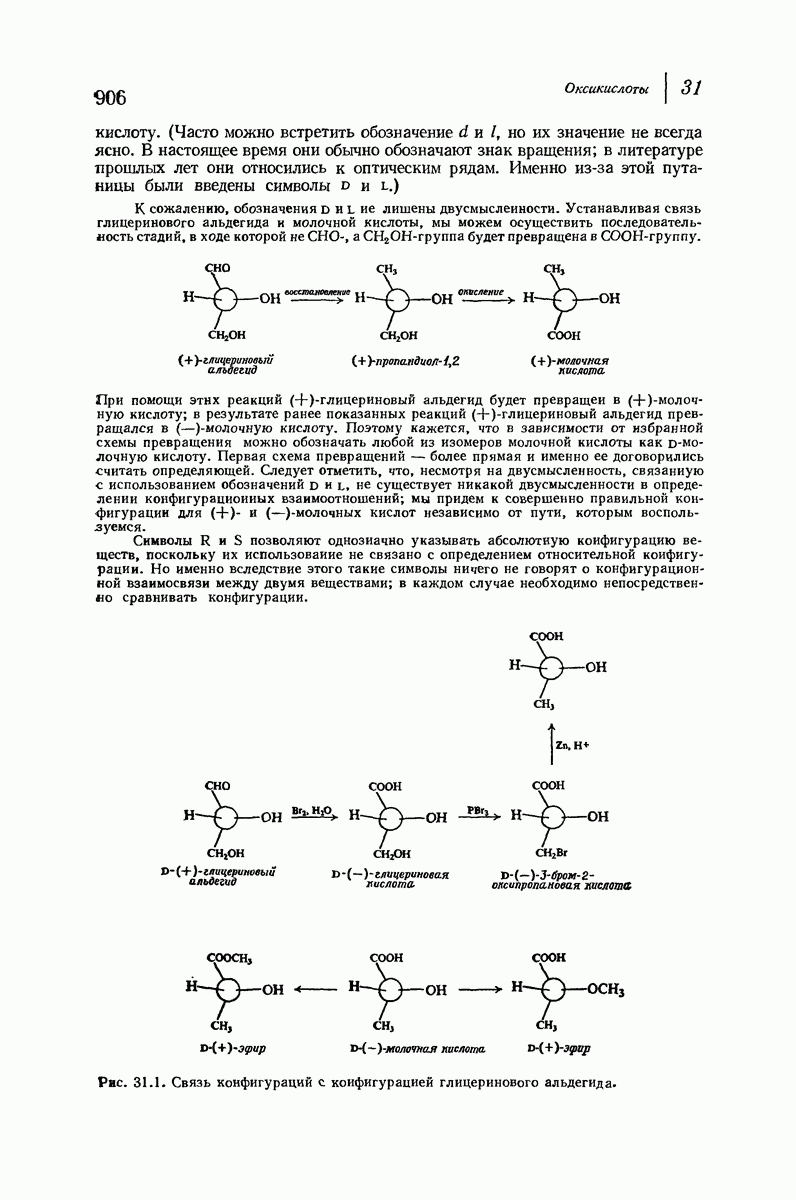
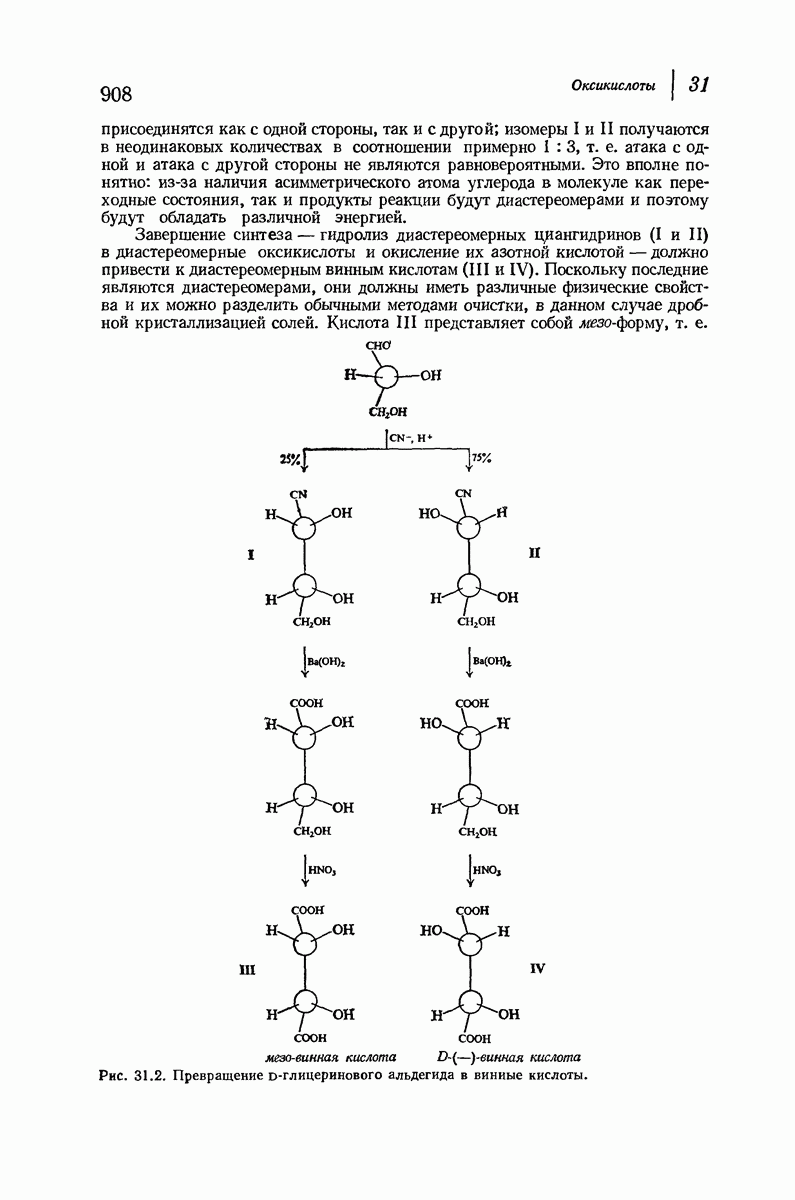
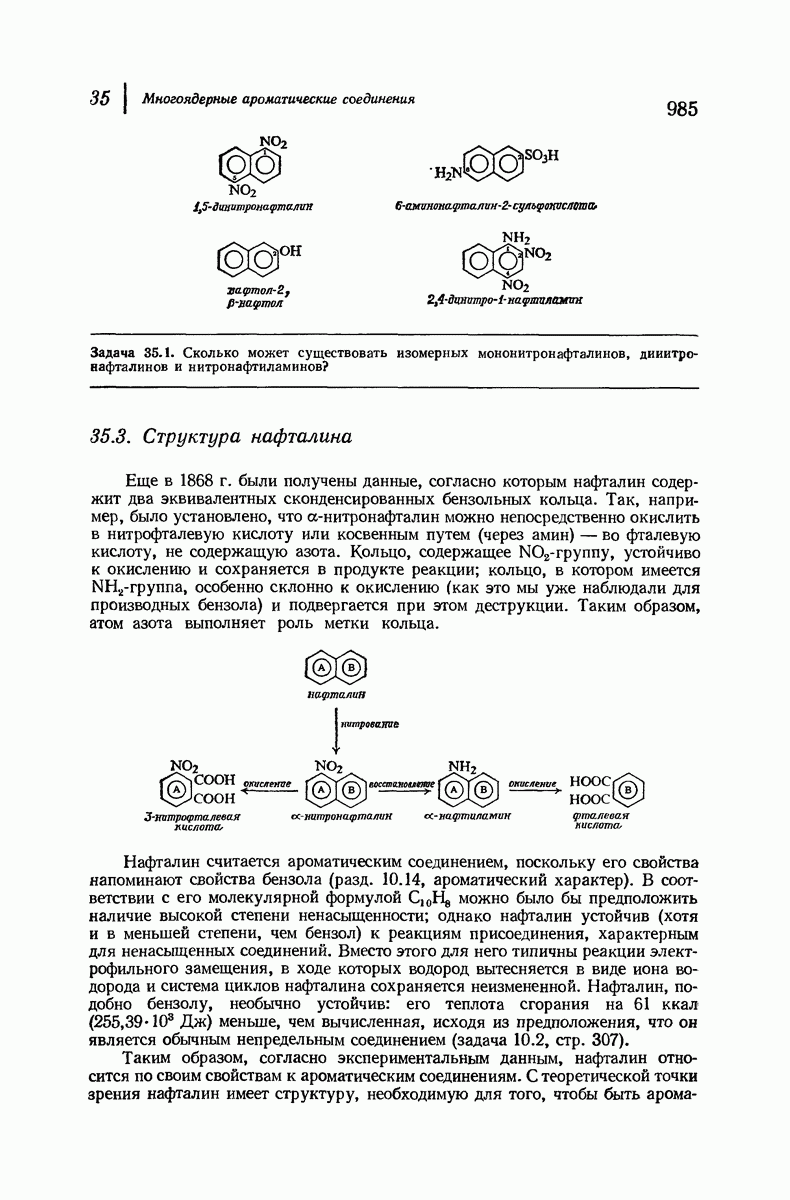
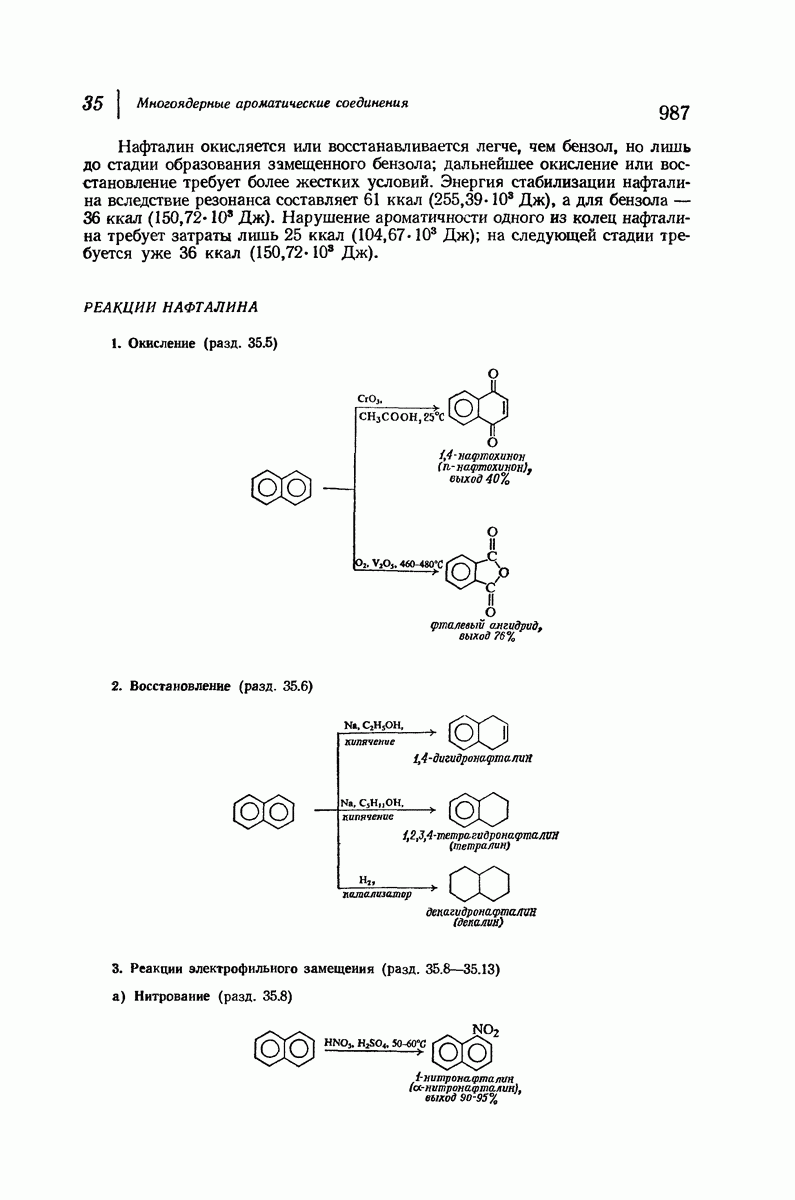
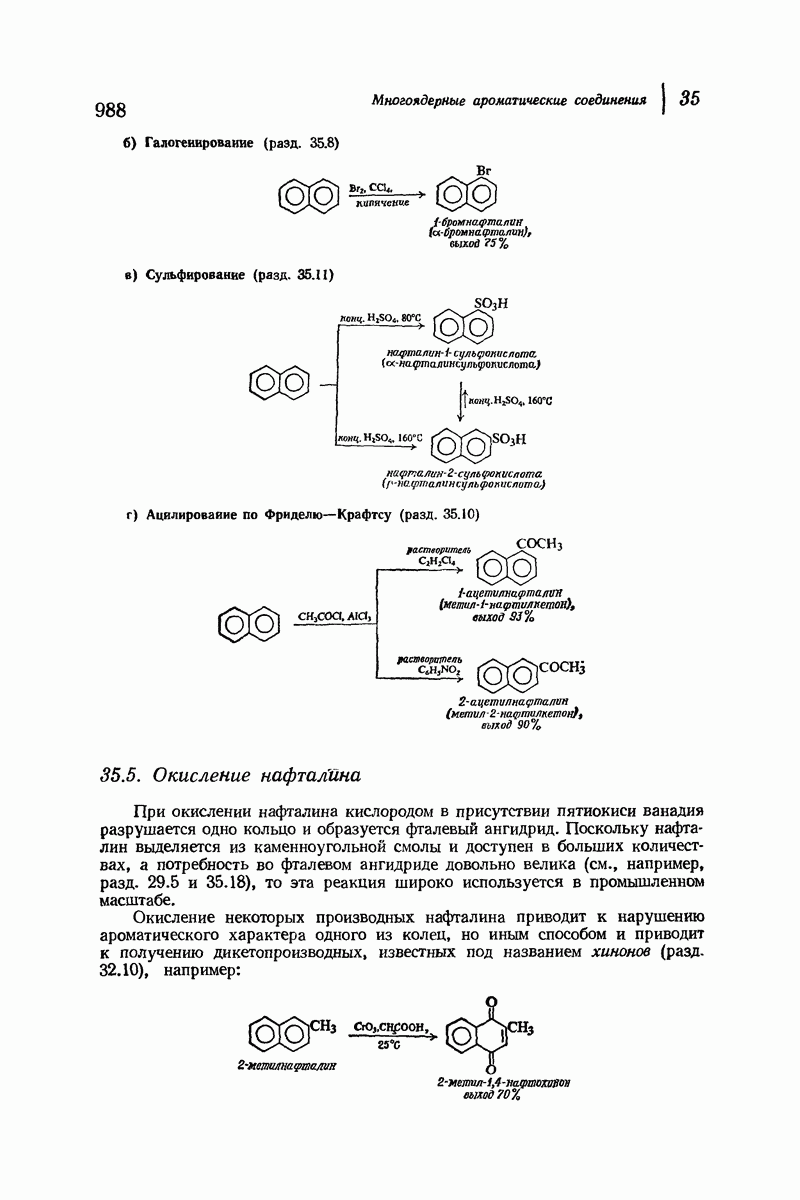
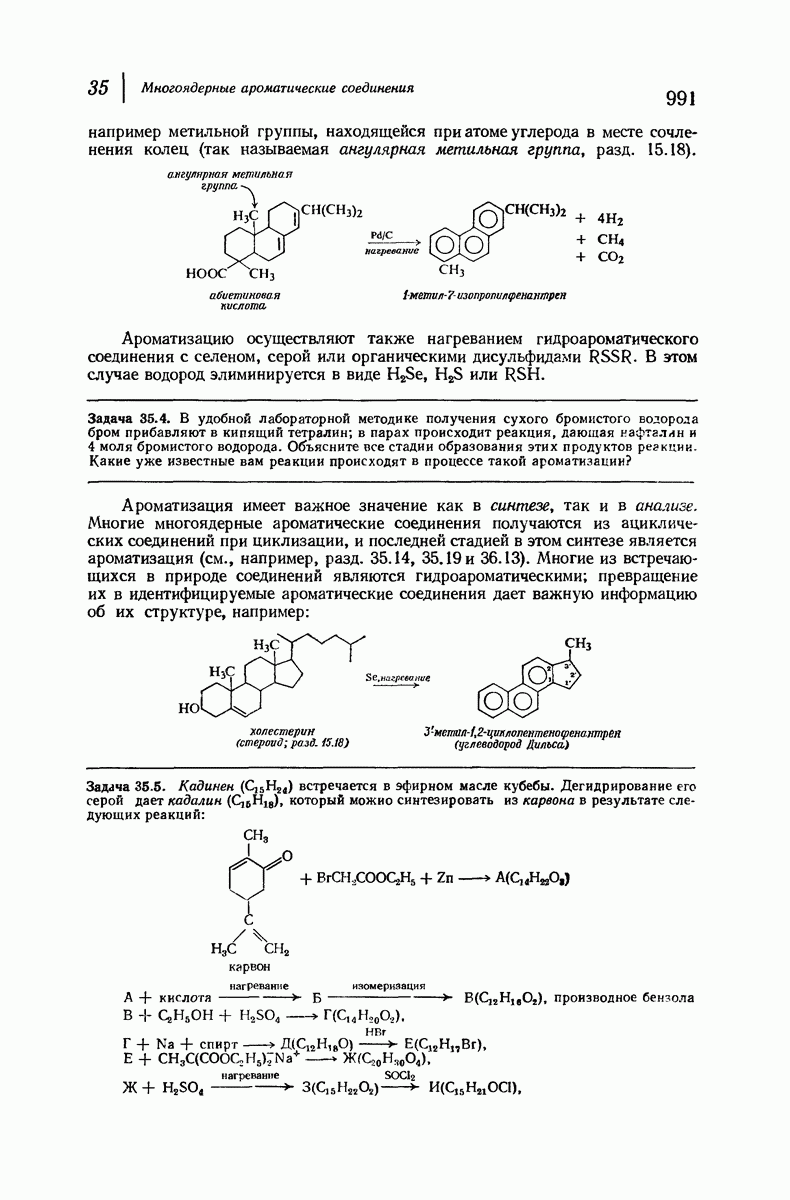
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
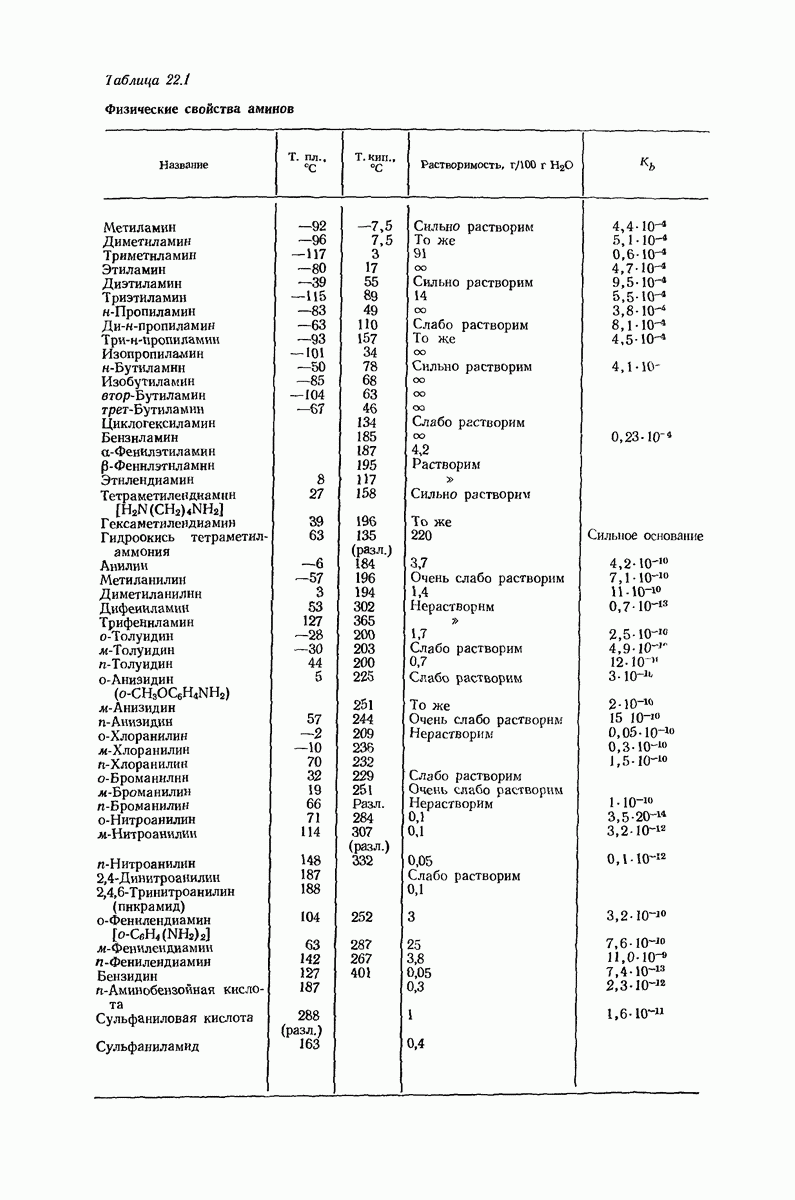
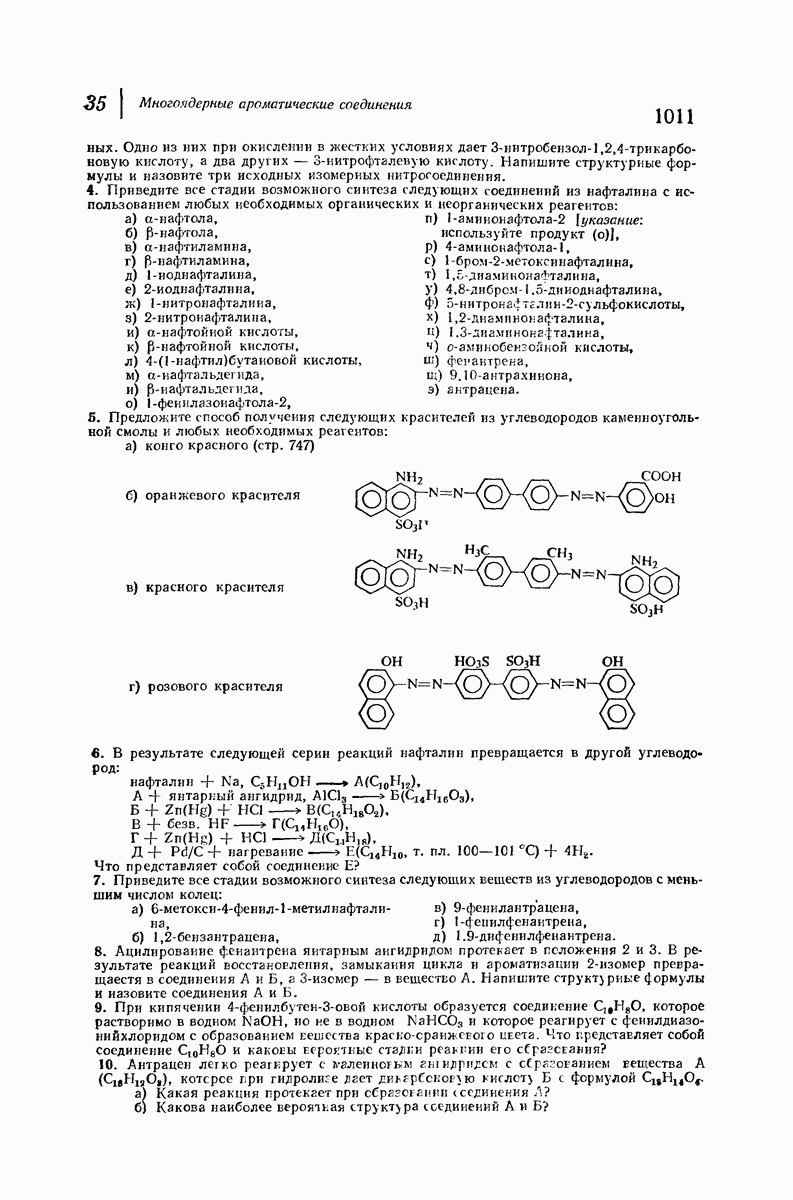
22.5. Соли аминов
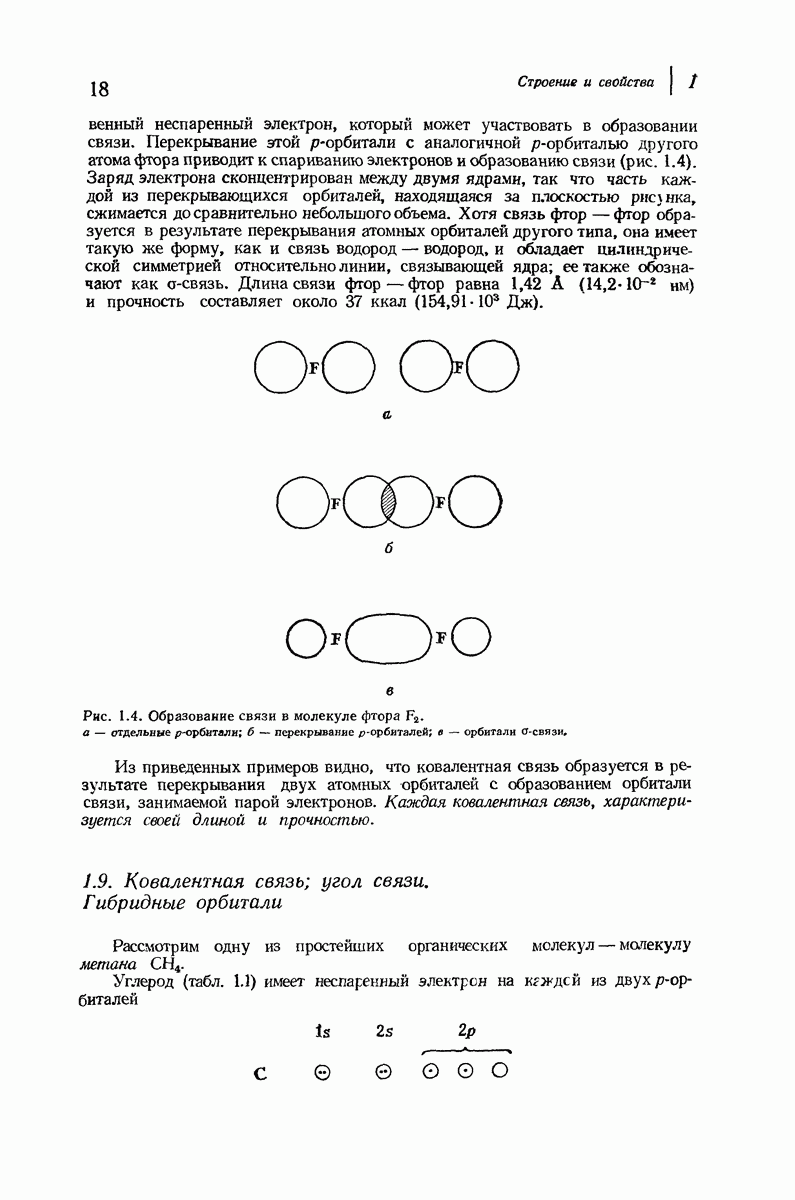
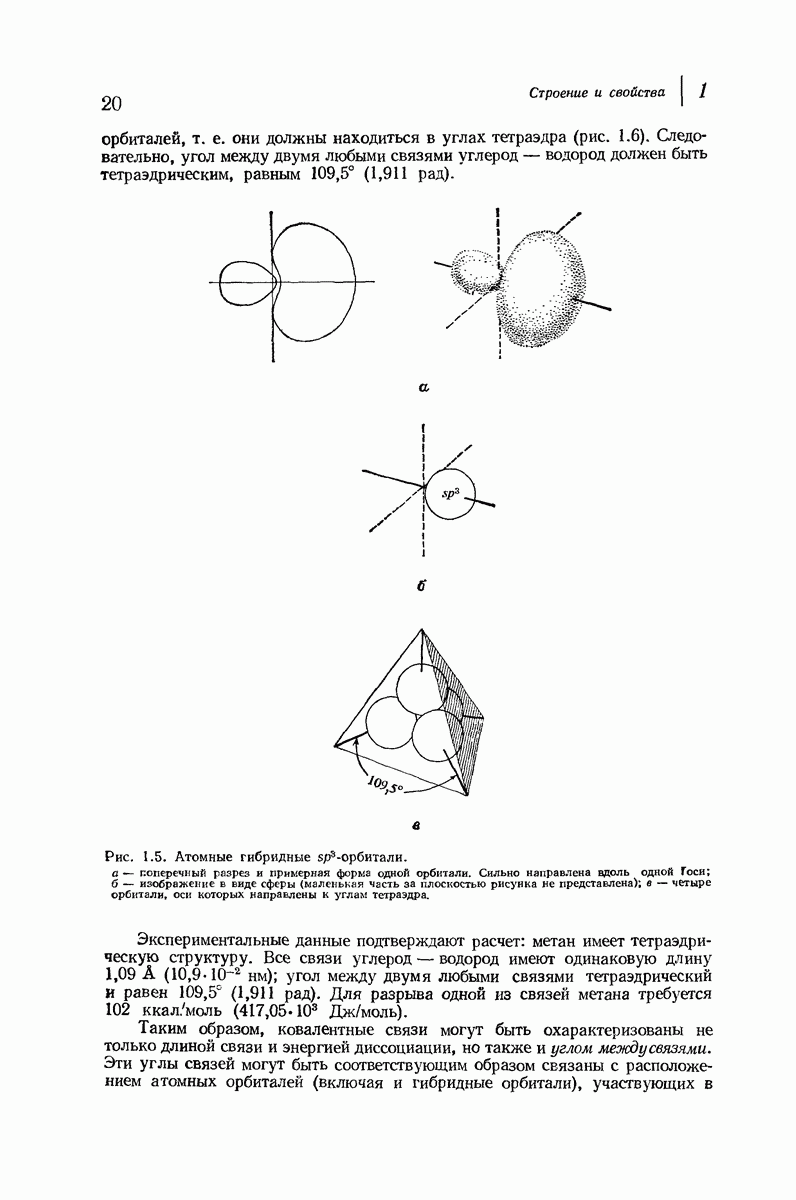
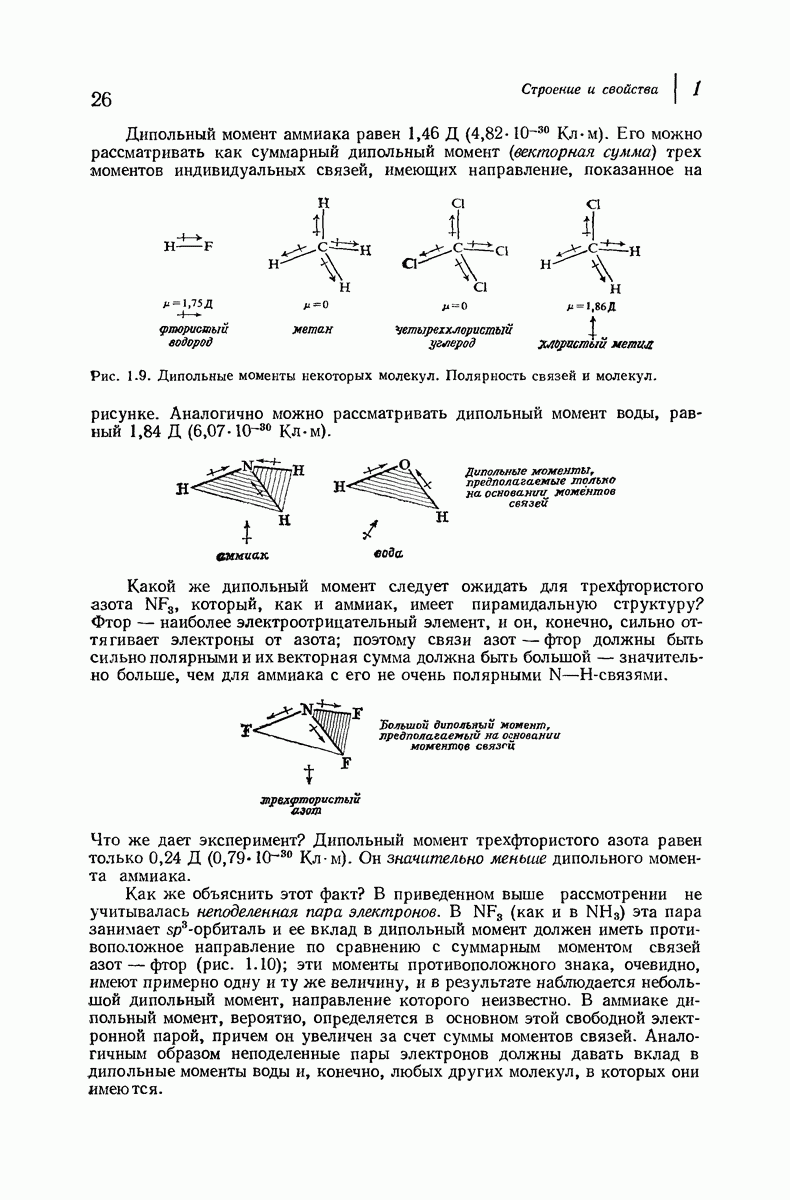
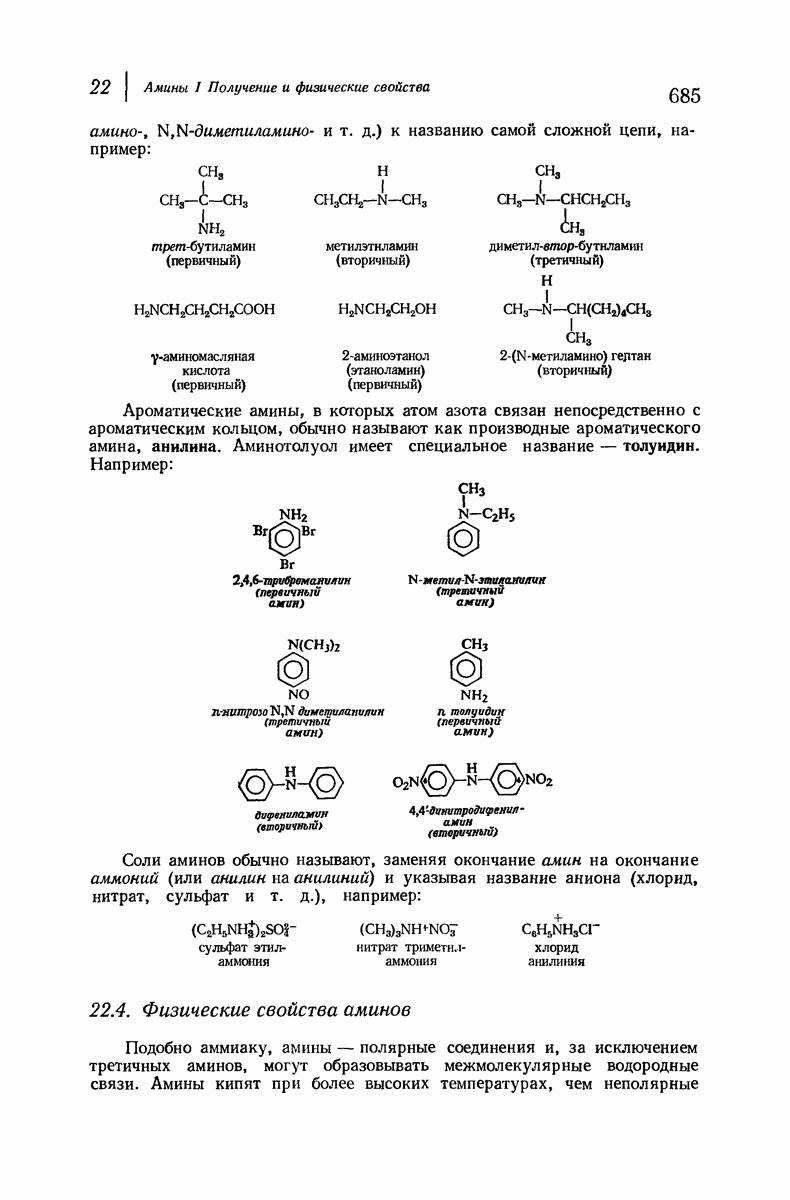
Алифатические амины обладают приблизительно такой же основностью, как и аммиак, а ароматические амины значительно менее основны. Амины гораздо менее основны, чем гидроксил- или этилат-ион, но они существенно более сильные основания, чем спирты, простые и сложные эфиры и т. д., а также вода. Под действием водных минеральных или карбоновых кислот амины легко превращаются в соли; водный раствор, содержащий гидроксил-ион, легко переводит соли обратно в свободные амины. Как и в случае карбоновых кислот, почти ни одна реакция аминов не происходит без превращения в соли и в свободные основания, и поэтому целесообразно рассмотреть свойства этих солей

В разд. 18.4 мы отметили резкое различие в физических свойствах карбоновых кислот и их солей; то же различие наблюдается при сопоставлении свойств аминов и их солей. Соли аминов — типичные ионные соединения. Они представляют собой нелетучие твердые вещества с высокой температурой плавления и при нагревании разлагаются обычно ниже температуры плавления. Галогениды, нитраты и сульфаты растворимы в воде, но не растворимы в неполярных растворителях.
Различие в растворимости аминов и их солей можно использовать как для обнаружения аминов, так и для их отделения от соединений, не являющихся основаниями. Органическое соединение, нерастворимое в воде, но растворимое в холодной разбавленной соляной кислоте, должно обладать заметными основными свойствами, что почти наверняка означает, что оно является амином. Амин можно отделить от соединений, не являющихся основаниями, по его растворимости в кислоте; после разделения амин можно регенерировать подщелачиванием водного раствора (см. в разд. 18.4 сходную ситуацию для карбоновых кислот).
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Предисловие
- 1 Строение и свойства
- 1.1. Органическая химия
- 1.2. Теория строения
- 1.3. Представление о химической связи до 1926 г.
- 1.4. Квантовая механика
- 1.5. Атомные орбитали
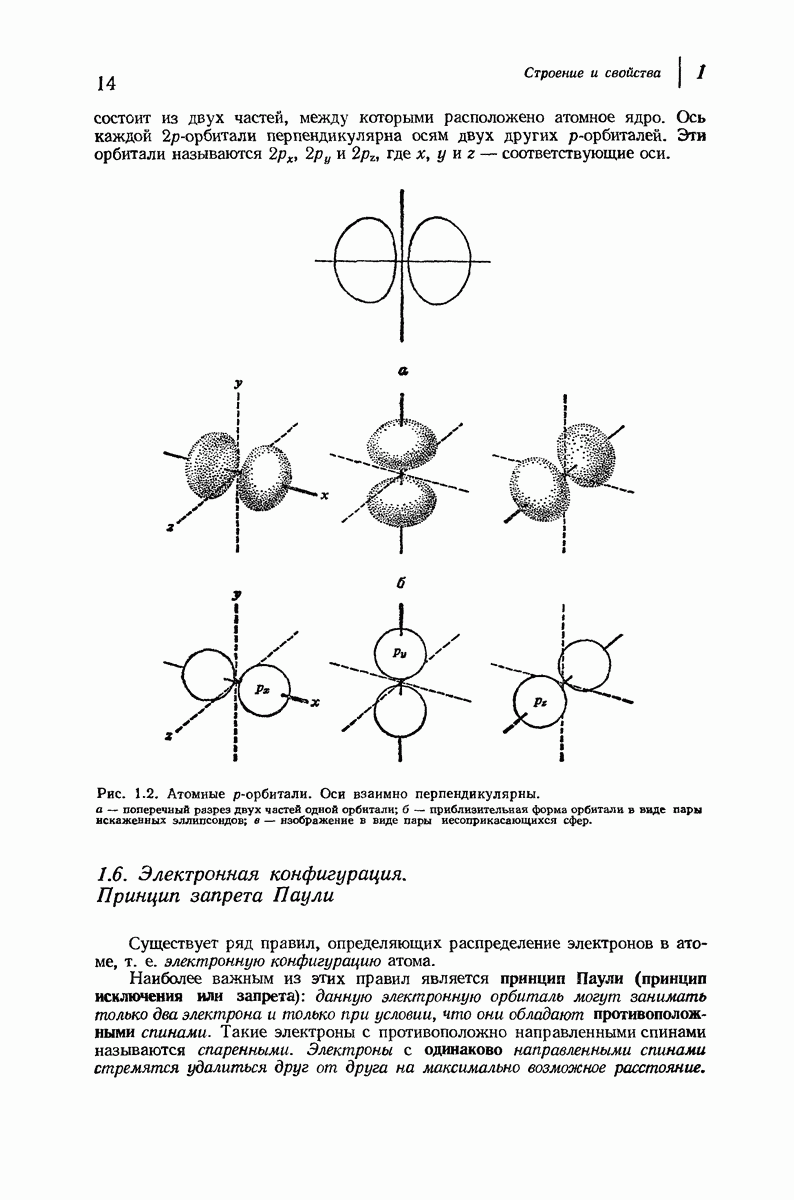
- 1.6. Электронная конфигурация. Принцип запрета Паули
- 1.7. Молекулярные орбитали
- 1.8. Ковалентная связь
- 1.10. Неподеленные пары электронов
- 1.11. Внутримолекулярные силы
- 1.12. Полярность связей
- 1.13. Полярность молекул
- 1.14. Строение и физические свойства
- 1.15. Температура плавления
- 1.16. Межмолекулярные силы
- 1.17. Температура кипения
- 1.18. Растворимость
- 1.19. Кислоты и основания
- 1.20. Изомерия
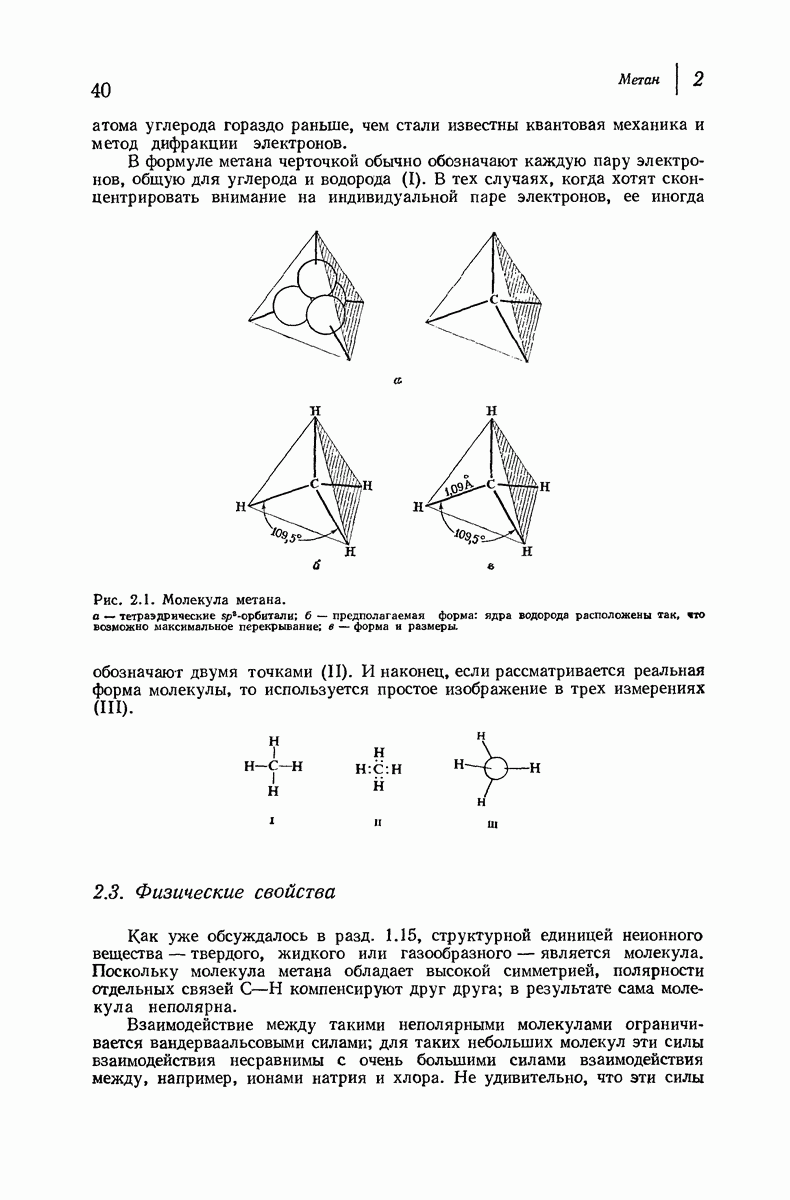
- 2. Метан. ЭНЕРГИЯ АКТИВАЦИИ. ПЕРЕХОДНОЕ СОСТОЯНИЕ
- 2.1. Углеводороды
- 2.2. Строение метана
- 2.3. Физические свойства
- 2.4. Источники
- 2.5. Реакции
- 2.6. Окисление. Теплота сгорания
- 2.7. Хлорирование: реакция замещения
- 2.8. Контроль за реакцией хлорирования
- 2.9. Реакции с другими галогенами: галогенирование
- 2.10. Относительная реакционная способность
- 2.11. Механизм реакции
- 2.12. Механизм хлорирования. Свободные радикалы
- 2.13. Цепные реакции
- 2.14. Ингибиторы
- 2.15. Проверка механизма хлорирования
- 2.16. Энергия диссоциации связей
- 2.17. Теплота реакции
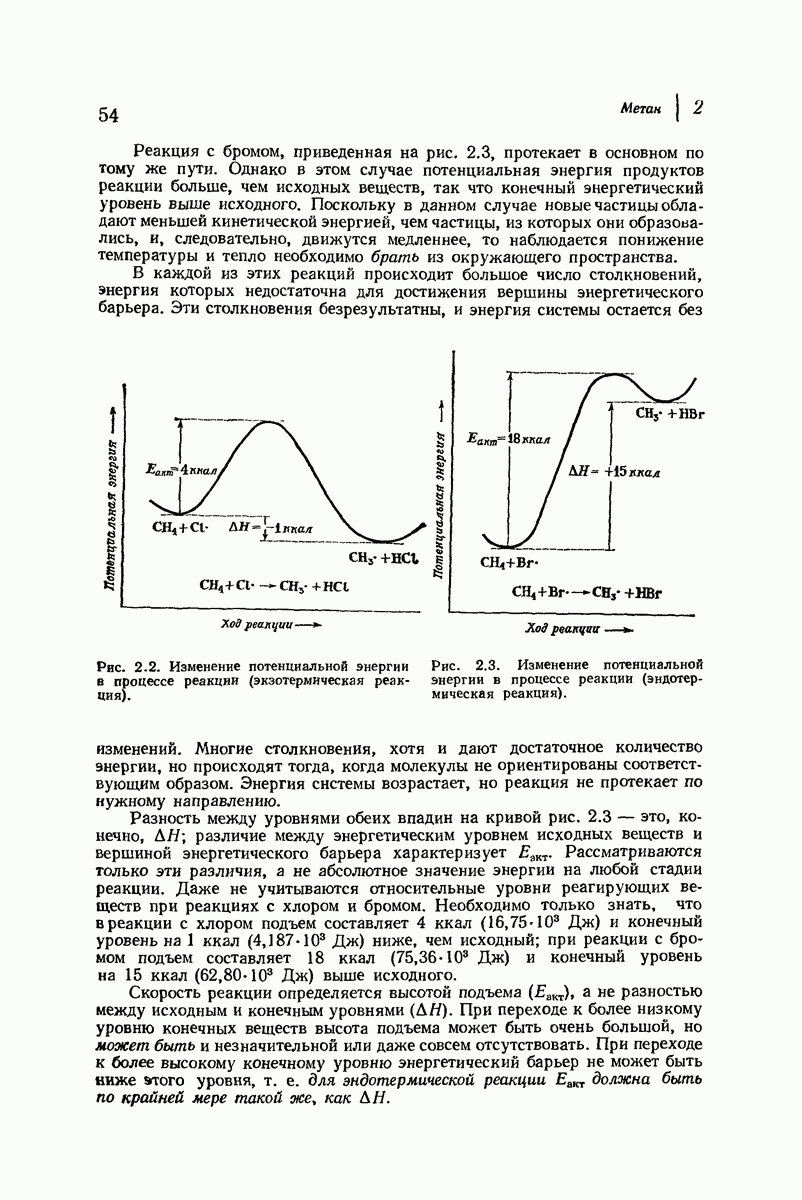
- 2.18. Энергия активации
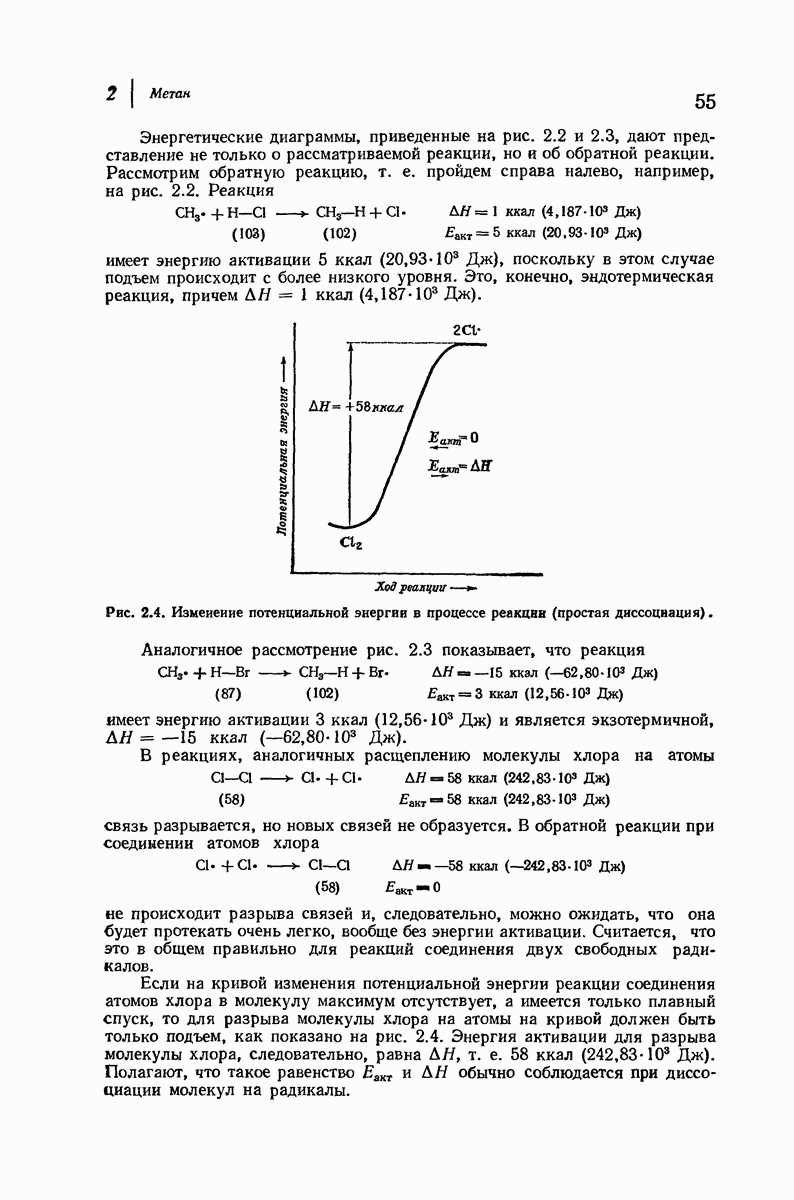
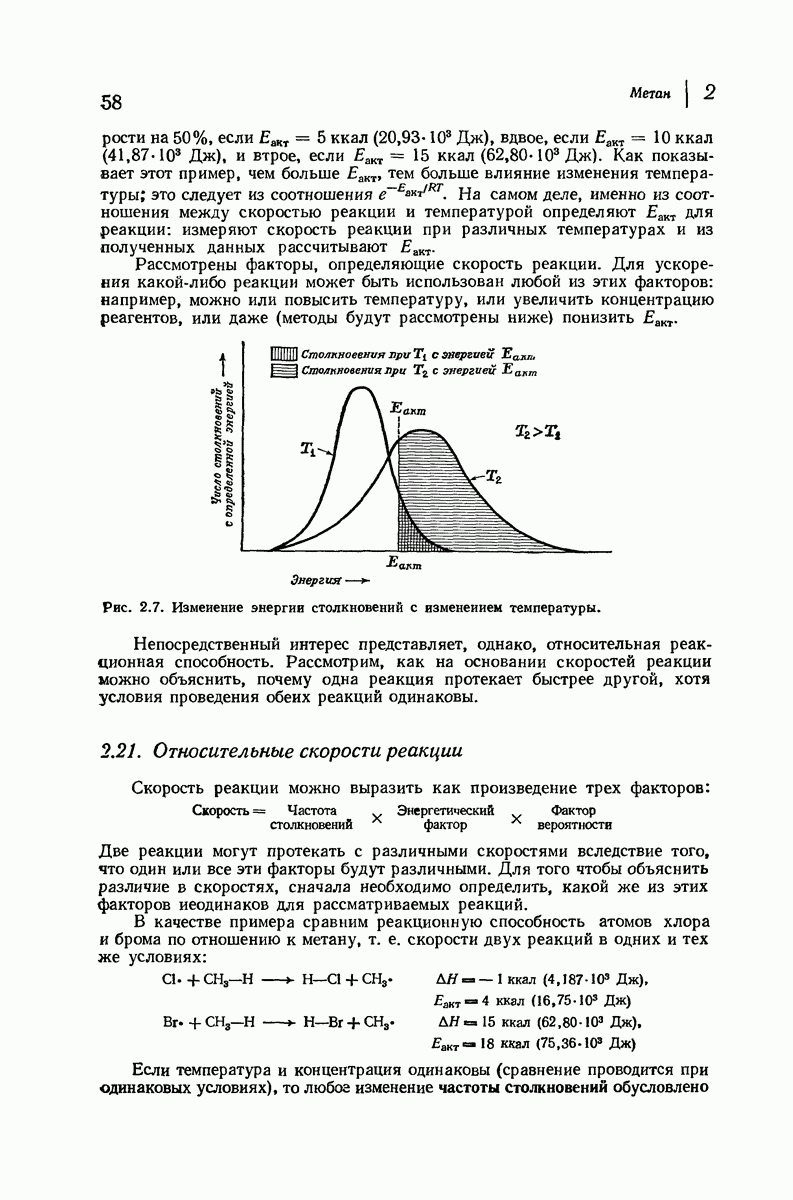
- 2.19. Течение реакции: изменение энергии
- 2.20. Скорость реакции
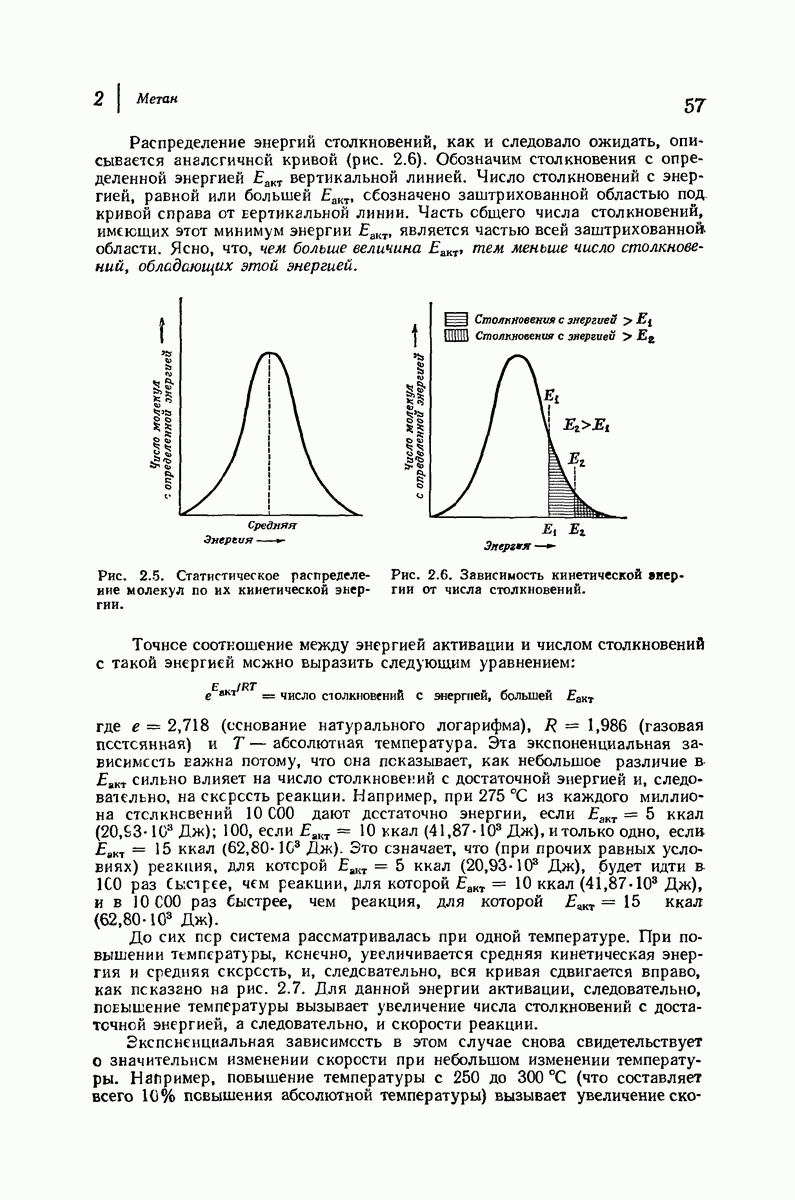
- 2.21. Относительные скорости реакции
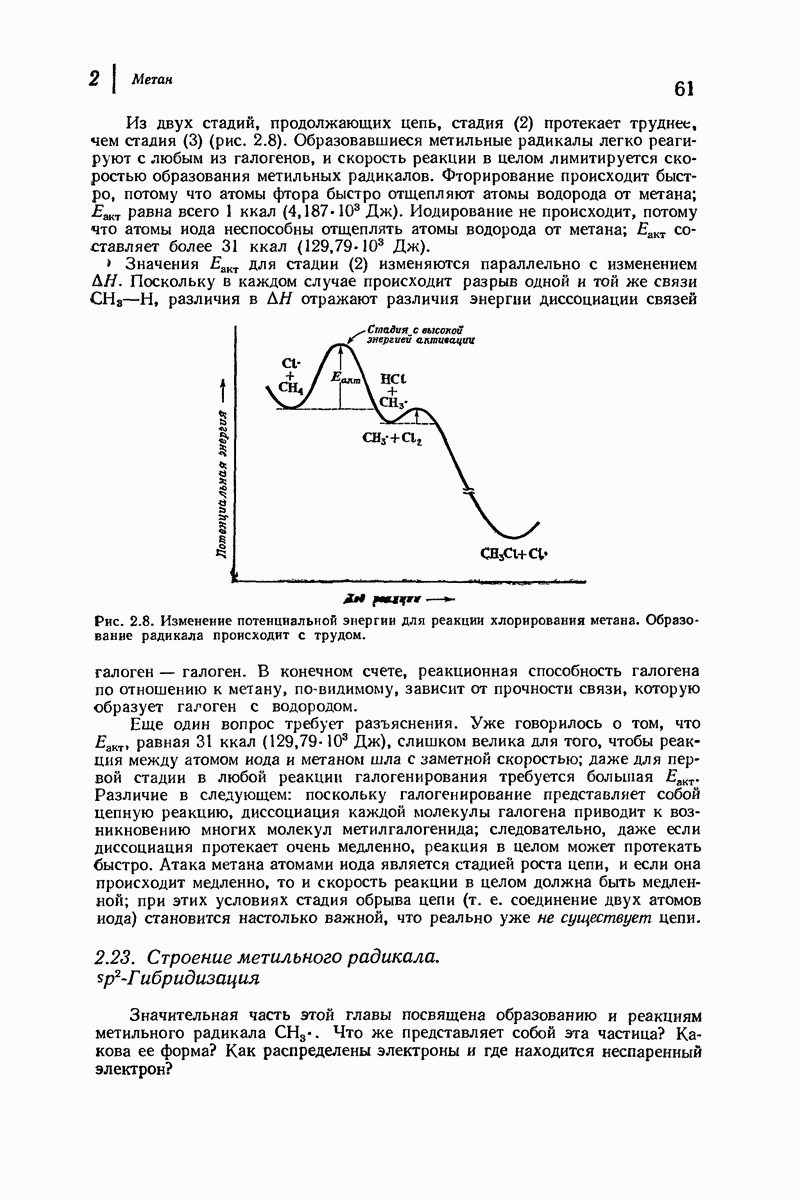
- 2.22. Реакционная способность галогенов по отношению к метану
- 2.23. Строение метильного радикала. sp2-Гибридизация
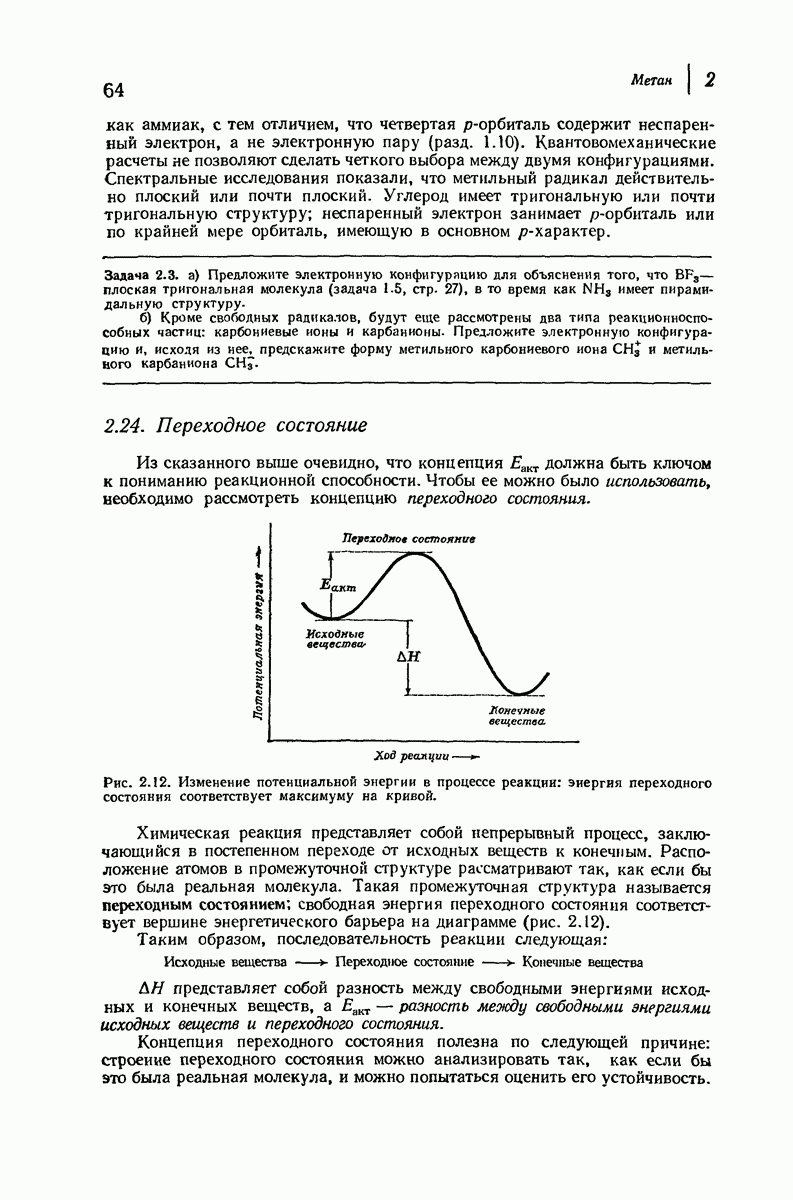
- 2.24. Переходное состояние
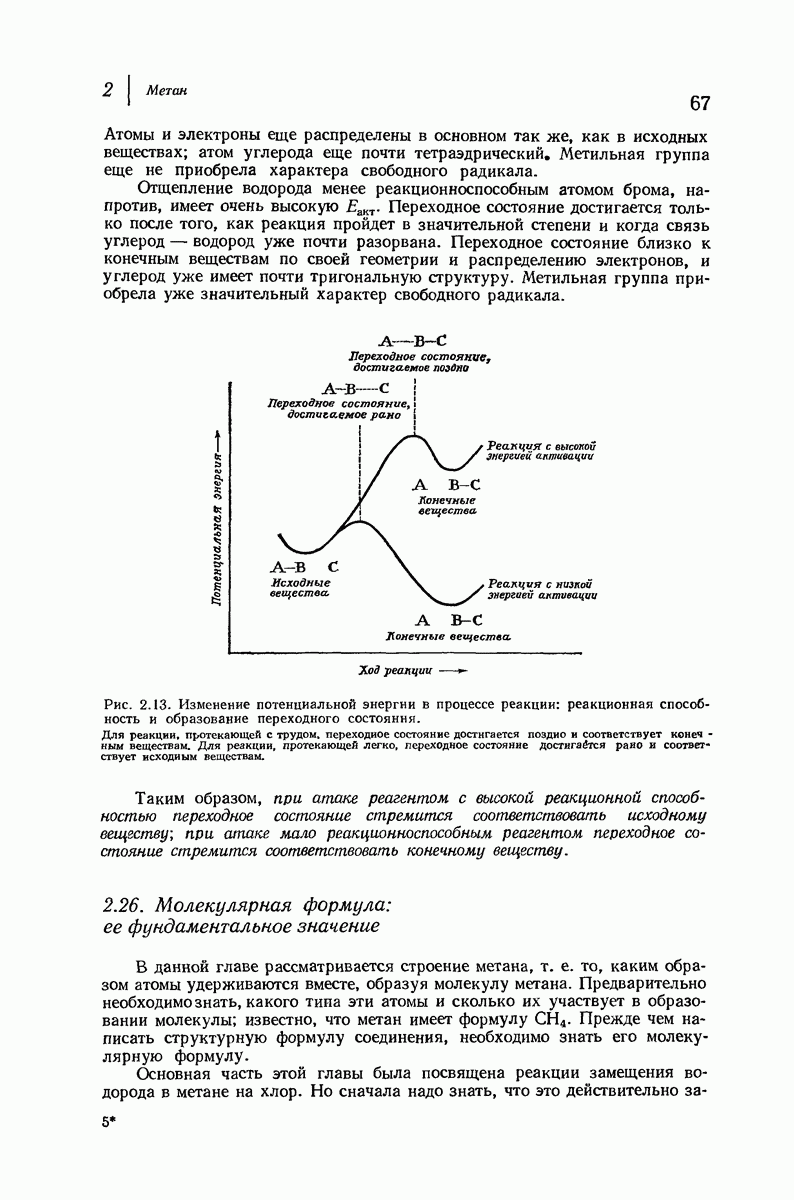
- 2.25. Реакционная способность и переходное состояние
- 2.26. Молекулярная формула: ее фундаментальное значение
- 2.27. Качественный элементный анализ: углерод, водород и галоген
- 2.28. Количественный элементный анализ: углерод, водород и галоген
- 2.29. Эмпирическая формула
- 2.30. Определение молекулярного веса: метод определения плотности пара. Молекулярная формула
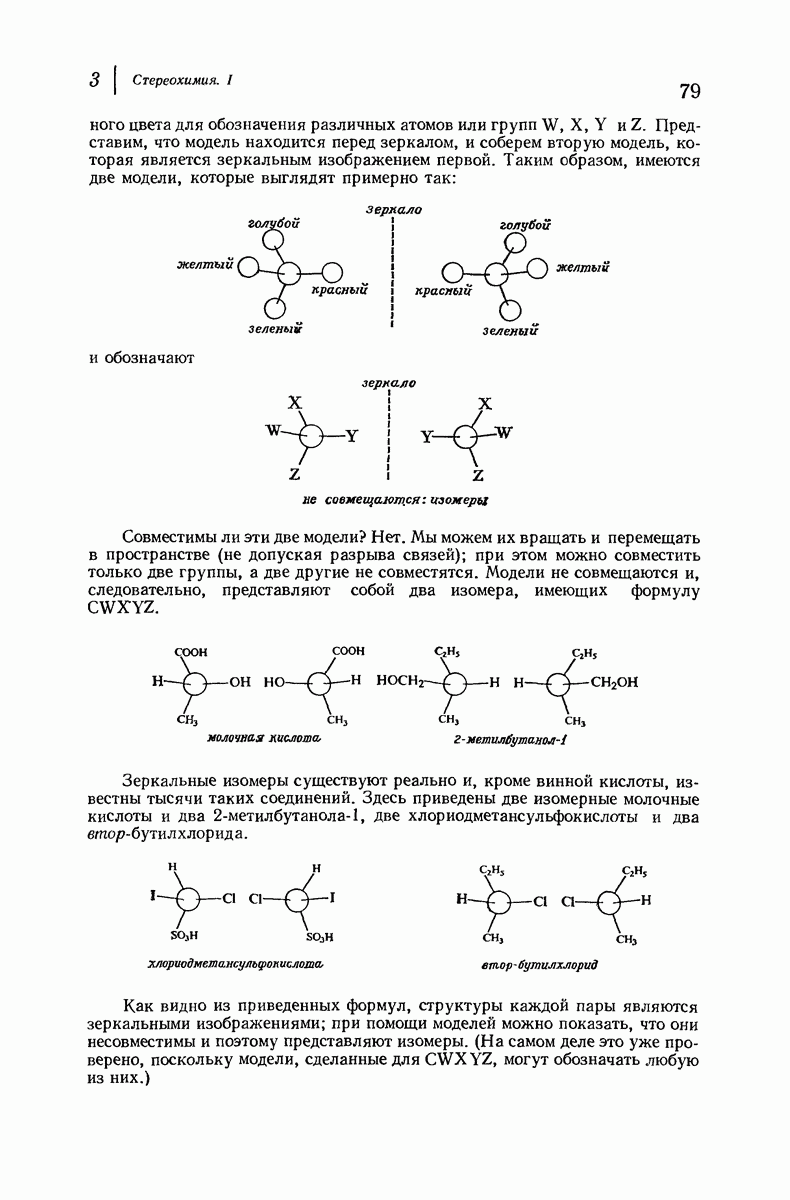
- 3. Стереохимия. I
- 3.1. Стереохимия и стереоизомерия
- 3.2. Число стереоизомеров и тетраэдрический атом углерода
- 3.3. Оптическая активность. Плоскополяризованный свет
- 3.4. Поляриметр
- 3.5. Удельное вращение
- 3.6. Открытие энантиомерии
- 3.7. Энантиомерия и тетраэдрический атом углерода
- 3.8. Энантиомерия и оптическая активность
- 3.9. Предсказание энантиомерии. Диссимметрия
- 3.10. Асимметрический атом углерода
- 3.11. Энантиомеры
- 3.12. Рацемическая модификация
- 3.13. Оптическая активность: более подробное рассмотрение
- 3.14. Конфигурация
- 3.15. Обозначения конфигурации: R и S
- 3.16. Правила старшинства
- 3.17. Обозначение конфигурации соединений с несколькими асимметрическими атомами
- 4. Алканы. Свободнорадикальное замещение
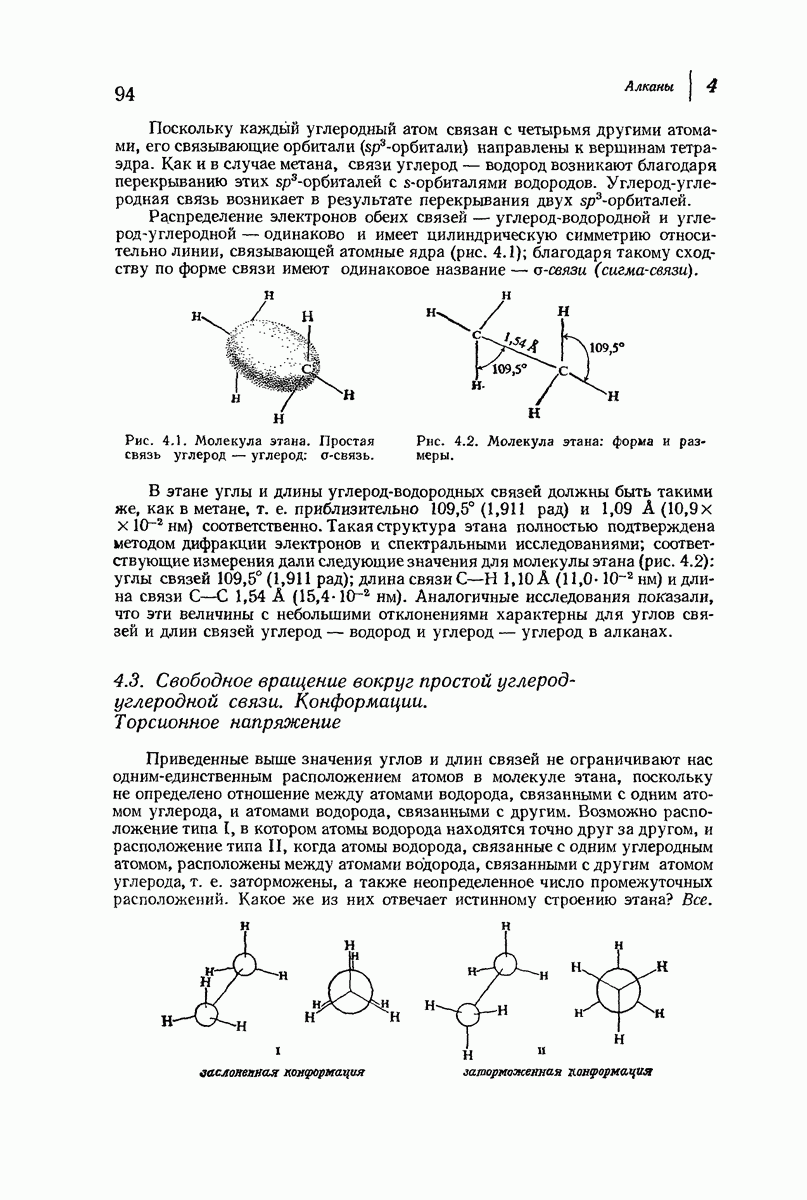
- 4.2. Строение этана
- 4.3. Свободное вращение вокруг простой углерод-углеродной связи. Конформации. Торсионное напряжение
- 4.4. Пропан и бутаны
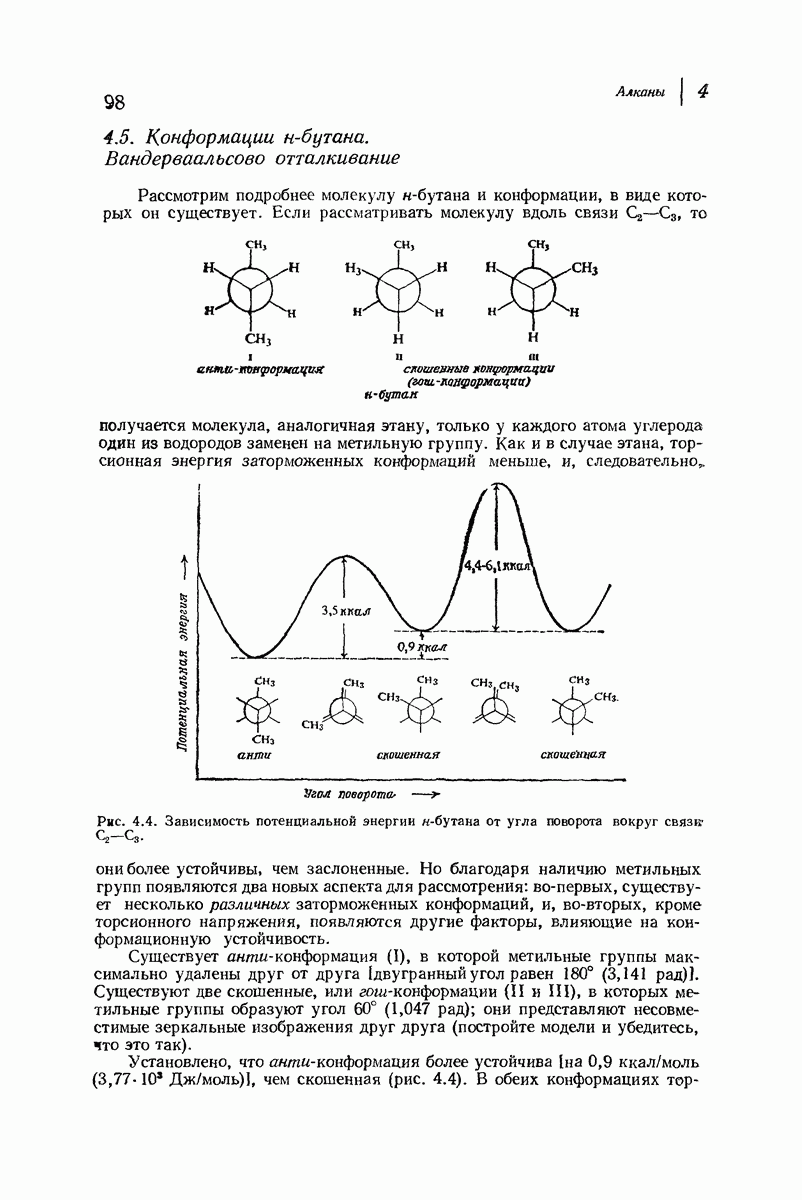
- 4.5. Конформации н-бутана. Вандерваальсово отталкивание
- 4.6. Конформационные изомеры
- 4.7. Конформационный анализ. Диполь-дипольные взаимодействия
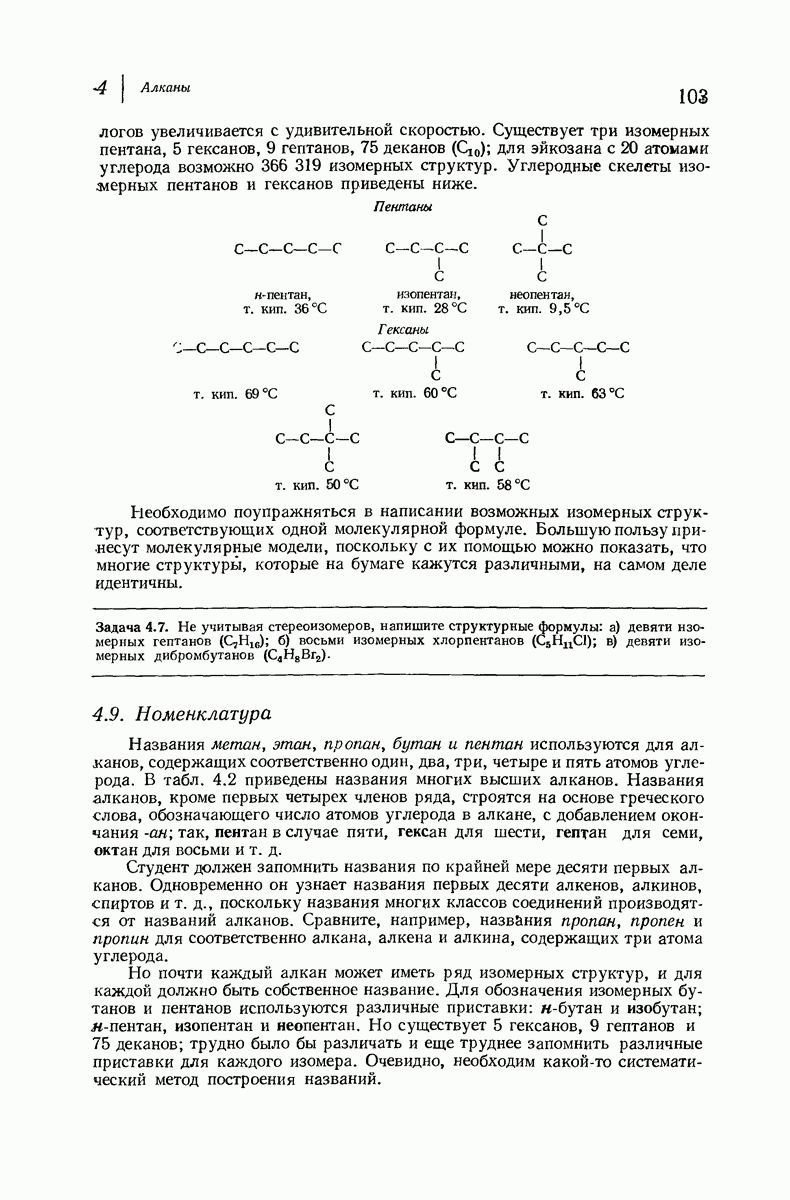
- 4.8. Высшие алканы. Гомологический ряд
- 4.9. Номенклатура
- 4.10. Алкильные группы
- 4.11. Тривиальные названия
- 4.12. Номенклатура IUPAC
- 4.13. Типы углеродных и водородных атомов
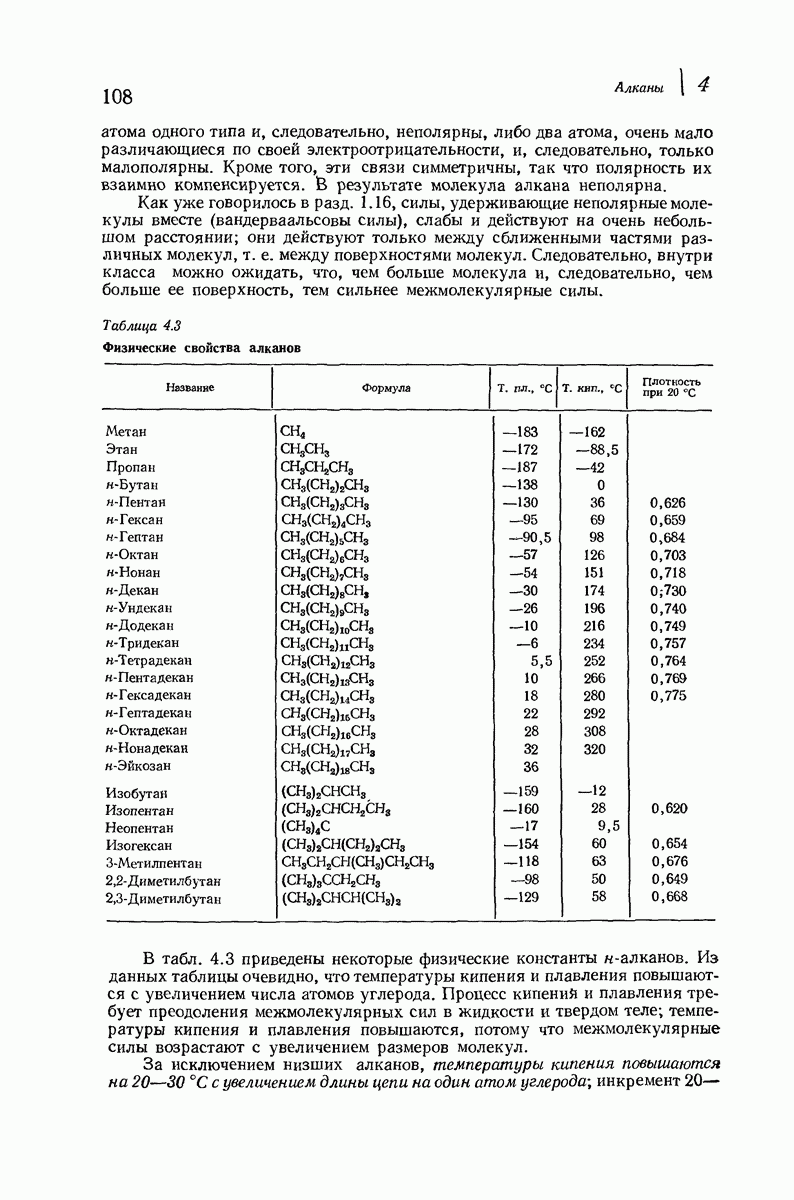
- 4.14. Физические свойства
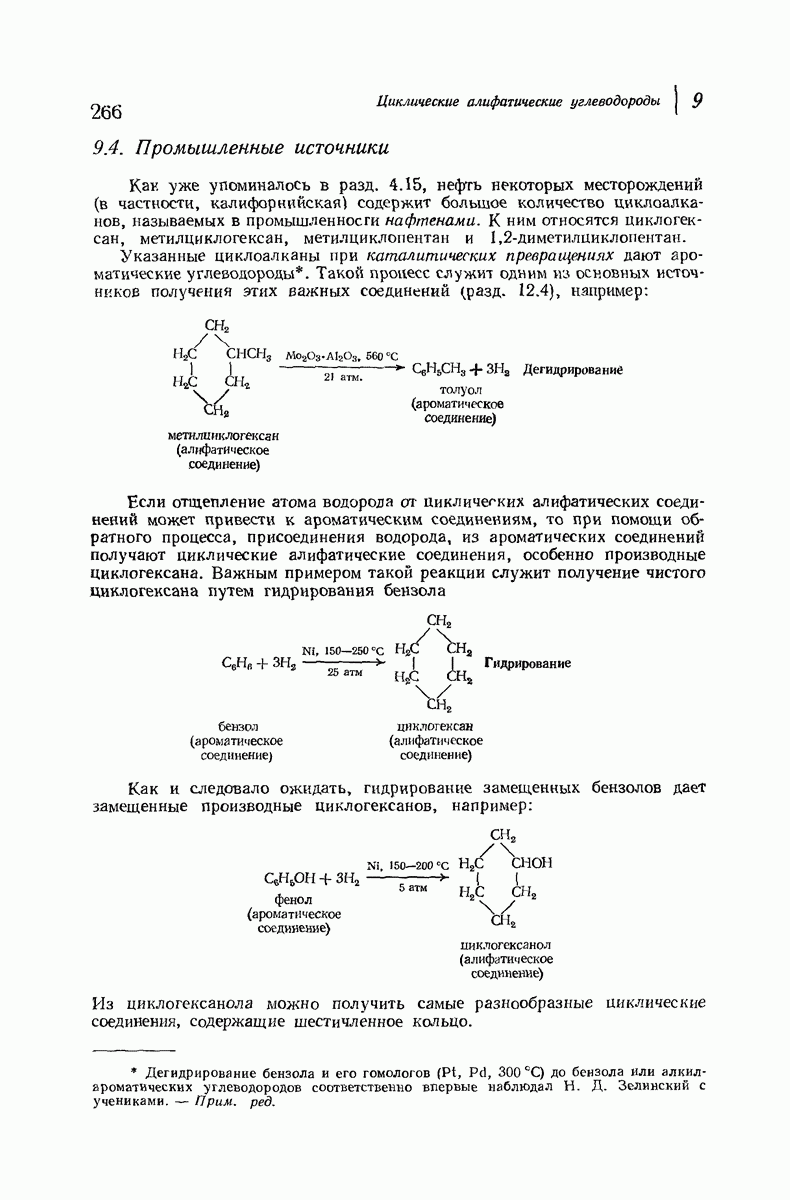
- 4.15. Промышленные источники
- 4.16. Получение в промышленности и в лаборатории
- 4.17. Методы синтеза
- 4.18. Реактив Гриньяра
- 4.19. Реакция Вюрца
- 4.20. Реакции
- 4.21. Галогенирование
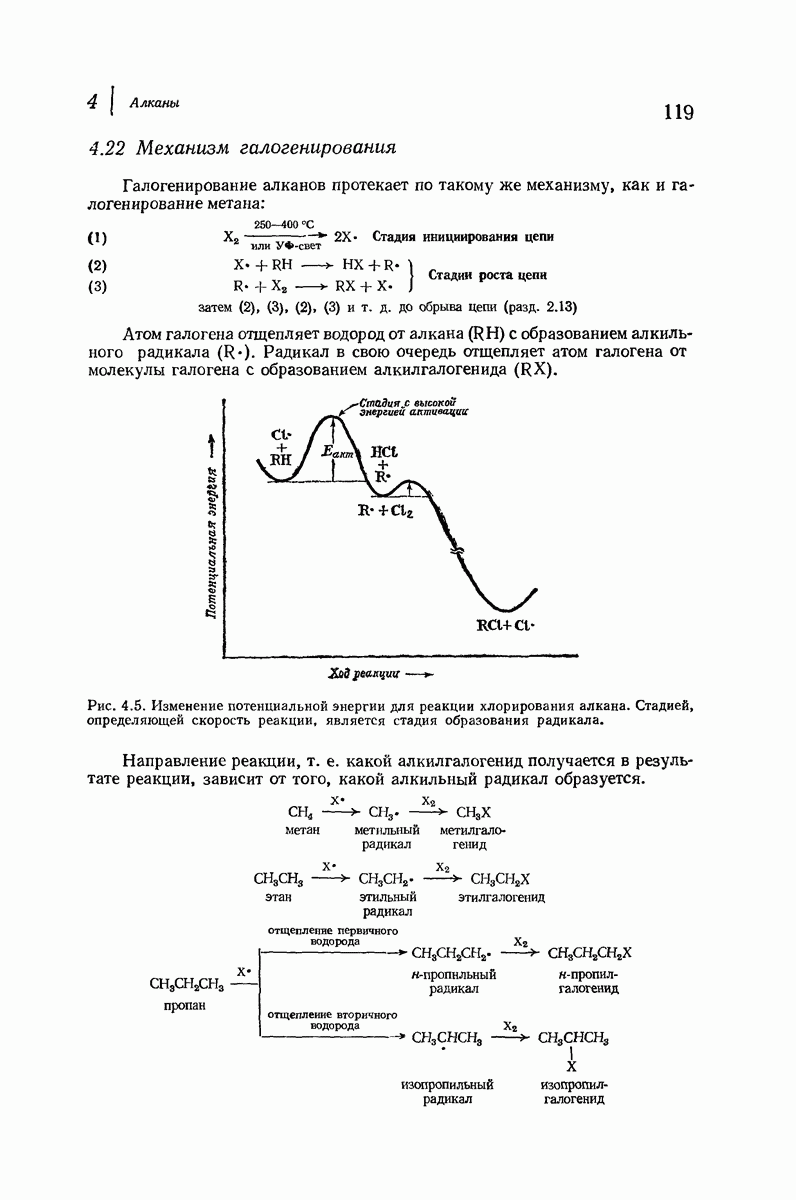
- 4.22 Механизм галогенирования
- 4.23. Ориентация при галогенировании
- 4.24. Относительная реакционная способность алканов в реакциях галогенирования
- 4.25. Легкость отщепления атомов водорода. Энергия активации
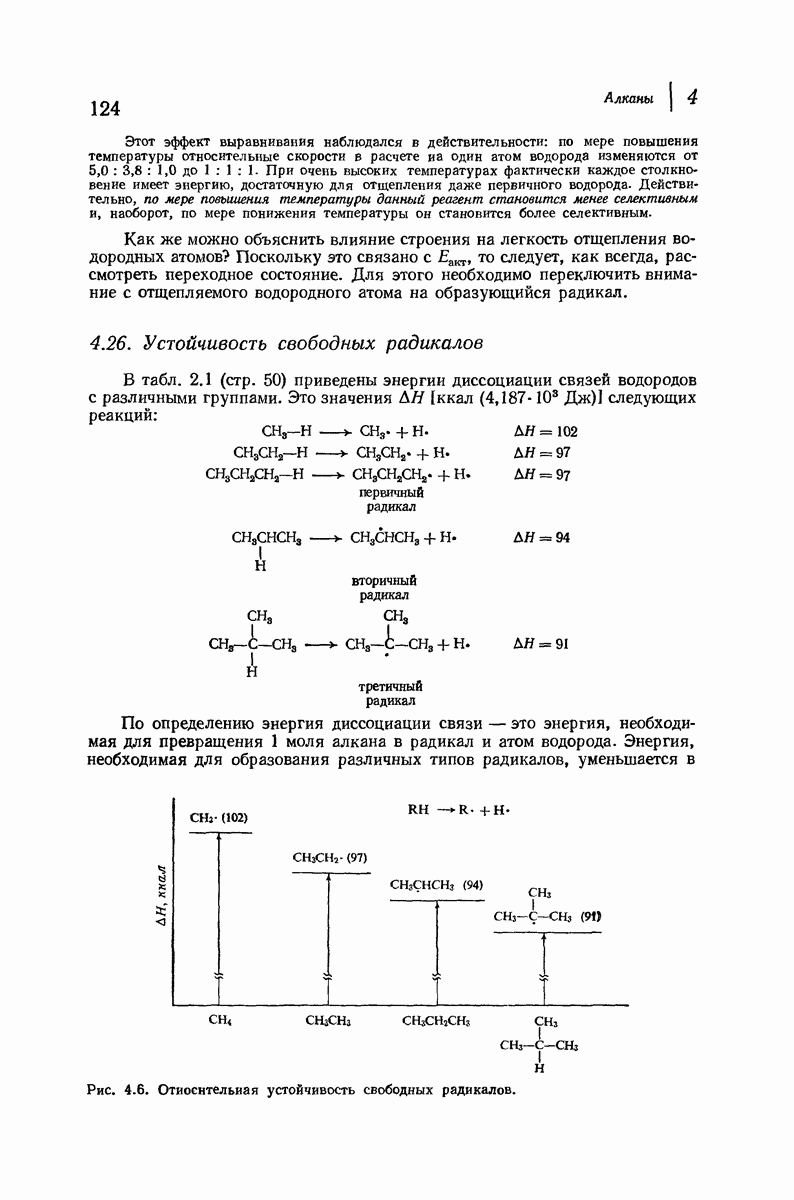
- 4.26. Устойчивость свободных радикалов
- 4.27. Легкость образования свободных радикалов
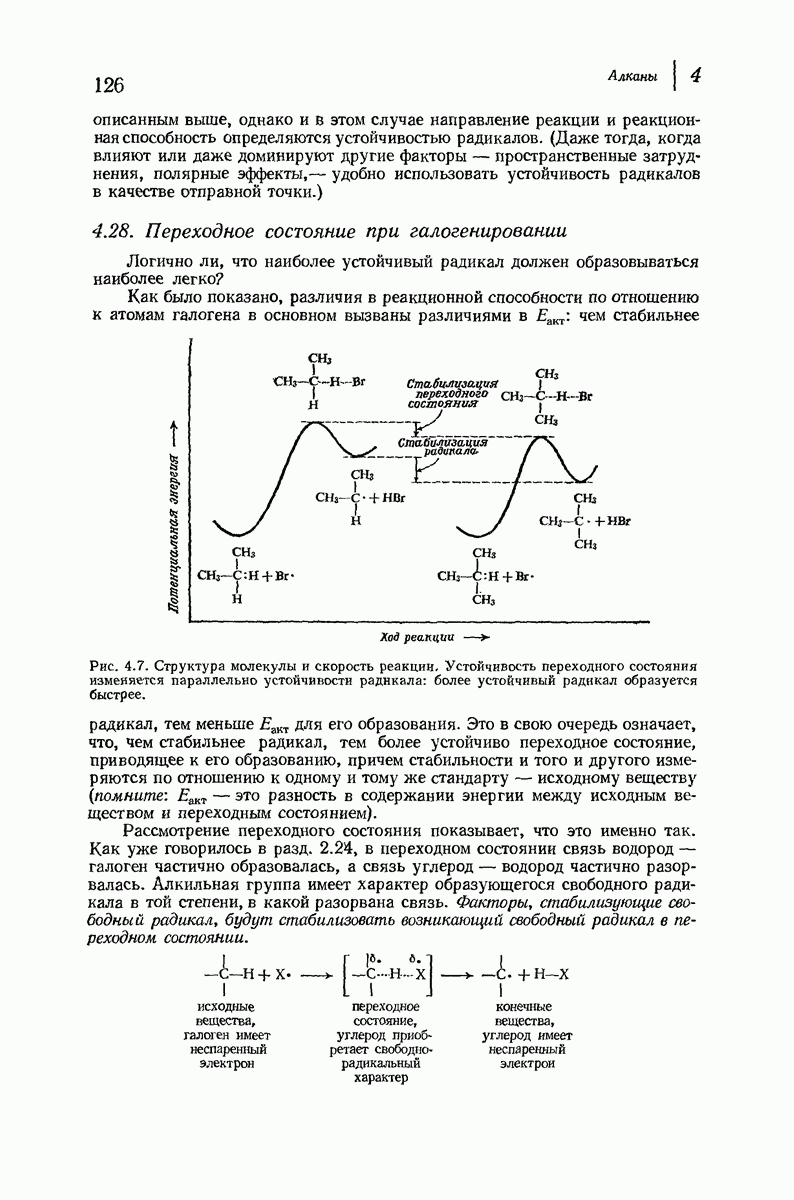
- 4.28. Переходное состояние при галогенировании
- 4.29. Направление реакции и реакционная способность
- 4.30. Реакционная способность и избирательность
- 4.31. Отсутствие перегруппировок свободных радикалов. Изотопные метки
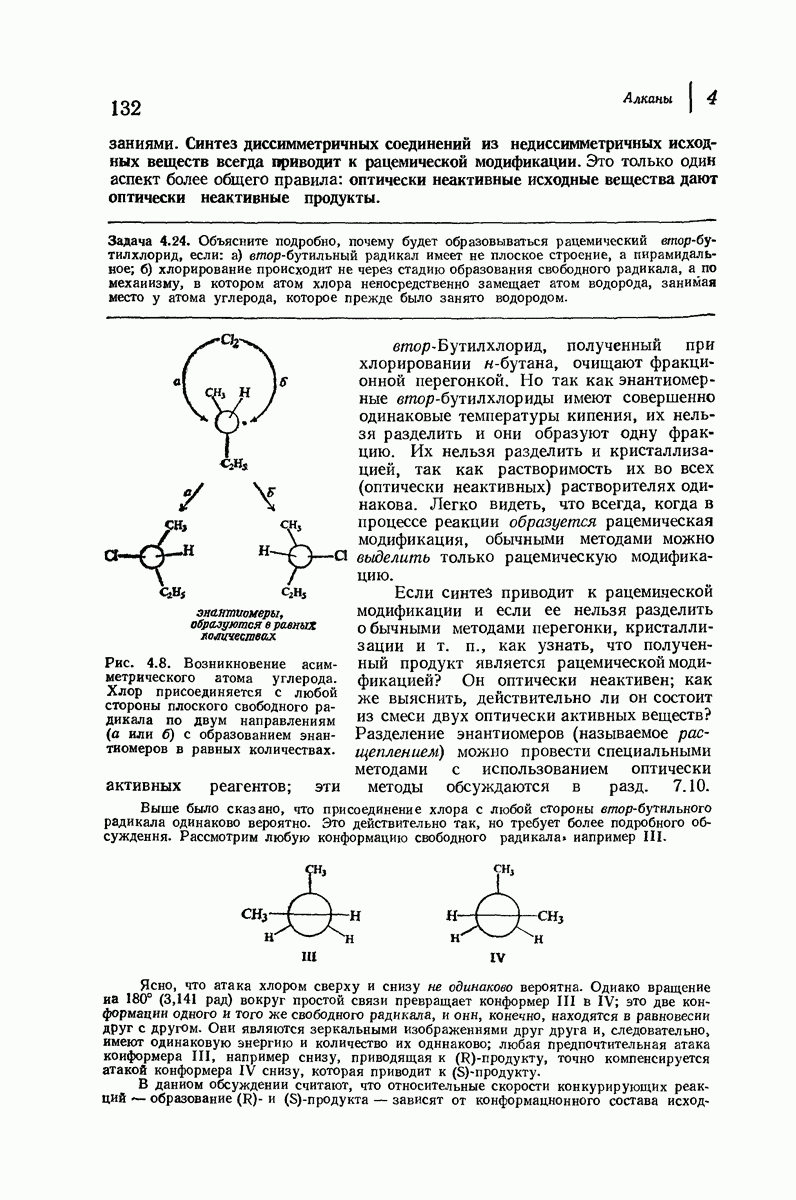
- 4.32 Синтез и оптическая активность. Возникновение асимметрического атома углерода
- 4.33. Метилен (карбен). Внедрение
- 4.34. Горение
- 4.35. Пиролиз: крекинг
- 4.36. Определение строения
- 4.37. Анализ алканов
- 5. Алкены. I. Строение и получение
- 5.1. Ненасыщенные углеводороды
- 5.2. Строение этилена. Двойная углерод-углеродная связь
- 5.3. Гибридизация и размер орбиталей
- 5.4. Пропилен
- 5.5. Бутилены
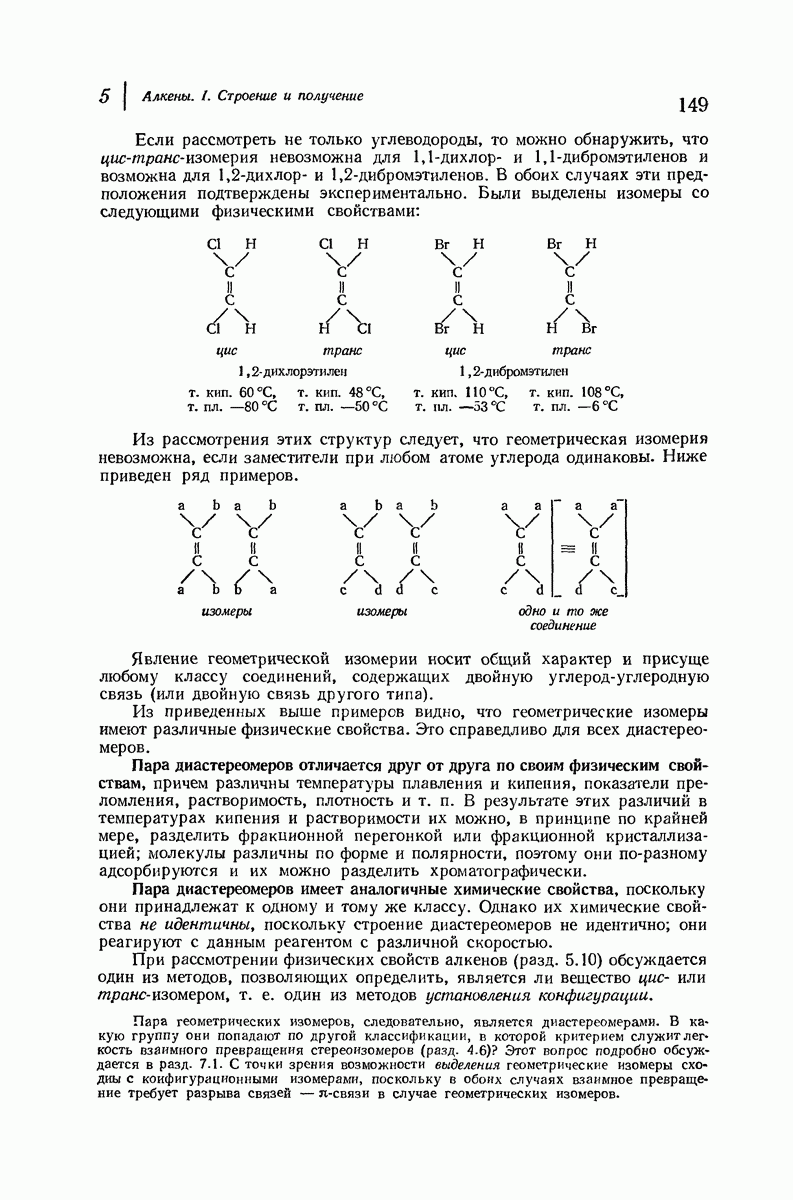
- 5.6. Диастереомерия: геометрическая изомерия
- 5.7. Высшие алкены
- 5.8. Общие названия
- 5.9. Номенклатура IUPAC
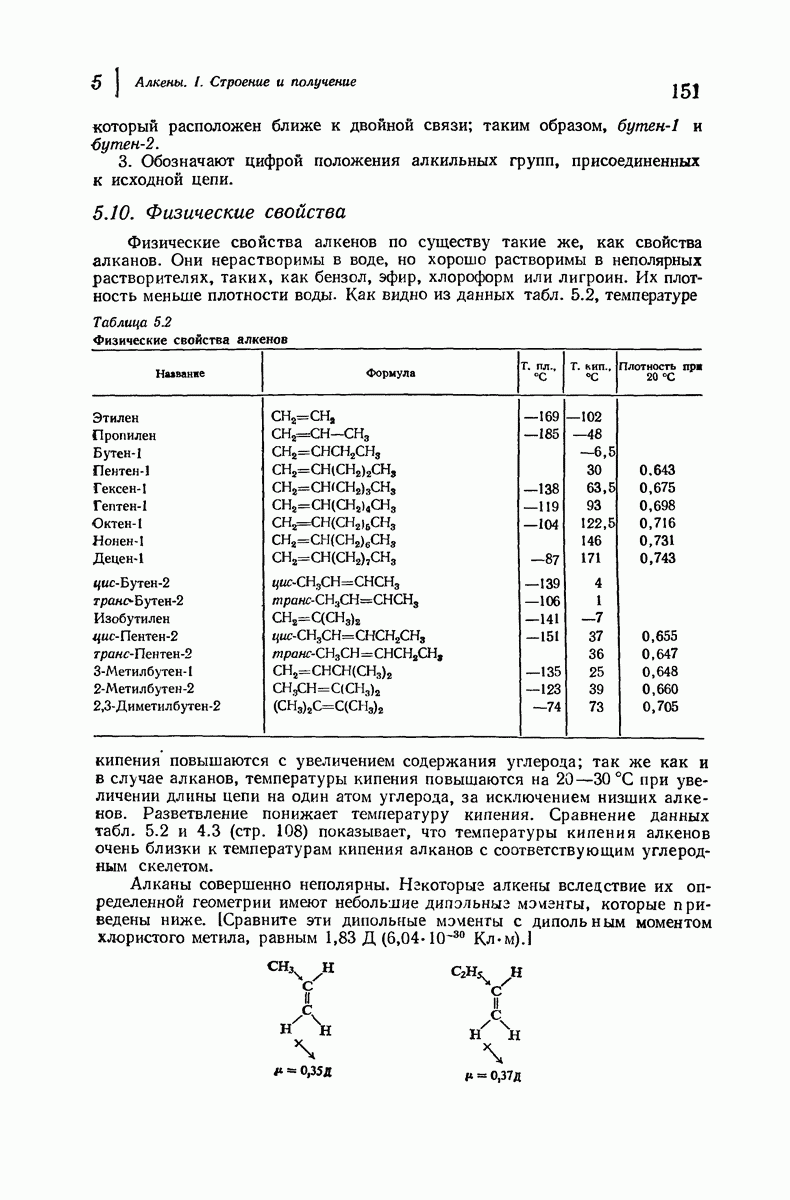
- 5.10. Физические свойства
- 5.11. Промышленные источники
- 5.12. Методы синтеза
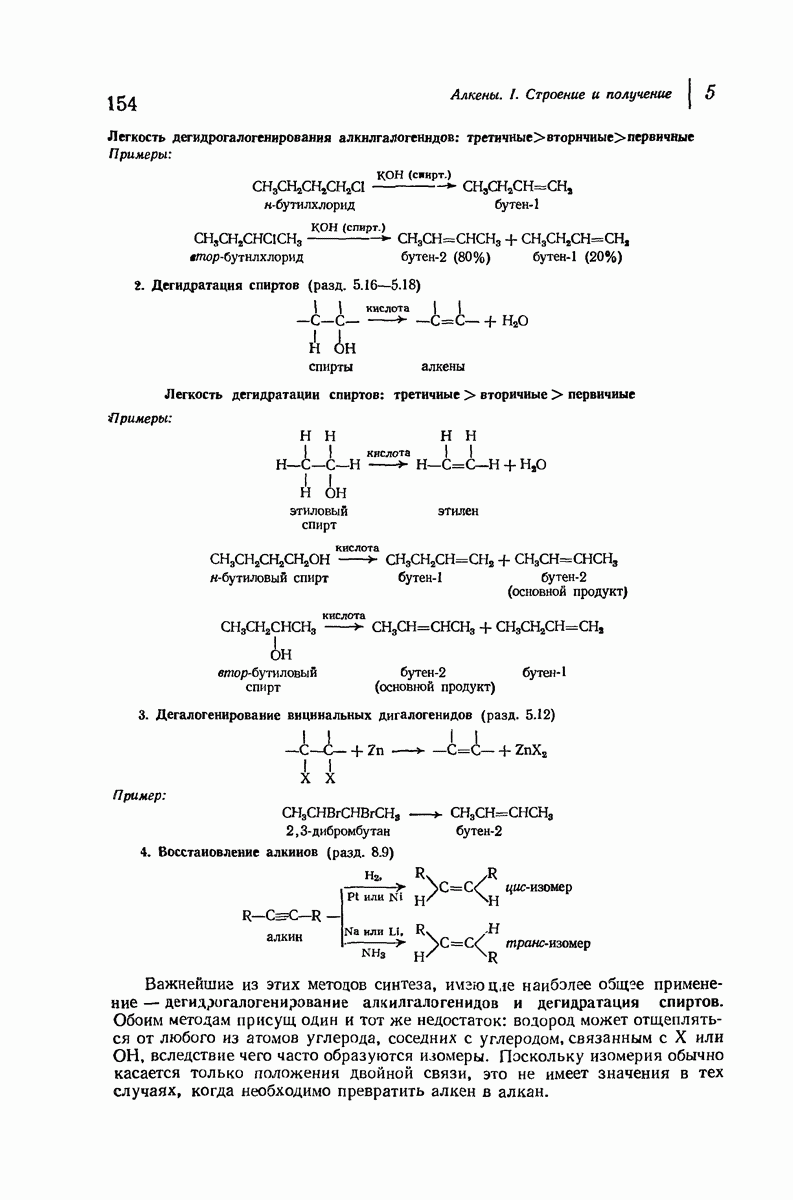
- 5.13. Дегидрогалогенирование алкилгалогенидов
- 5.14. Механизм дегидрогалогенирования
- 5.15. Направление реакции и реакционная способность при дегидрогалогенировании
- 5.16. Дегидратация спиртов
- 5.17. Теория карбониевых ионов
- 5.18. Механизм дегидратации спиртов
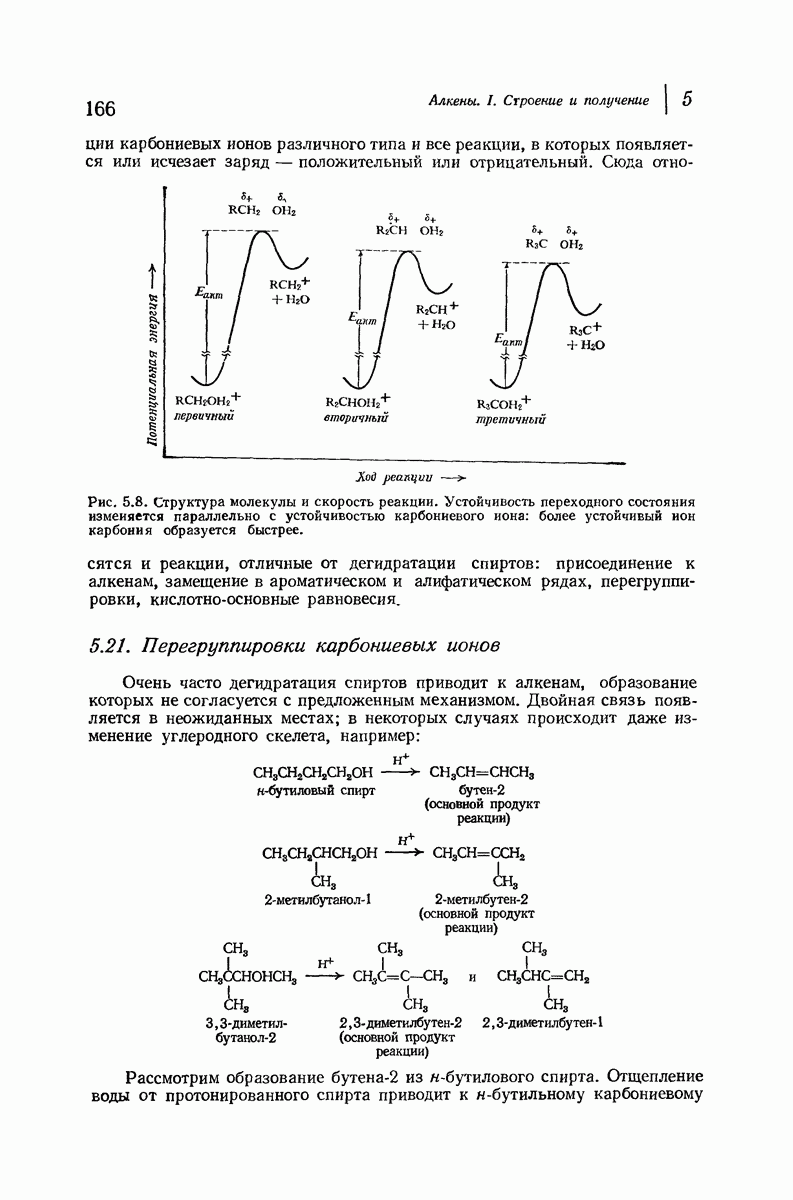
- 5.19. Устойчивость карбониевых ионов. Распределение заряда
- 5.20. Легкость образования карбониевых ионов
- 5.21. Перегруппировки карбониевых ионов
- 5.22. Направление реакции и реакционная способность при дегидратации
- 6 Алкены II. Реакции двойной углерод-углеродной связи
- 6.2. Реакции двойной углерод-углеродной связи: присоединение
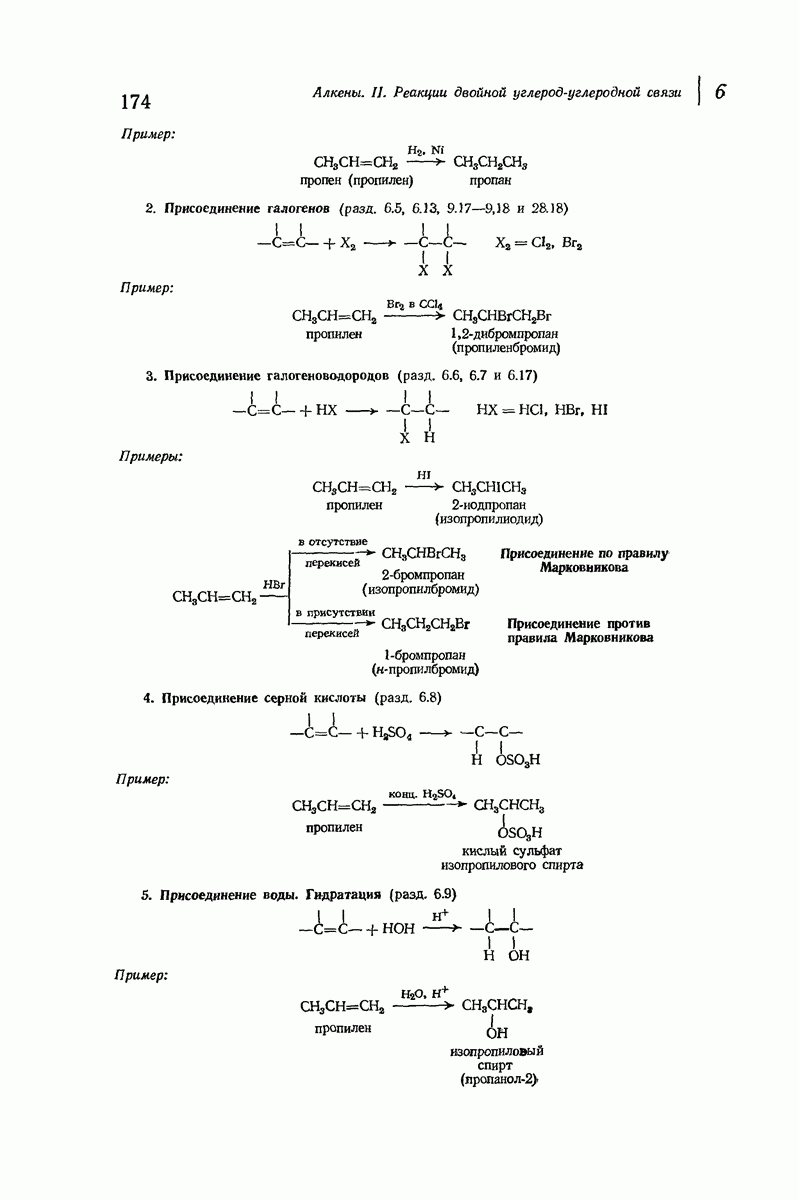
- 6.3. Гидрирование. Теплота гидрирования
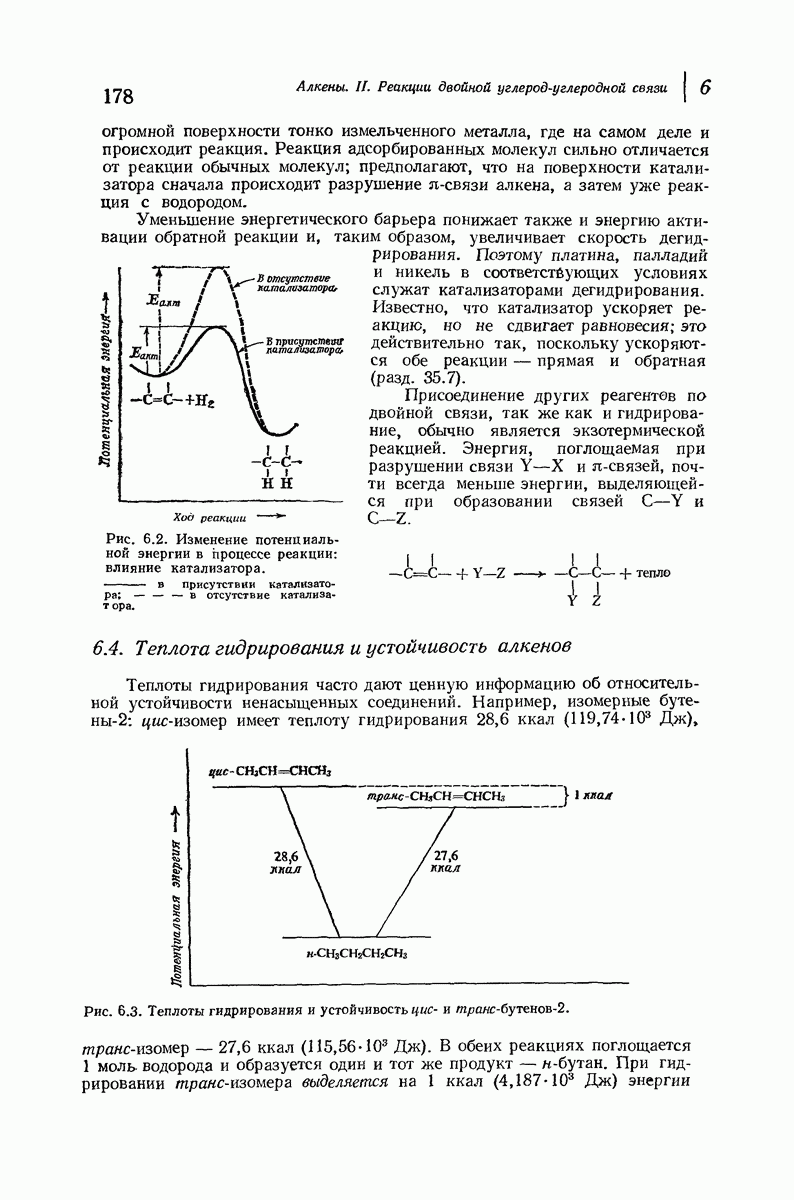
- 6.4. Теплота гидрирования и устойчивость алкенов
- 6.5. Присоединение галогенов
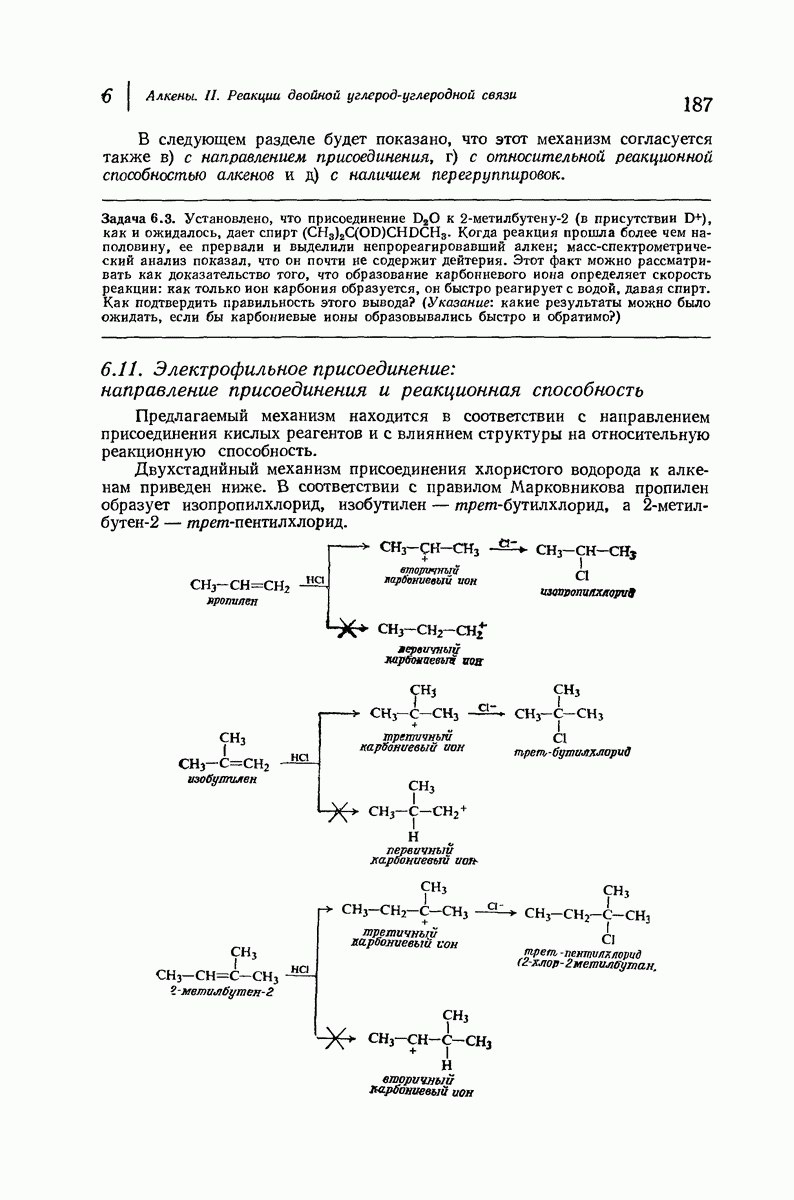
- 6.6. Присоединение галогеноводородов. Правило Марковникова
- 6.7. Присоединение бромистого водорода. Влияние перекисей
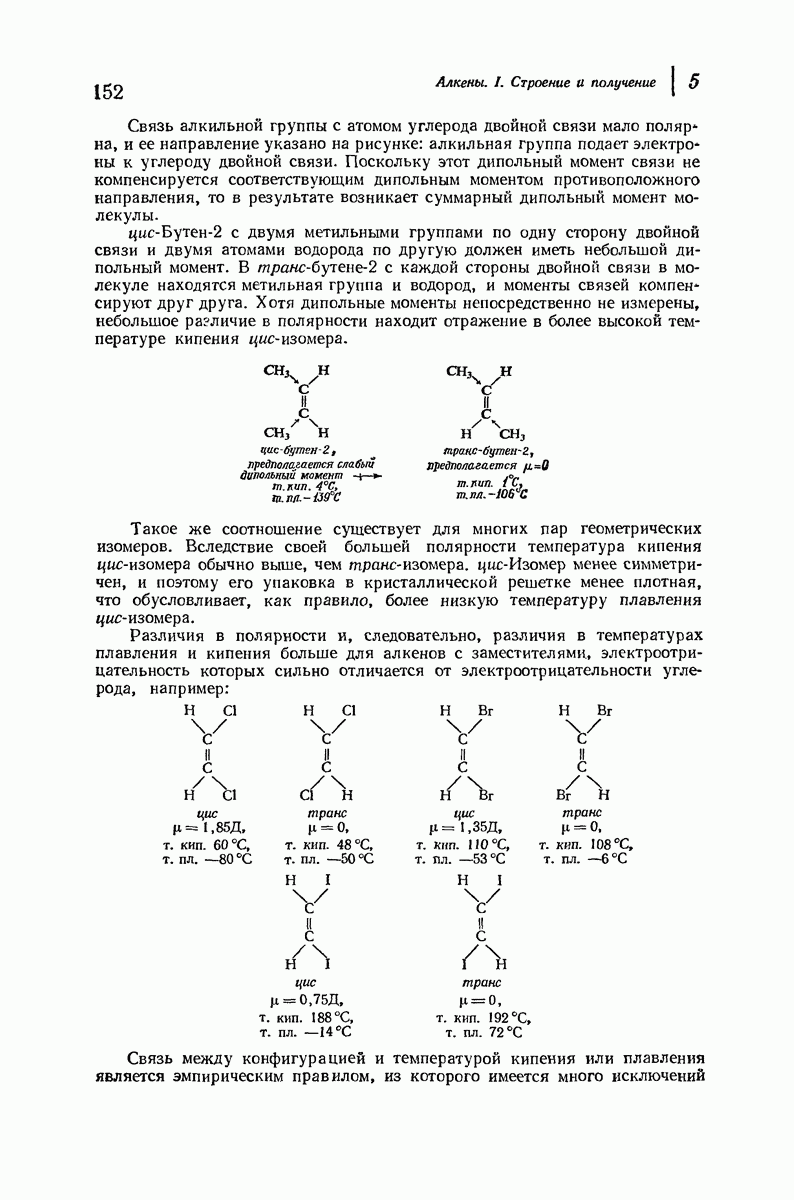
- 6.8. Присоединение серной кислоты
- 6.9. Присоединение воды. Гидратация
- 6.10. Электрофильное присоединение: механизм
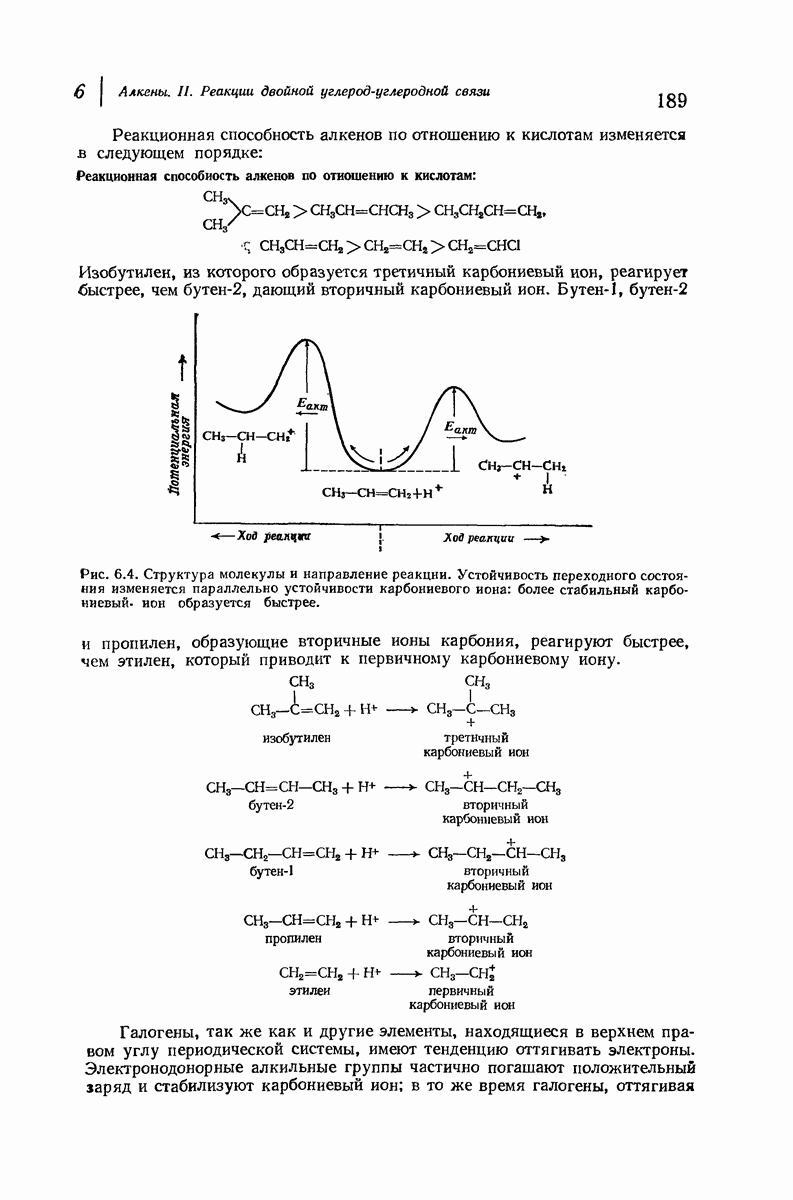
- 6.11. Электрофильное присоединение: направление присоединения и реакционная способность
- 6.12. Электрофильное присоединение: перегруппировки
- 6.13. Механизм присоединения галогенов
- 6.14. Образование галогенгидринов
- 6.15. Присоединение алкенов. Димеризация
- 6.16. Присоединение алканов. Алкилирование
- 6.17. Свободнорадикальное присоединение. Механизм присоединения бромистого водорода, инициируемый перекисями
- 6.18. Другие реакции свободнорадикального присоединения
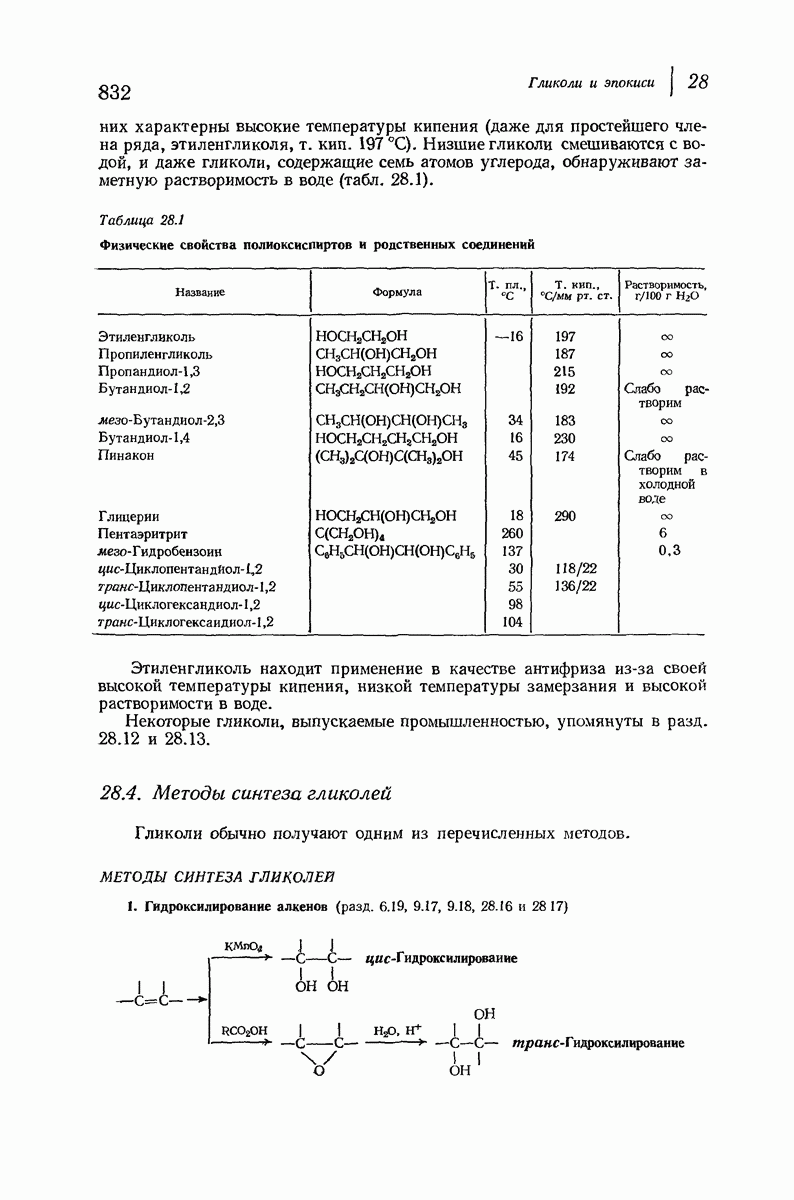
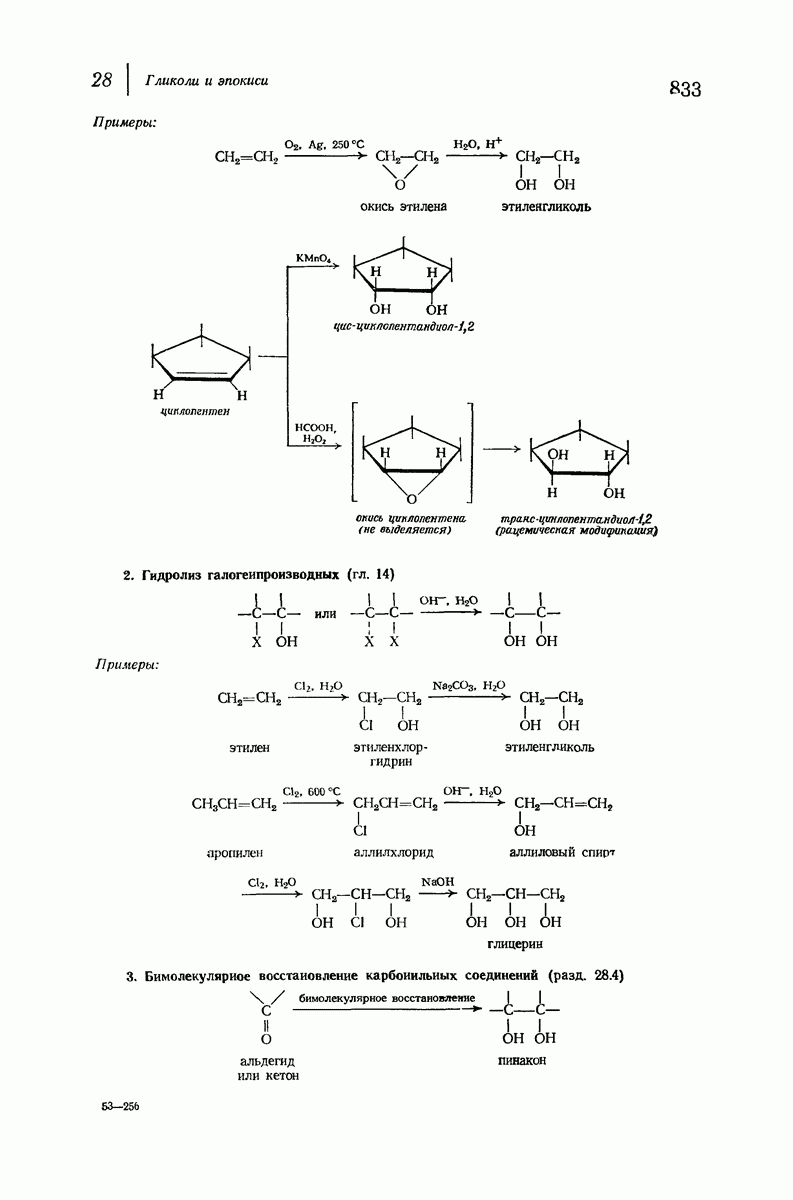
- 6.19. Гидроксилирование. Образование гликолей
- 6.20. Реакции замещения. Галогенирование. Аллильный водород
- 6.21. Ориентация и реакционная способность при замещении
- 6.22. Озонолиз. Определение структуры методом расщепления
- 6.23. Анализ алкенов
- 7. Стереохимия. II
- 7.1. Классификация стереоизомеров
- 7.2. Реакции стереоизомеров
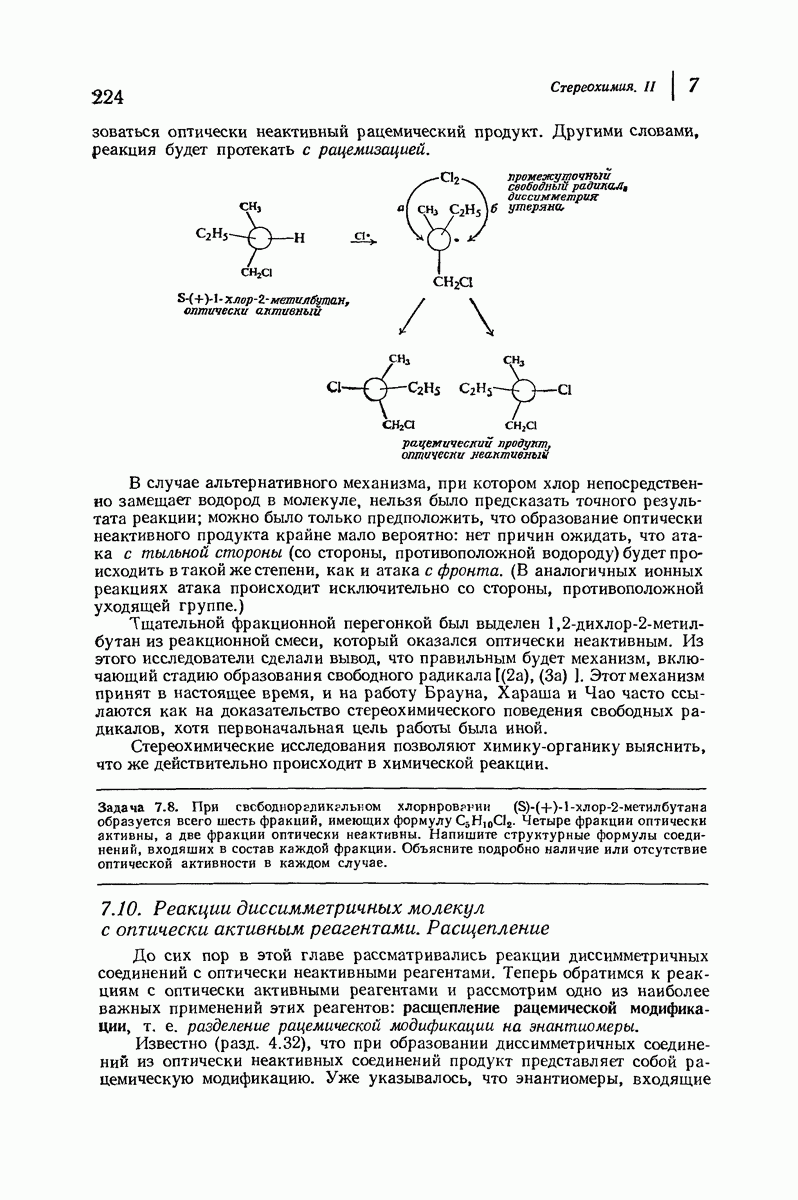
- 7.3. Реакции диссимметричных молекул. Разрыв связи
- 7.4. Реакции диссимметричных молекул. Относительные конфигурации
- 7.5. Оптическая чистота
- 7.6. Стереоизомеры: диастереомеры
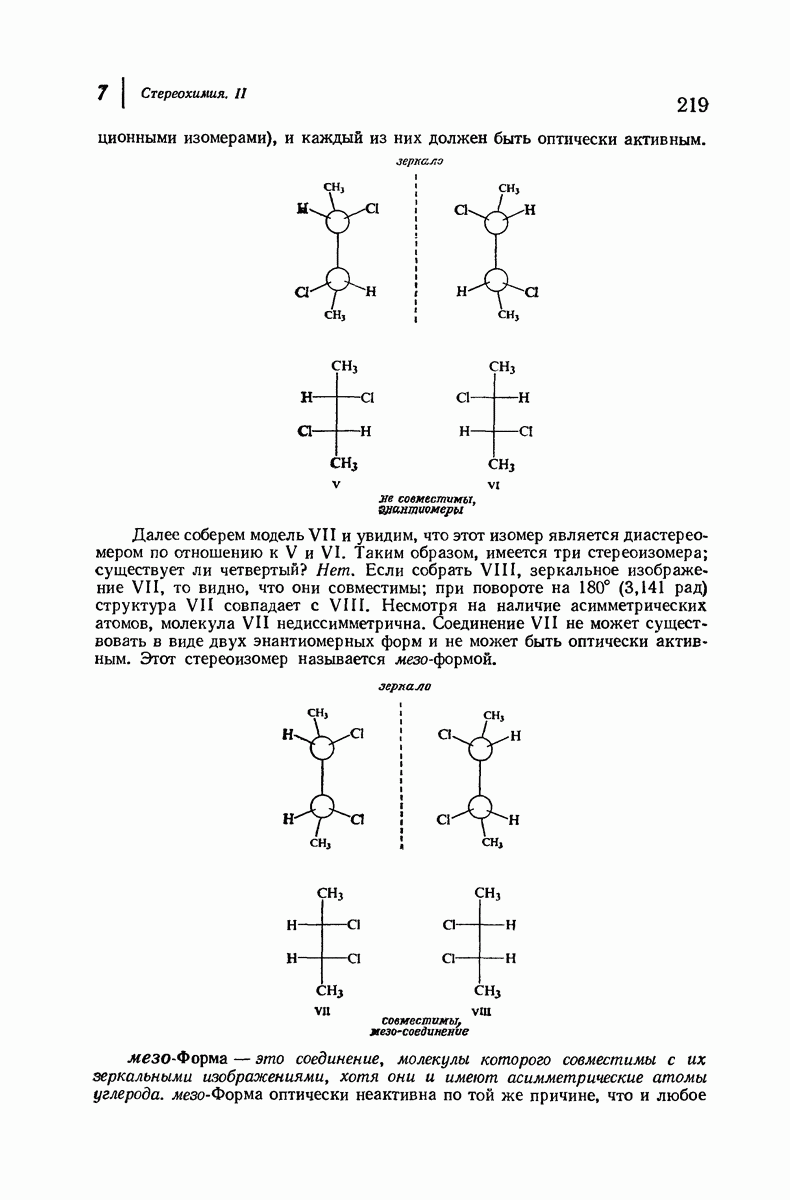
- 7.7. Стереоизомеры: мезо-формы
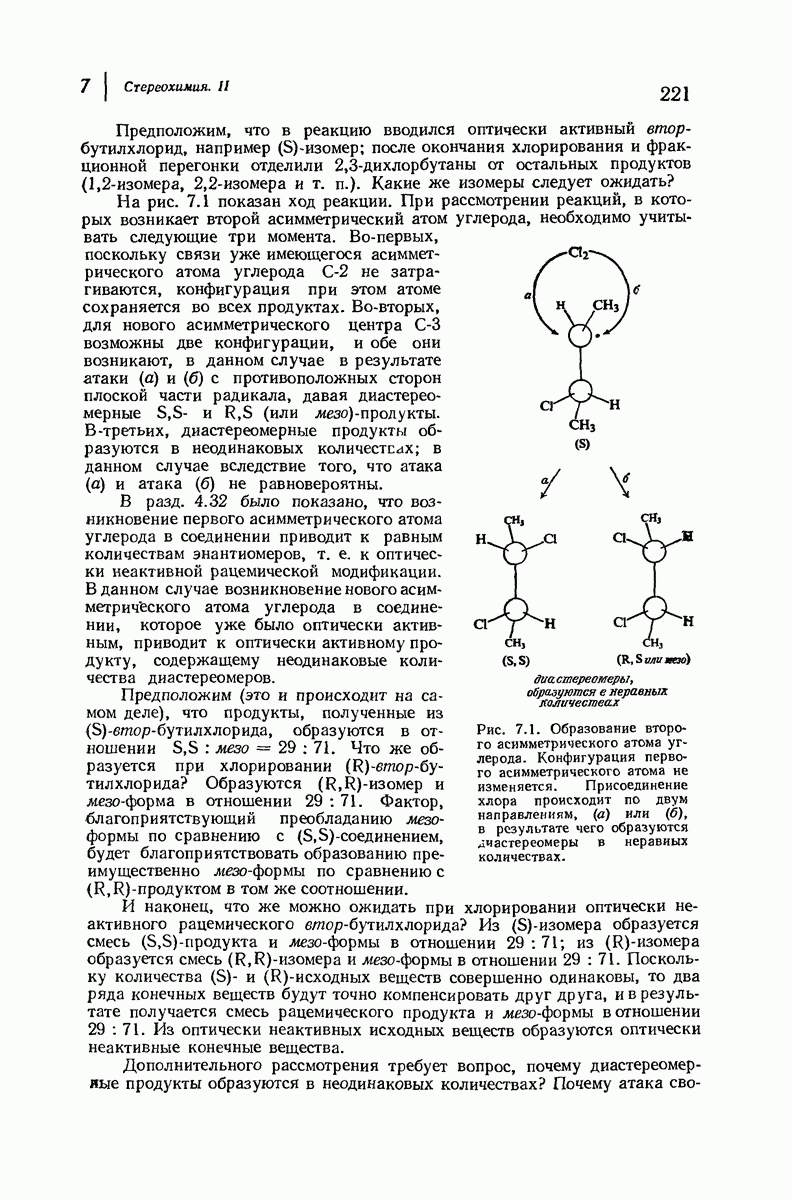
- 7.8. Реакции диссимметричных молекул. Образование второго асимметрического атома углерода
- 7.9. Реакции диссимметричных молекул. Механизм свободнорадикального хлорирования
- 7.10. Реакции диссимметричных молекул с оптически активным реагентами. Расщепление
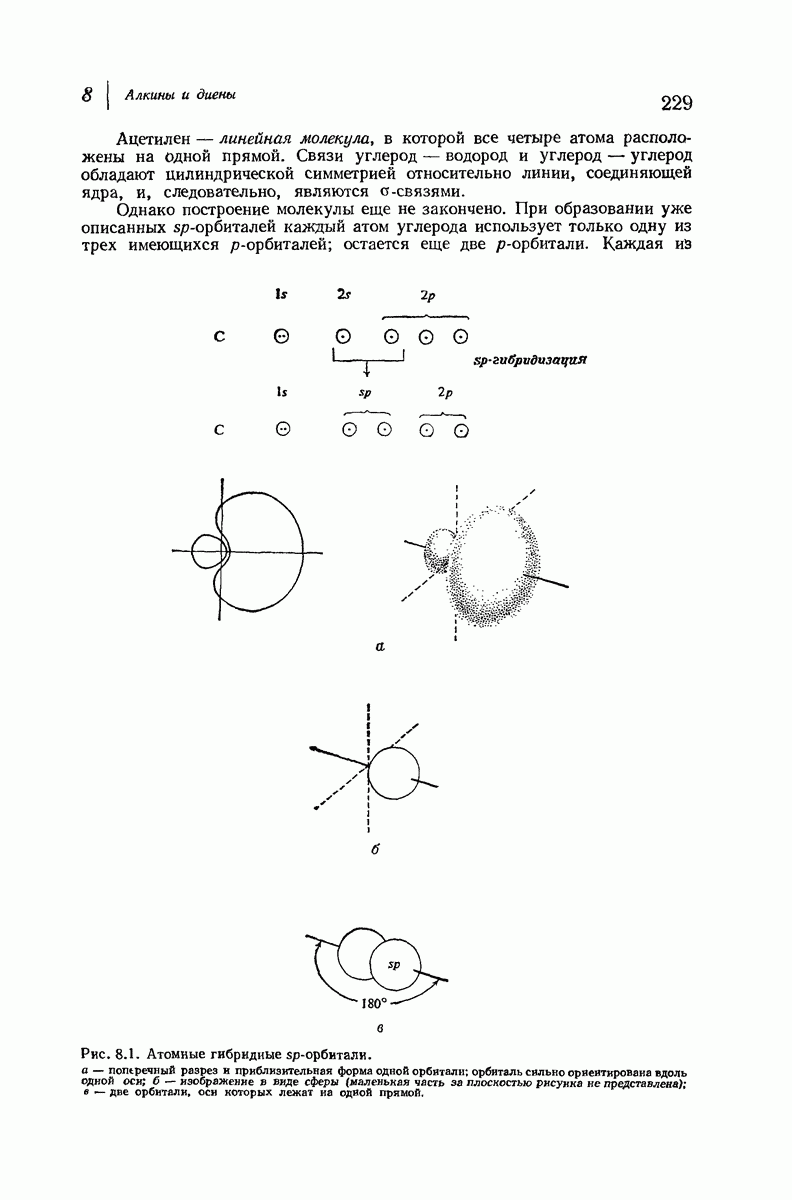
- 8. Алкины и диены
- 8.3. Высшие алкины. Номенклатура
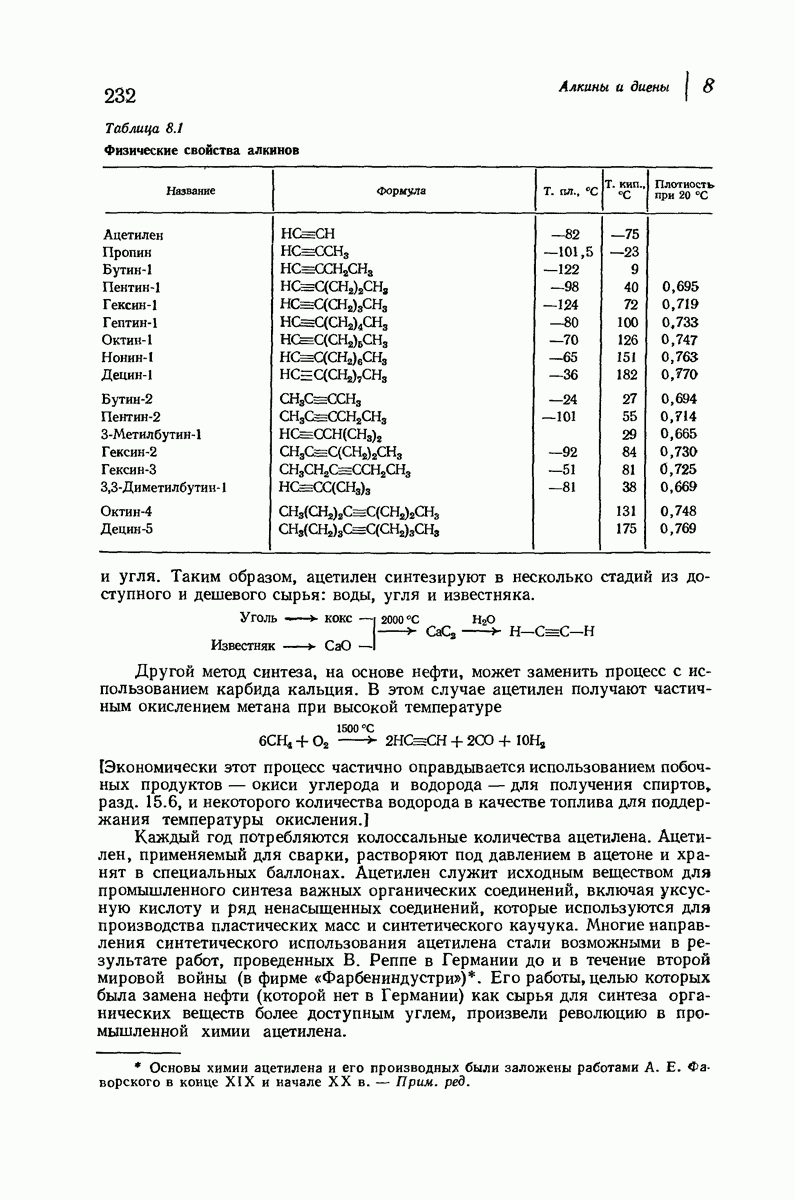
- 8.4. Физические свойства алкинов
- 8.5. Промышленный источник ацетилена
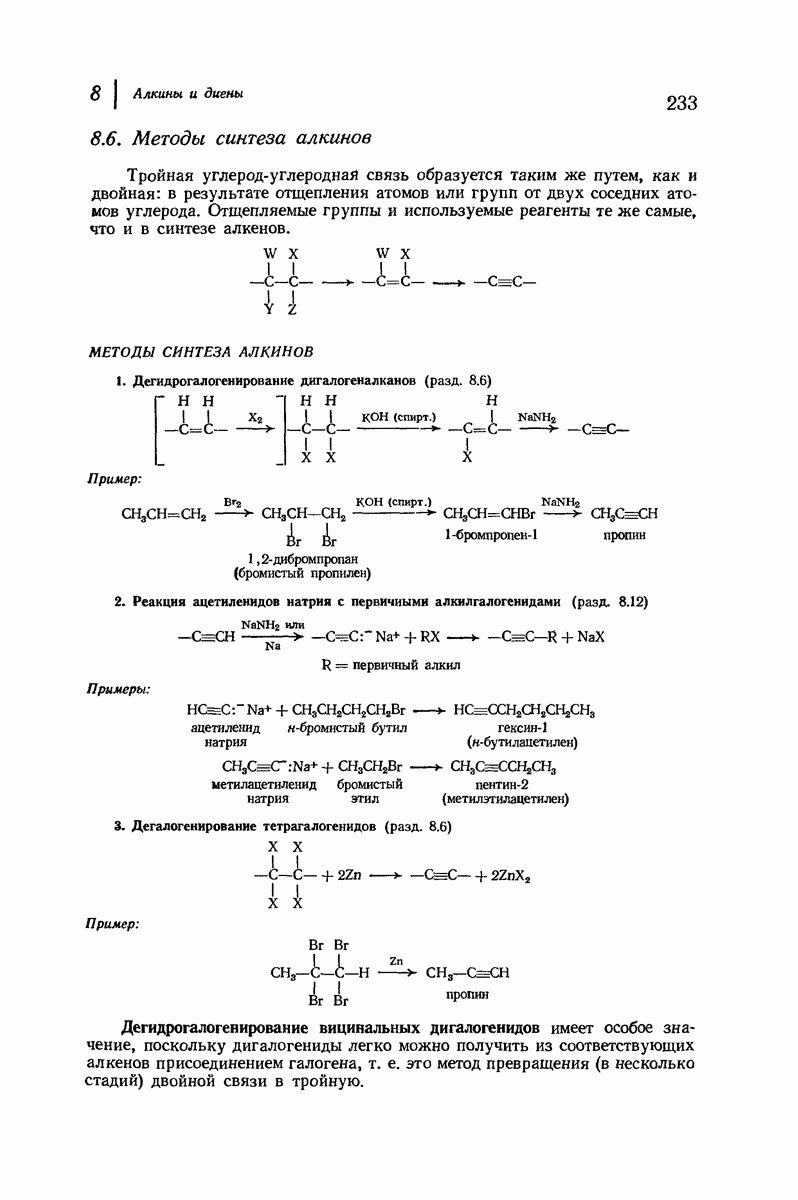
- 8.6. Методы синтеза алкинов
- 8.7. Реакции алкинов
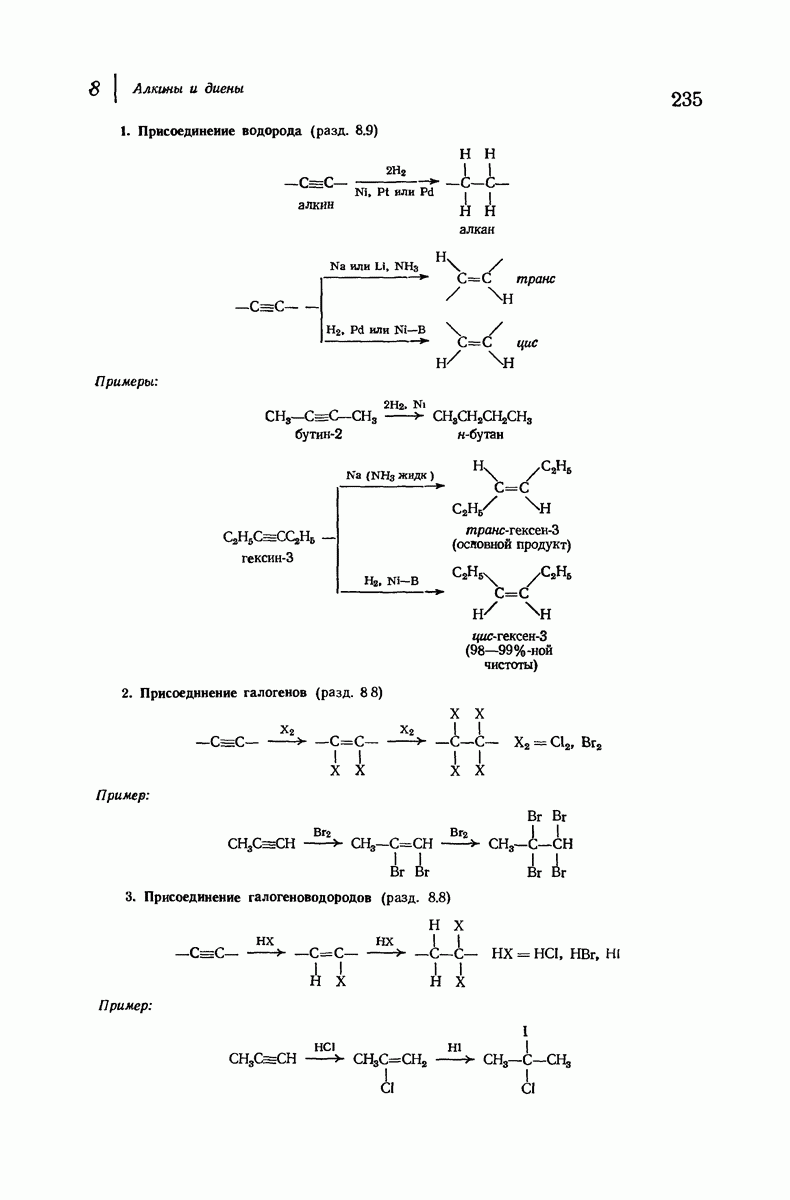
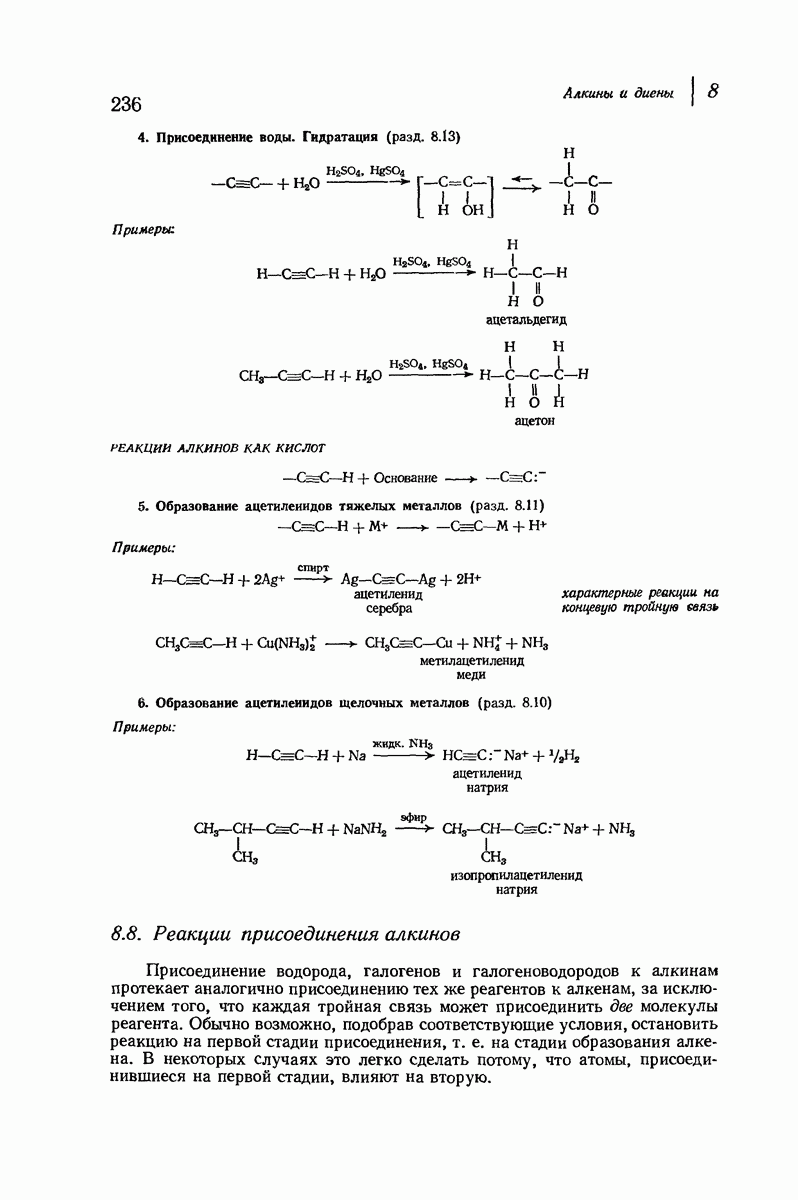
- 8.8. Реакции присоединения алкинов
- 8.9. Восстановление алкинов в алкены. Стереоселективные реакции
- 8.10. Кислотность алкинов. Очень слабые кислоты
- 8.11. Образование ацетиленидов тяжелых металлов
- 8.12. Реакция ацетиленидов натрия с алкилгалогенидами. Сравнение реакций замещения и элиминирования
- 8.13. Гидратация алкинов. Таутомерия
- 8.14. Строение и номенклатура диенов
- 8.15. Методы синтеза и свойства диенов
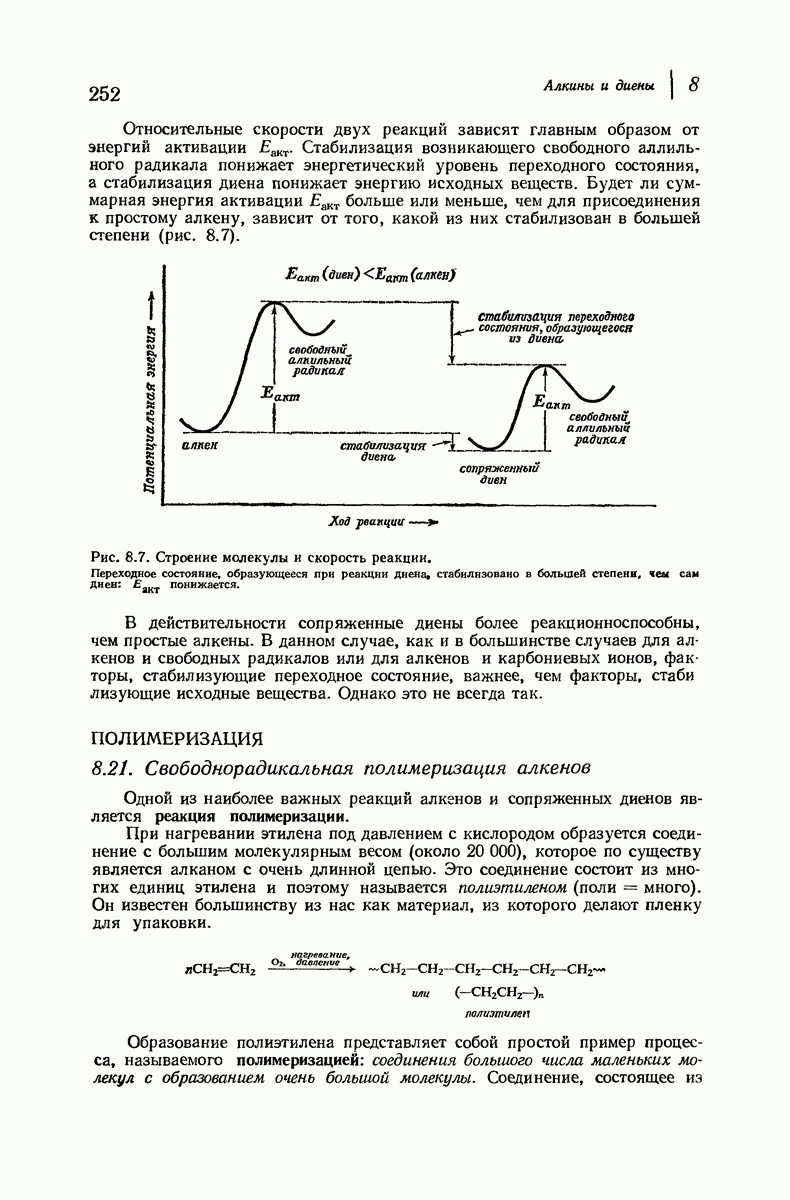
- 8.16. Устойчивость сопряженных диенов
- 8.17. Электрофильное присоединение к сопряженным диенам. 1,4-Присоединение
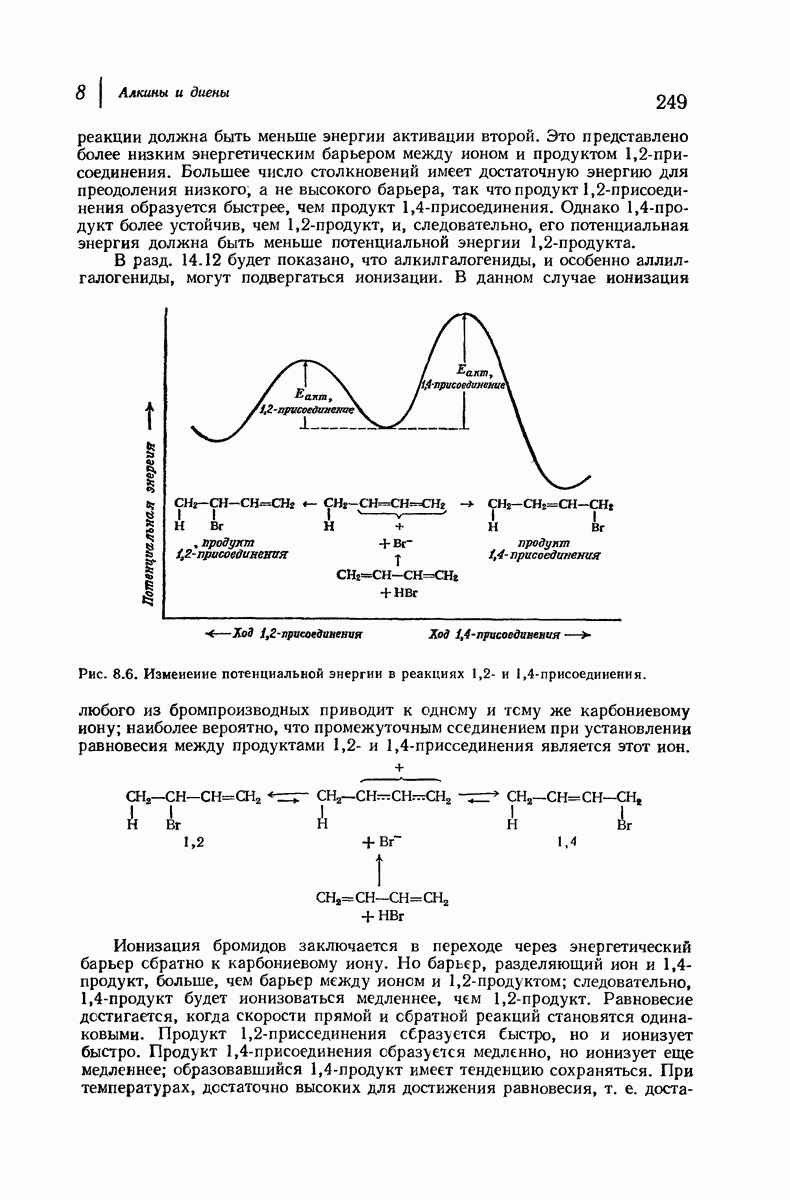
- 8.18. 1,2- и 1,4-Присоединение. Скорость и равновесие
- 8.19. Свободнорадикальное присоединение к сопряженным диенам: направление присоединения
- 8.20. Свободнорадикальное присоединение к сопряженным диеном: реакционная способность
- ПОЛИМЕРИЗАЦИЯ
- 8.21. Свободнорадикальная полимеризация алкенов
- 8.22. Свободнорадикальная полимеризация диенов. Натуральный каучук и его заменители
- 8.23. Сополимеризация
- 8.24. Ионная полимеризация
- 8.25. Изопрен и изопреновое правило
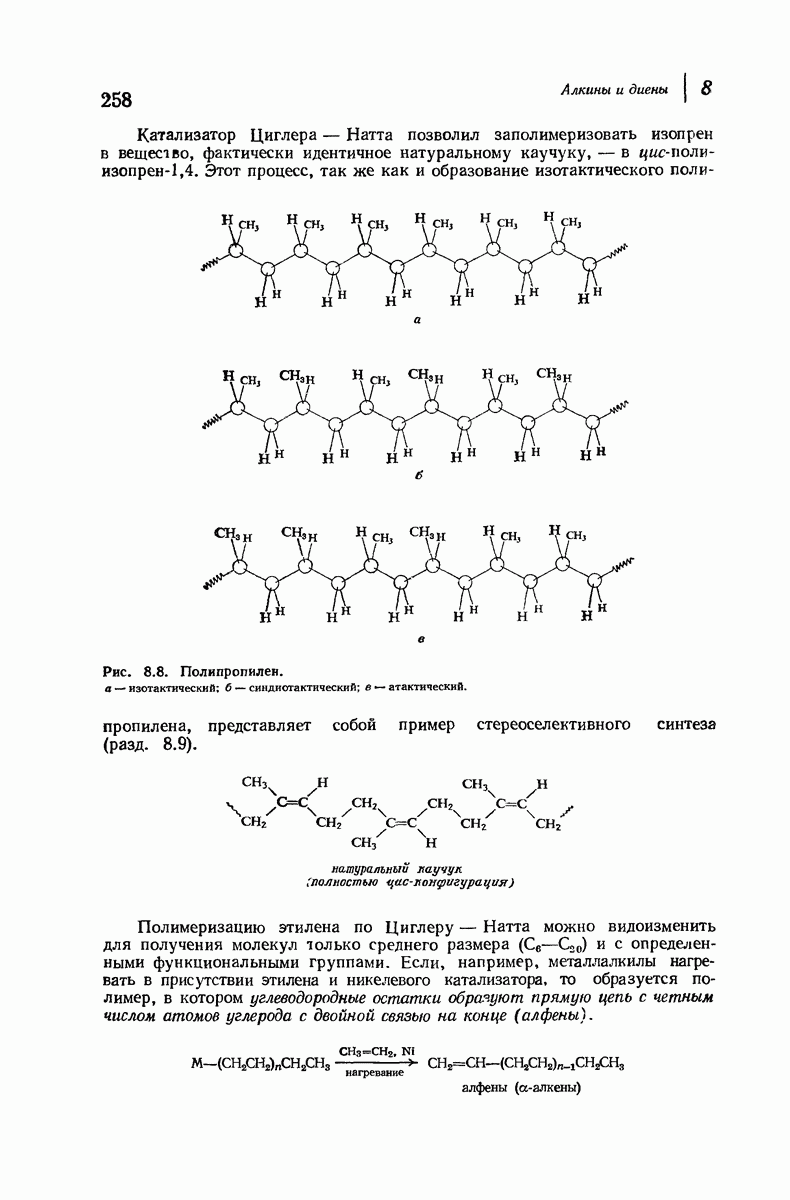
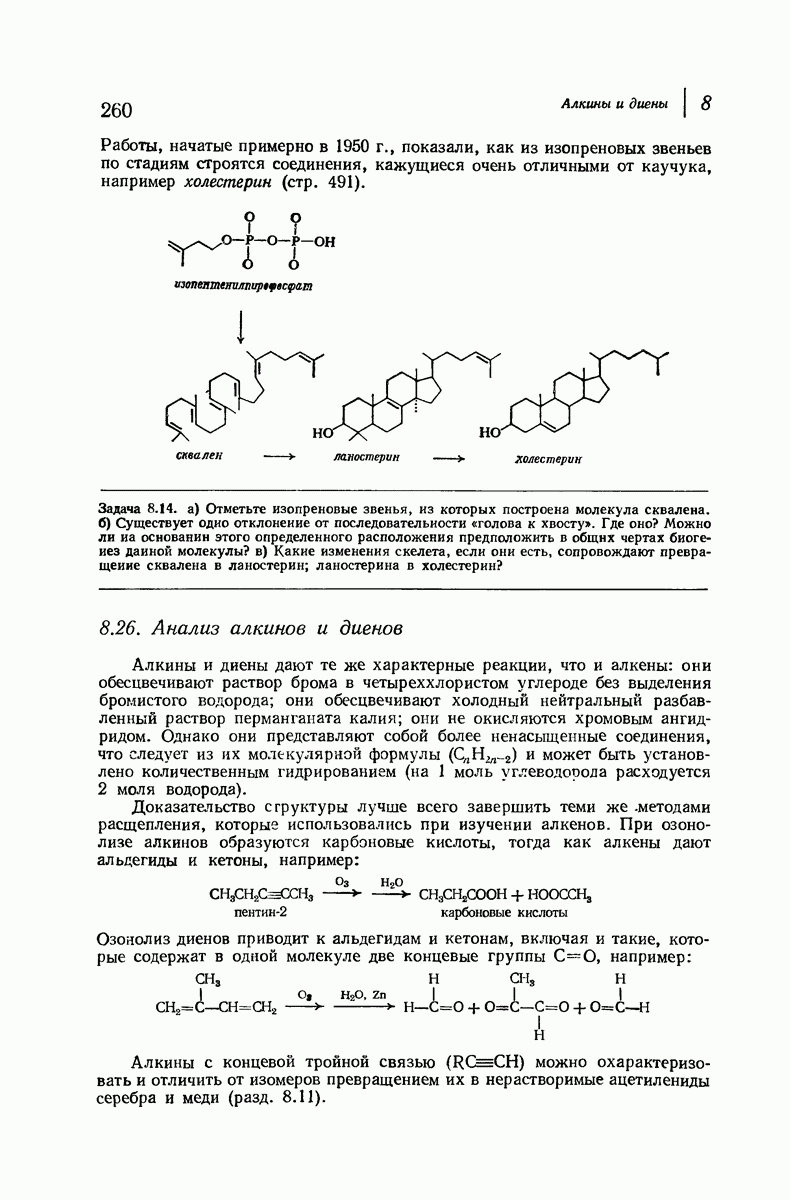
- 8.26. Анализ алкинов и диенов
- 9. Циклические алифатические углеводороды
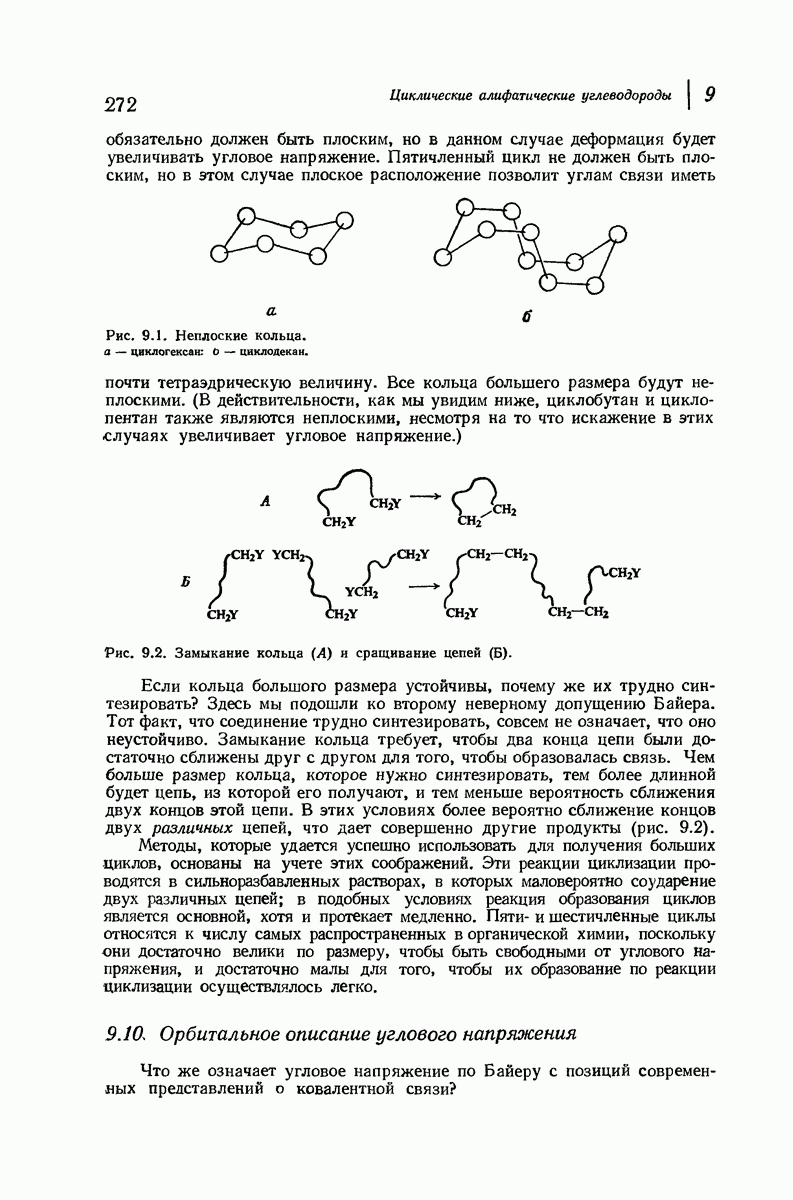
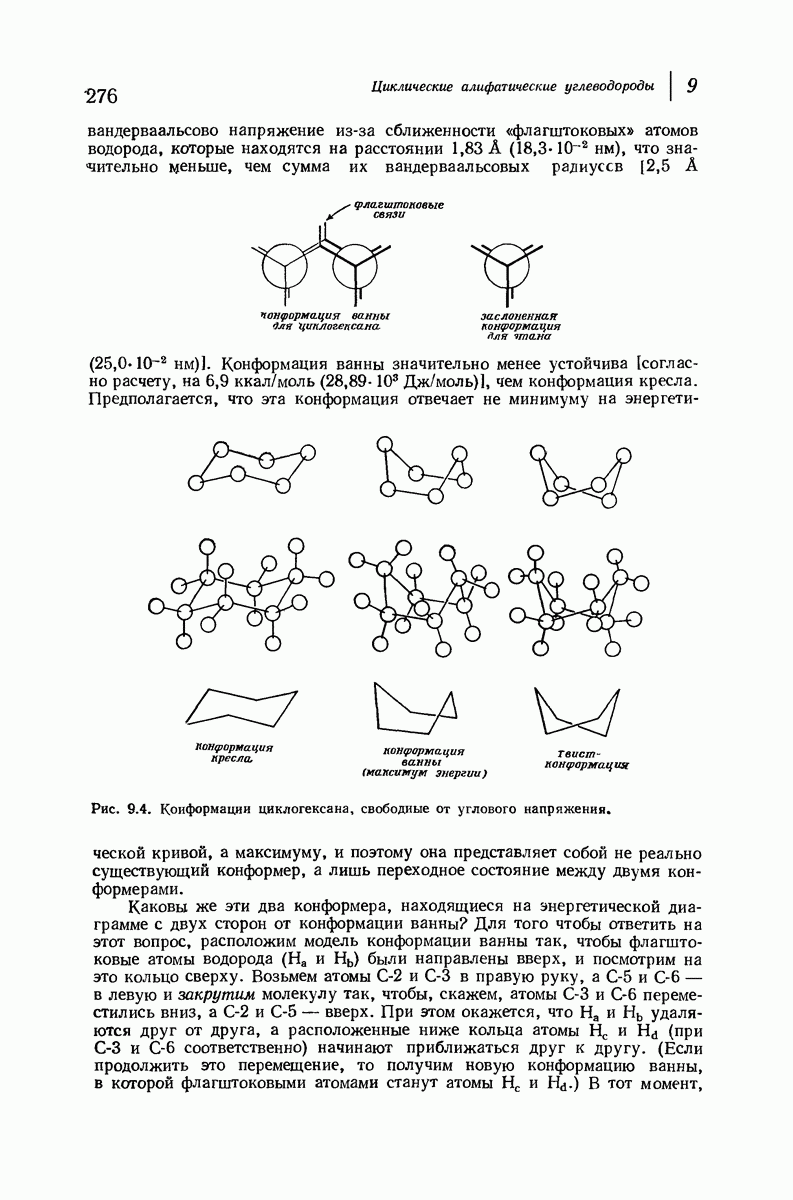
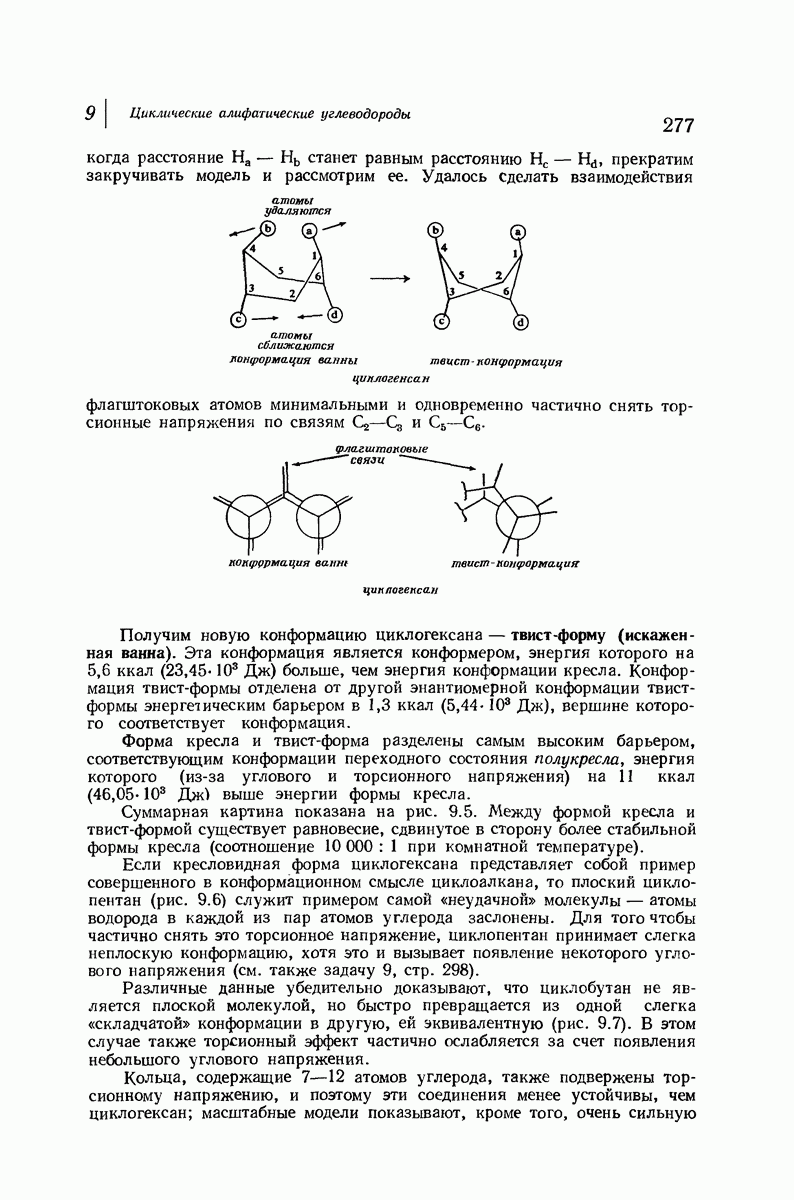
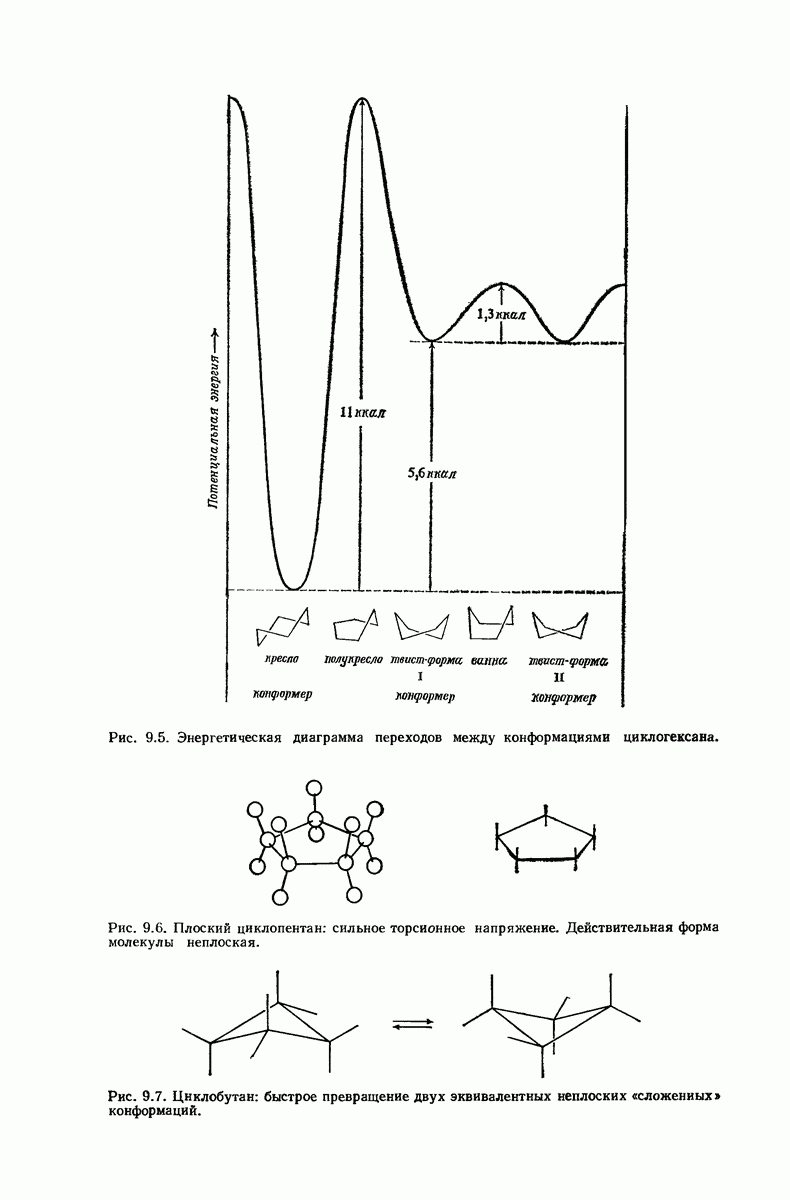
- 9.1. Ациклические и циклические соединения
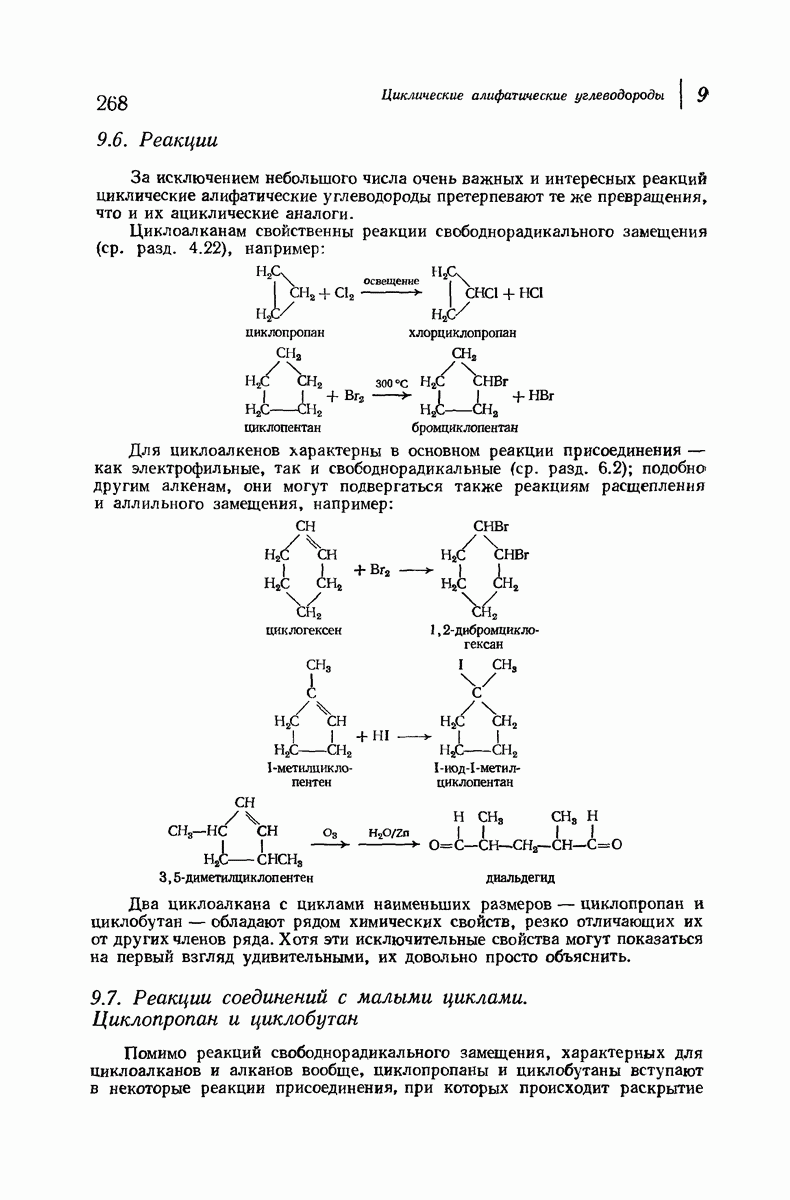
- 9.7. Реакции соединений с малыми циклами. Циклопропан и циклобутан
- 9.8. Теория напряжения Байера
- 9.9. Теплоты сгорания и относительная стабильность циклоалканов
- 9.10. Орбитальное описание углового напряжения
- 9.11. Факторы, влияющие на устойчивость конформаций
- 9.12. Конформация циклоалканов
- 9.14. Стереоизомерия циклических соединений. Диастереомерия: цис- и транс-изомеры
- 9.15. Стереоизомерия циклических соединений. Энантиомерия
- 9.16. Стереоизомерия циклических соединений. Конформационный анализ
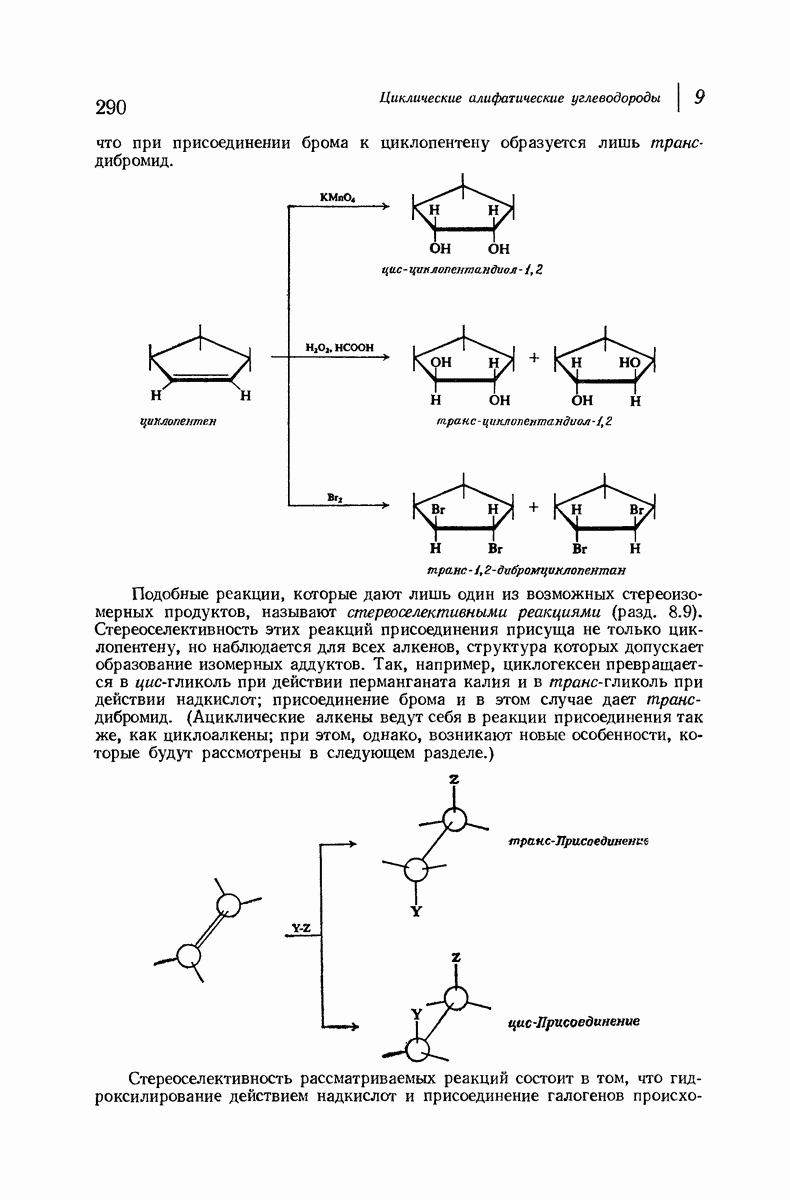
- 9.17. цис и транс-Присоединение к циклическим алкенам
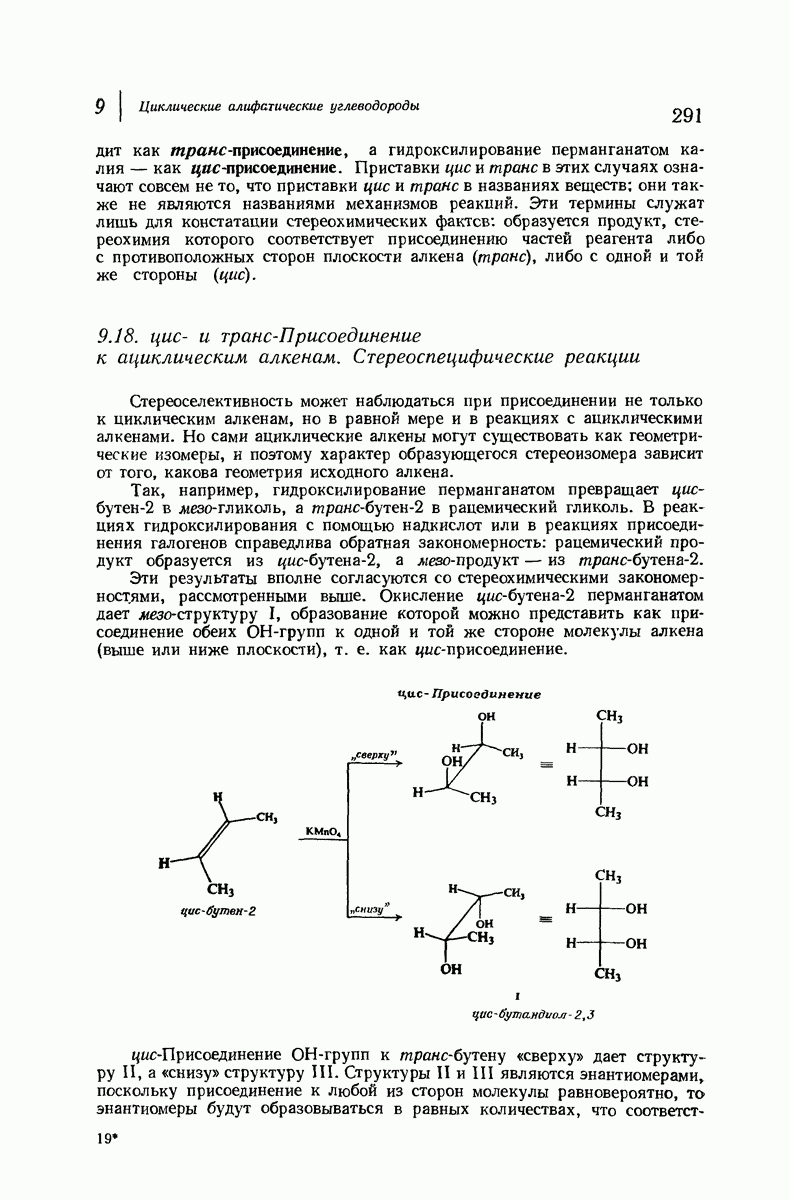
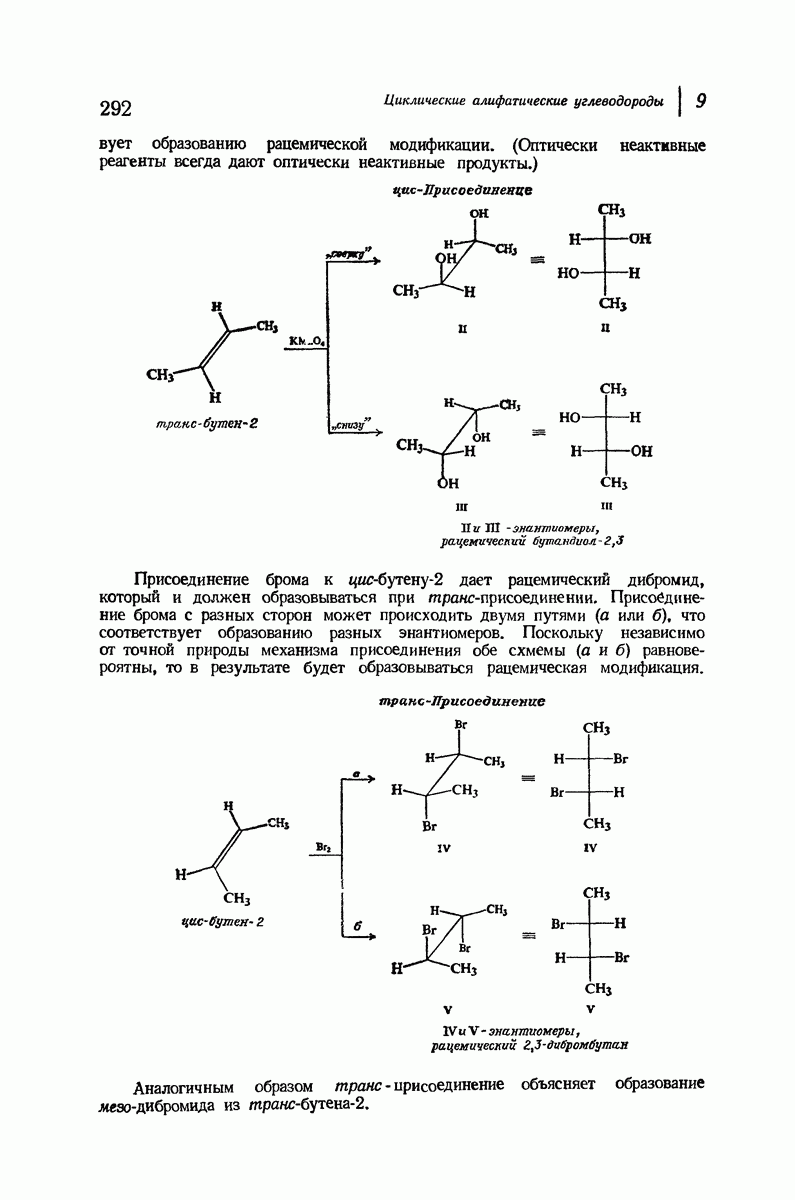
- 9.18. цис и транс-Присоединение к ациклическим алкенам. Стереоспецифические реакции
- 9.19. Присоединение метиленов
- 9.20. Замещенные метилены. а-Эламинирование
- 9.21. Анализ циклических алифатических углеводородов
- 10. Бензол. РЕЗОНАНС. АРОМАТИЧНОСТЬ
- 10.1. Алифатические и ароматические соединения
- 10.2. Структура бензола
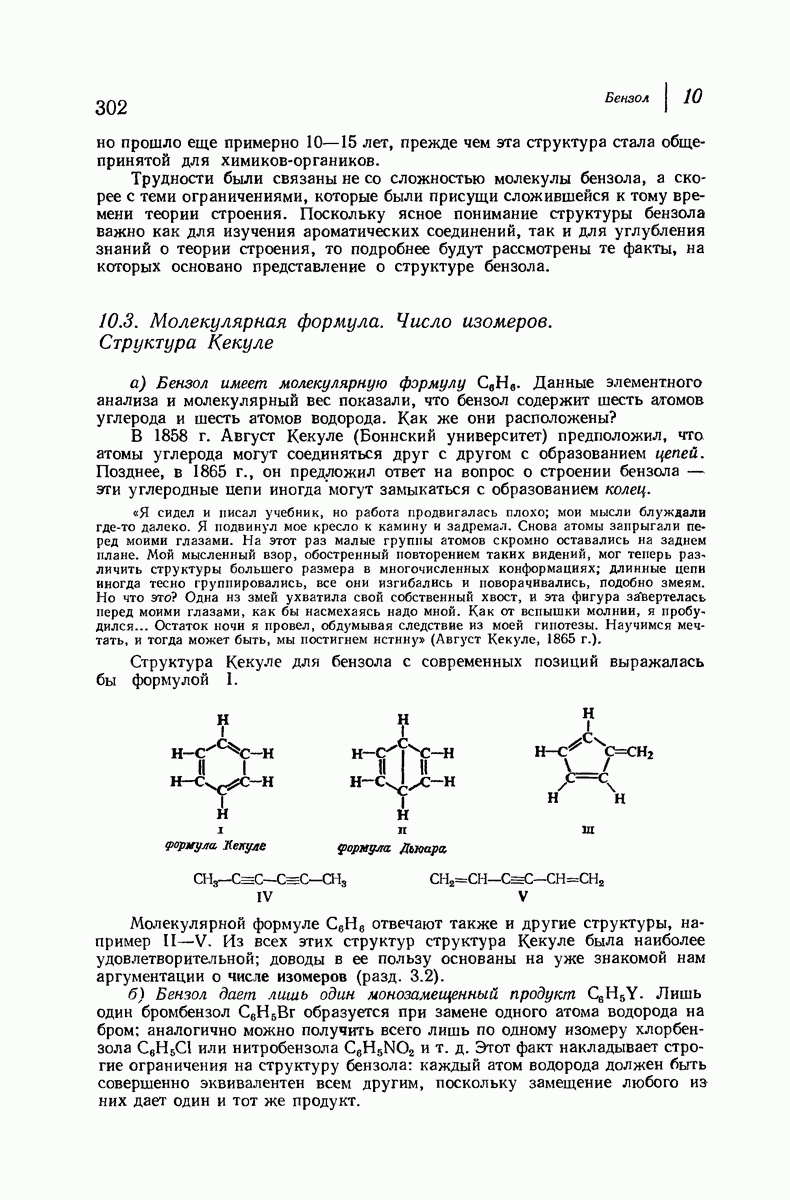
- 10.3. Молекулярная формула. Число изомеров. Структура Кекуле
- 10.4. Стабильность бензольного кольца. Реакции бензола
- 10.5. Устойчивость бензольного кольца. Теплоты гидрирования и сгорания
- 10.6. Длины углерод-углеродных связей в бензоле
- 10.7. Теория резонанса
- 10.8. Резонансная структура бензола
- 10.9. Длины связей в бензоле
- 10.10. Число изомеров
- 10.11. Стабильность бензола
- 10.12. Орбитальное представление структуры бензола
- 10.13. Изображение бензольного кольца
- 10.14. Ароматические свойства. (4n+2)-Правило Хюккеля
- 10.15. Применение теории резонанса
- 10.16. Резонанс в сопряженных диенах
- 10.13. Изображение бензольного кольца
- 10.18. Стабильность диенов и алкенов: альтернативная интерпретация
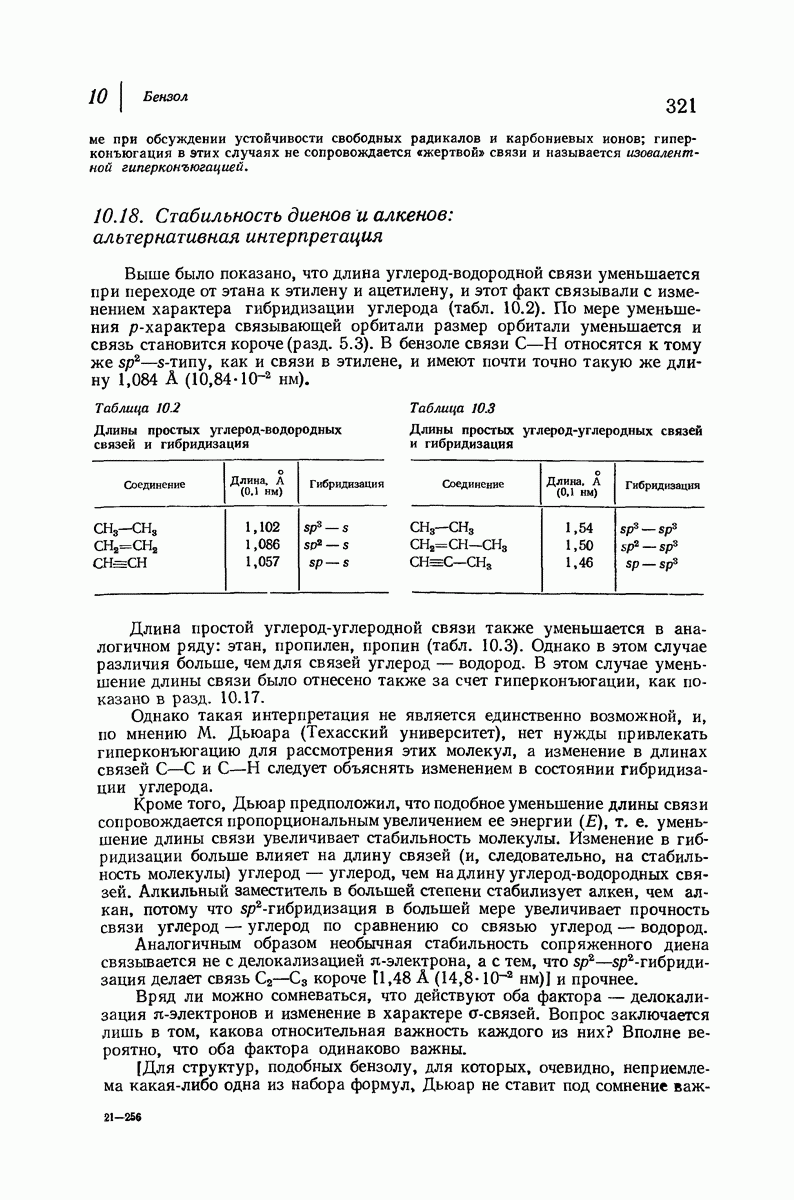
- 10.19. Номенклатура производных бензола
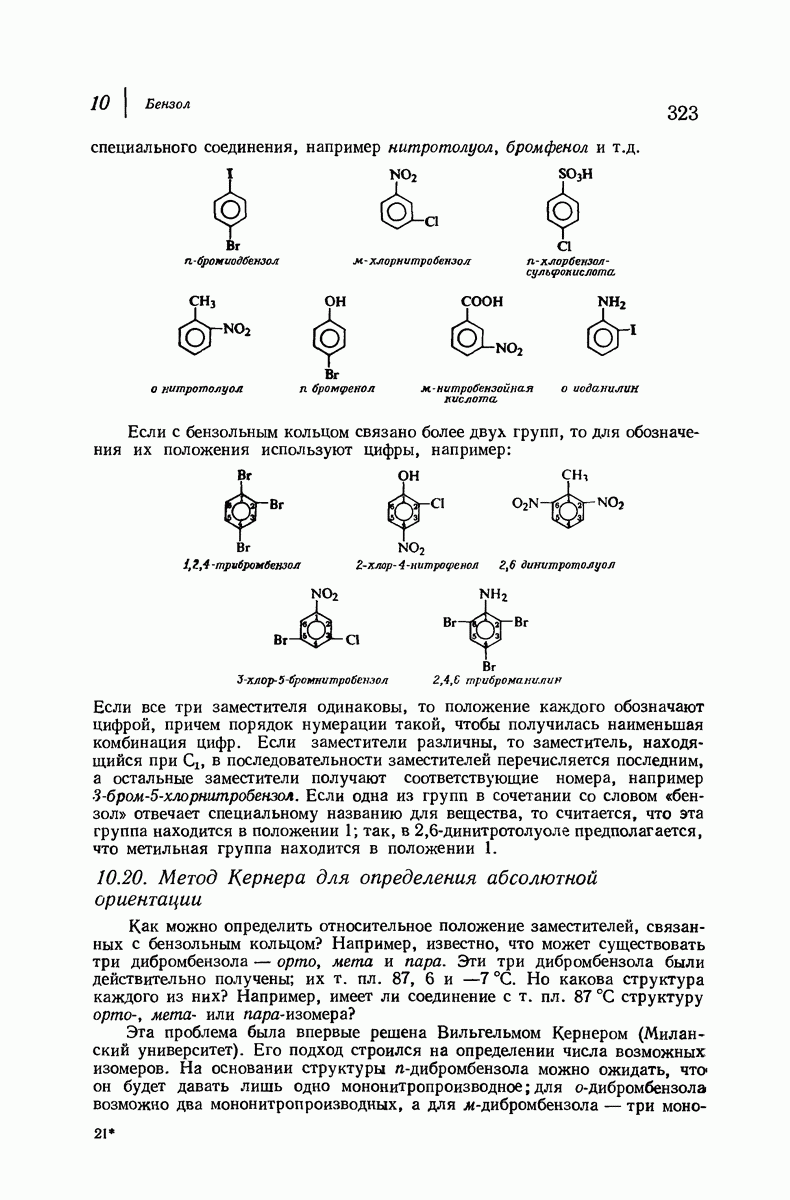
- 10.20. Метод Кернера для определения абсолютной ориентации
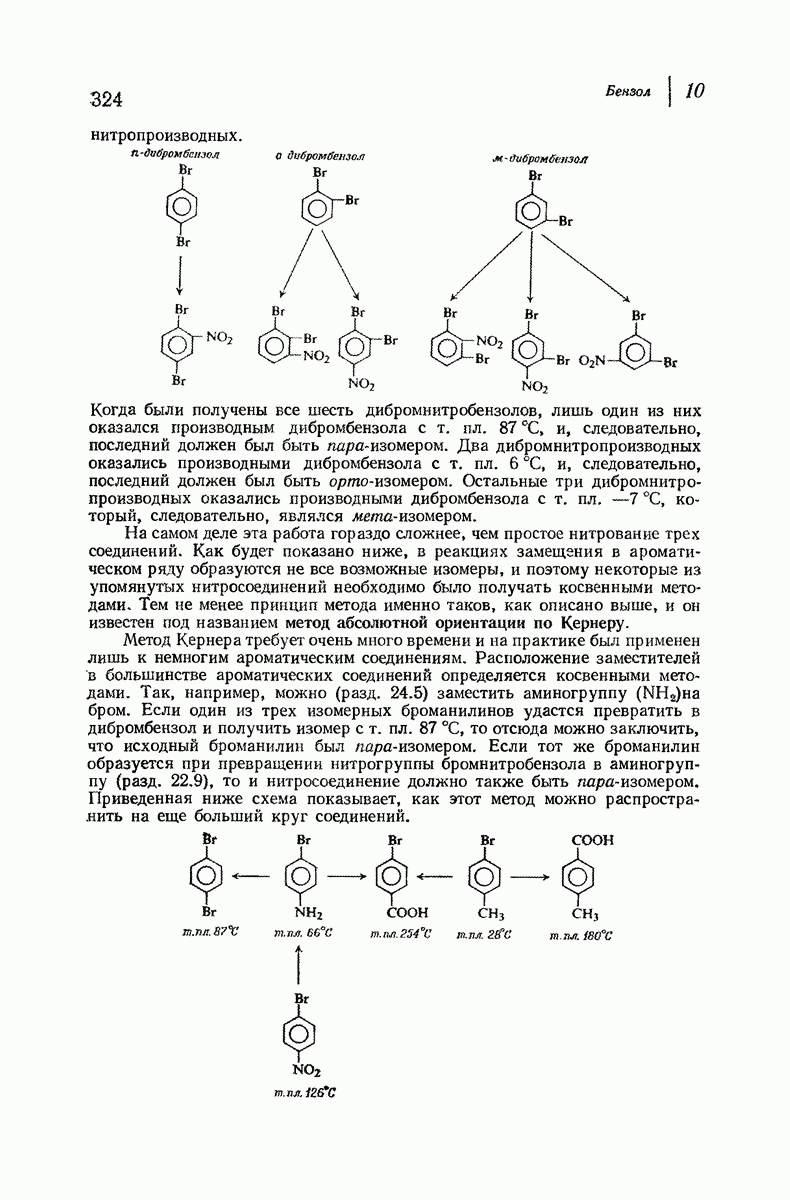
- 10.21. Качественный элементный анализ: азот и сера
- 10.22. Количественный элементный анализ: азот и сера
- 10.23. Определение молекулярного веса: понижение температуры замерзания. Метод Раста
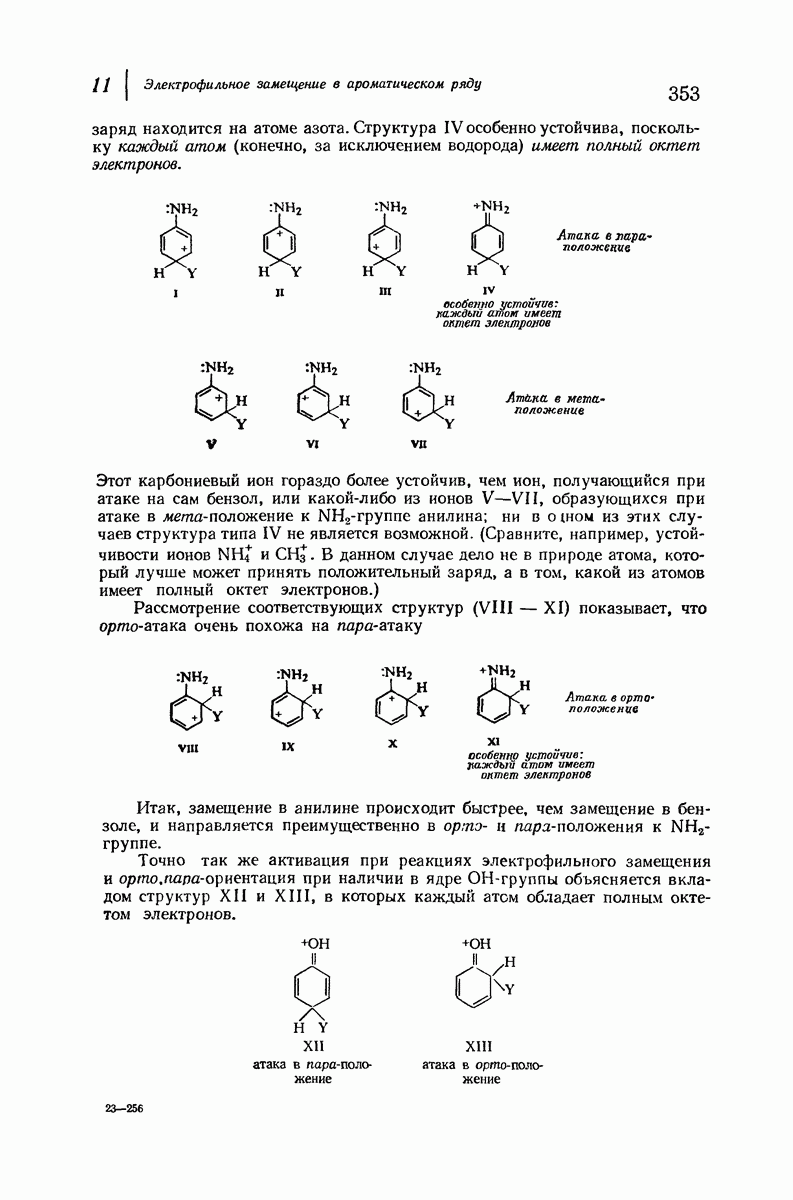
- 11. Электрофильное замещение в ароматическом ряду
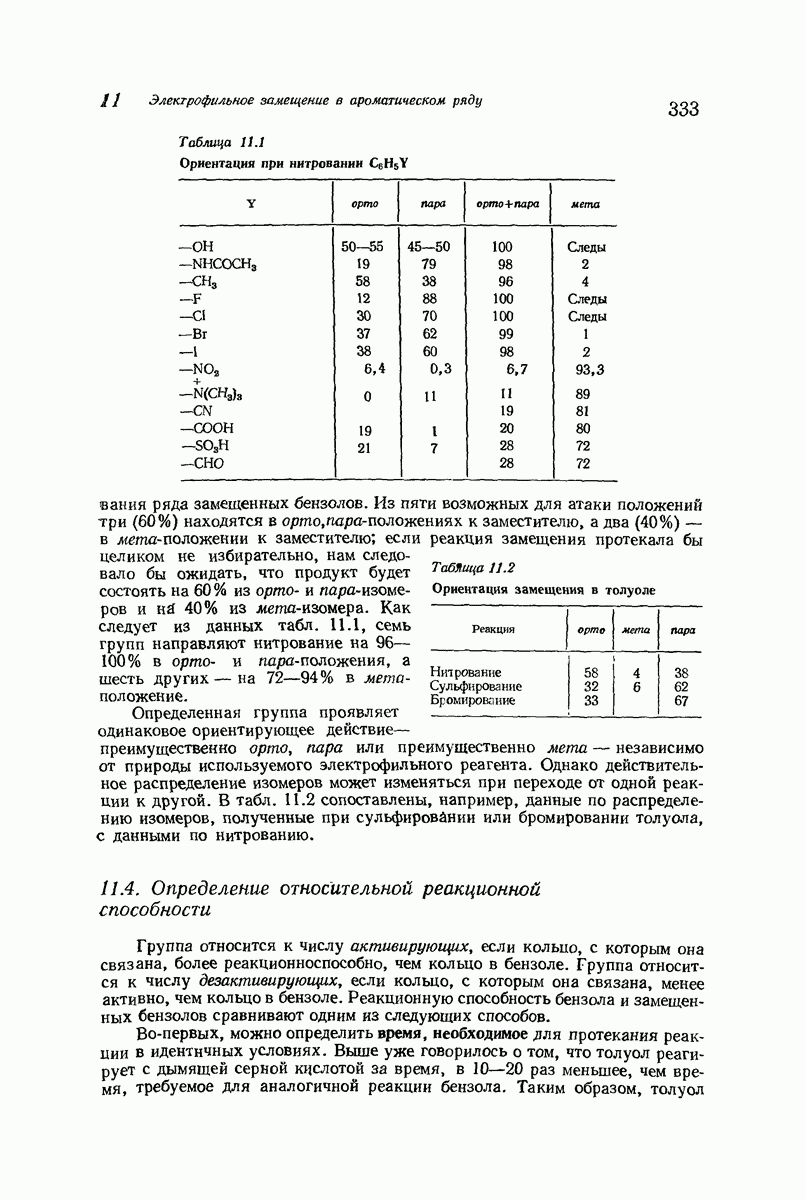
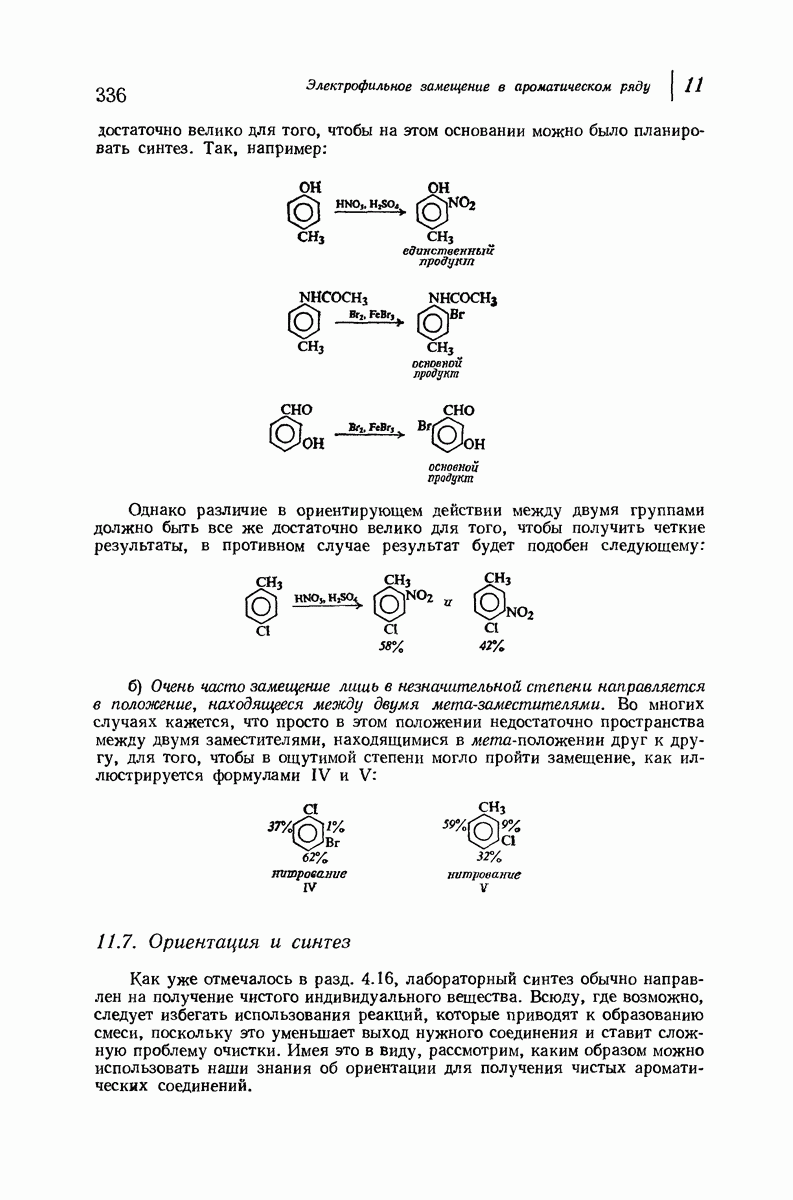
- 11.6. Ориентация в дизамещенных бензолах
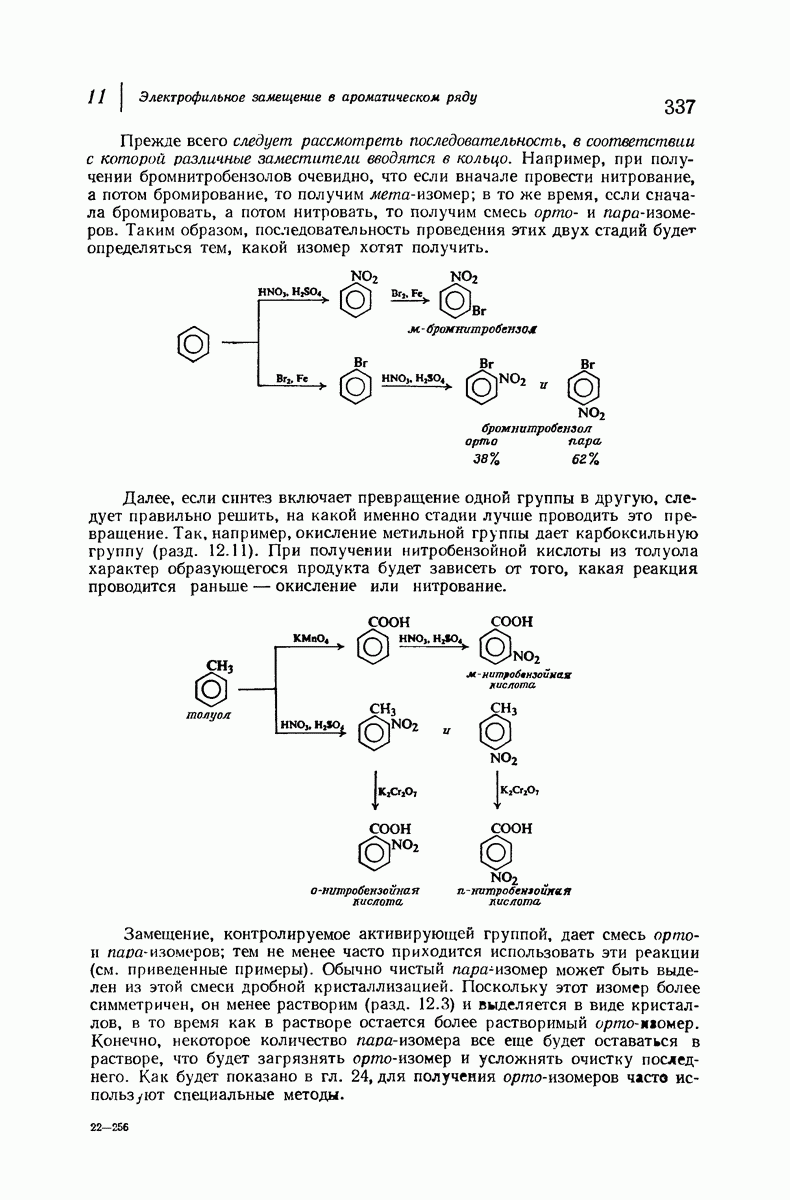
- 11.7. Ориентация и синтез
- 11.8. Механизм нитрования
- 11.9. Механизм сульфирования
- 11.10. Механизм галогенирования
- 11.11. Механизм алкилирования по Фриделю-Крафтсу
- 11.12. Механизм электрофильного замещения в ароматическом ряду: общие положения
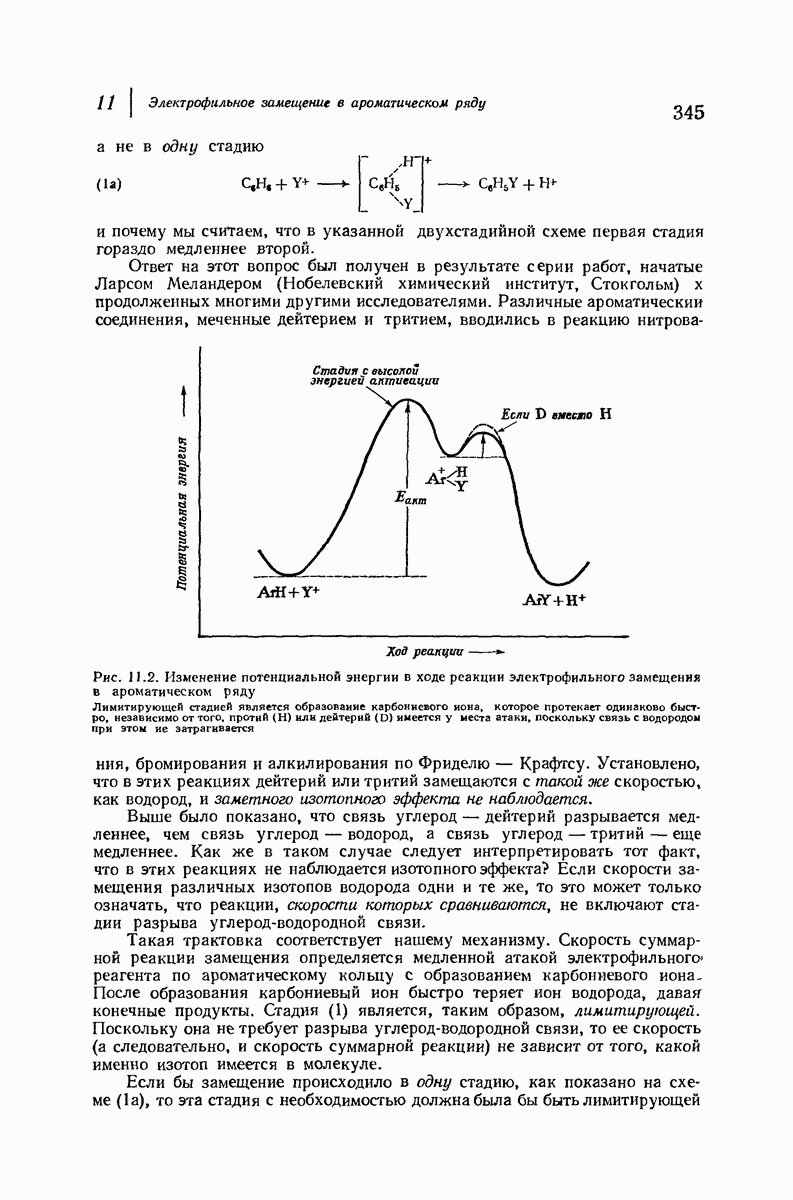
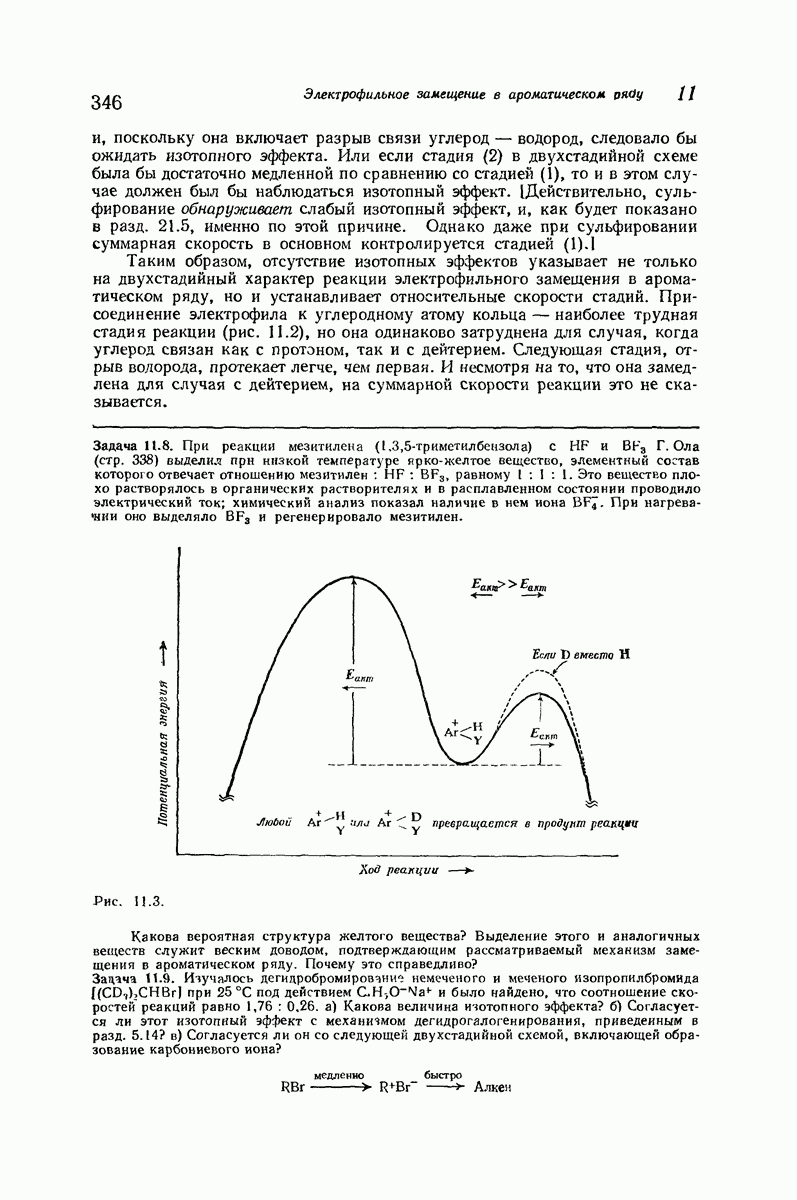
- 11.13. Изотопный эффект
- 11.14. Механизм электрофильного замещения в ароматическом ряду: две стадии
- 11.15. Реакционная способность и ориентация
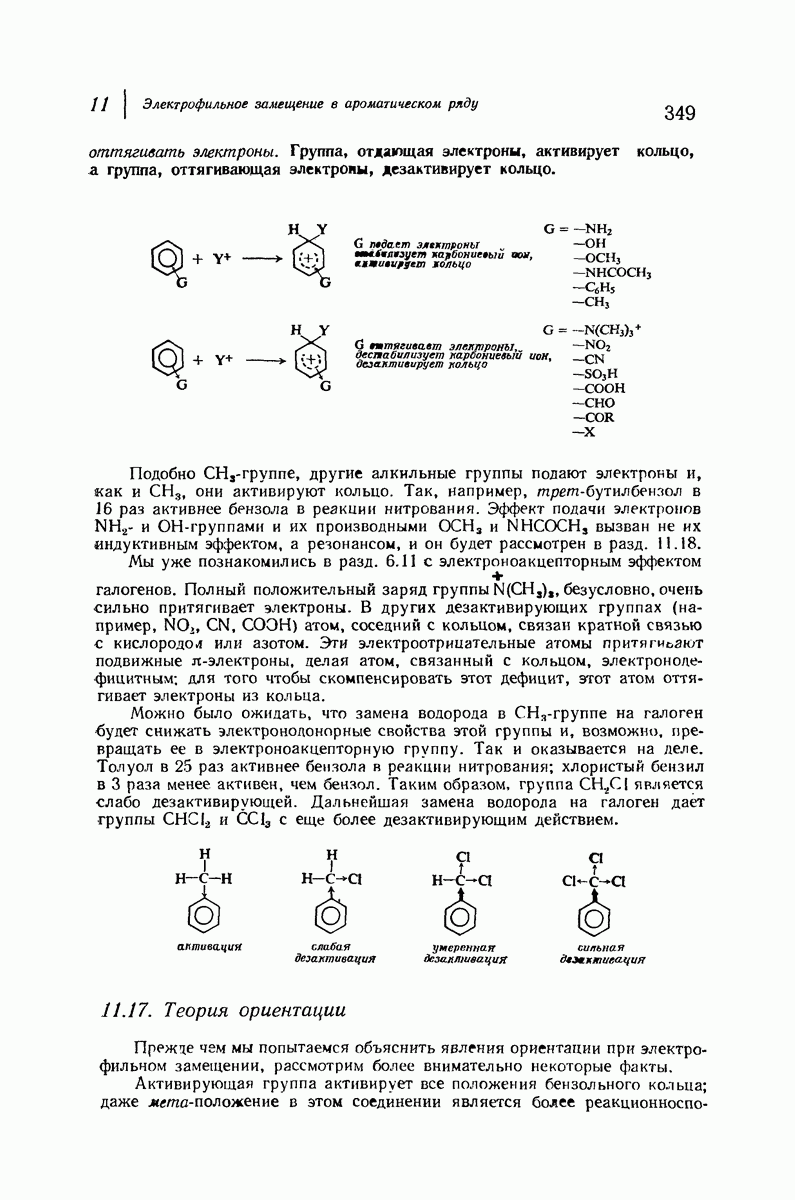
- 11.16. Теория реакционной способности
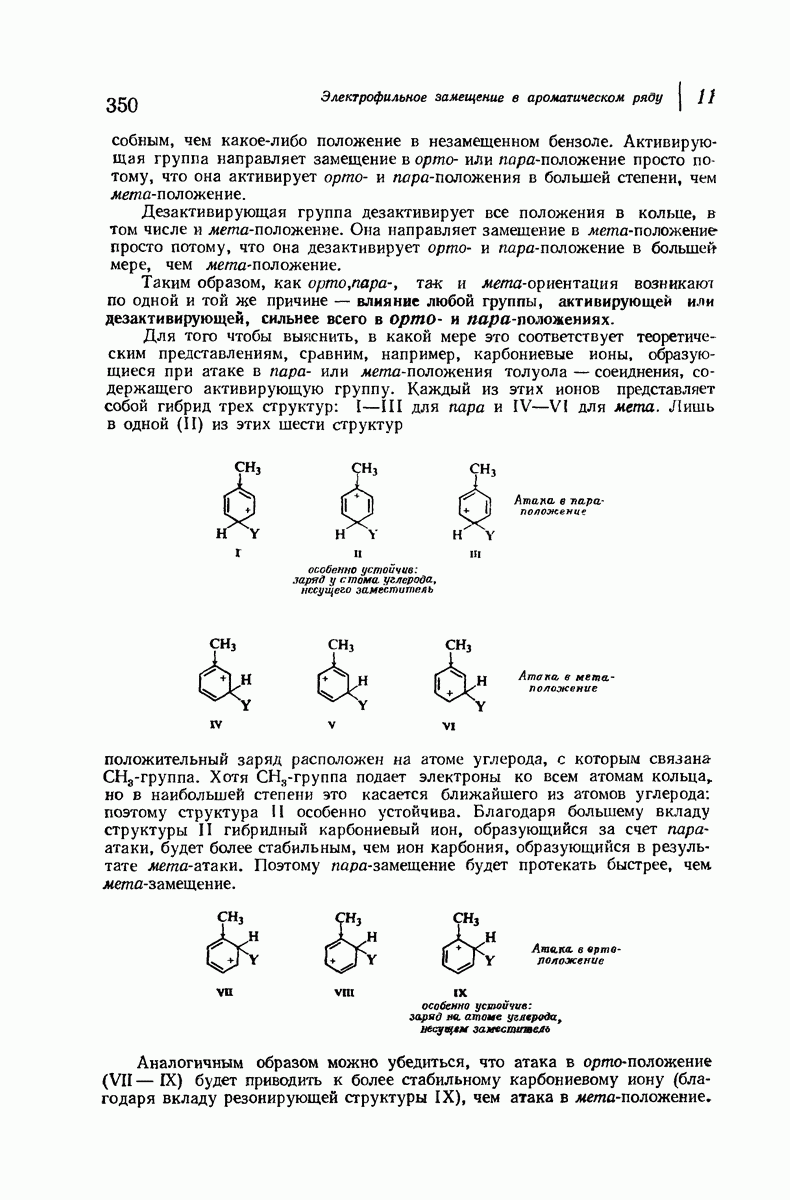
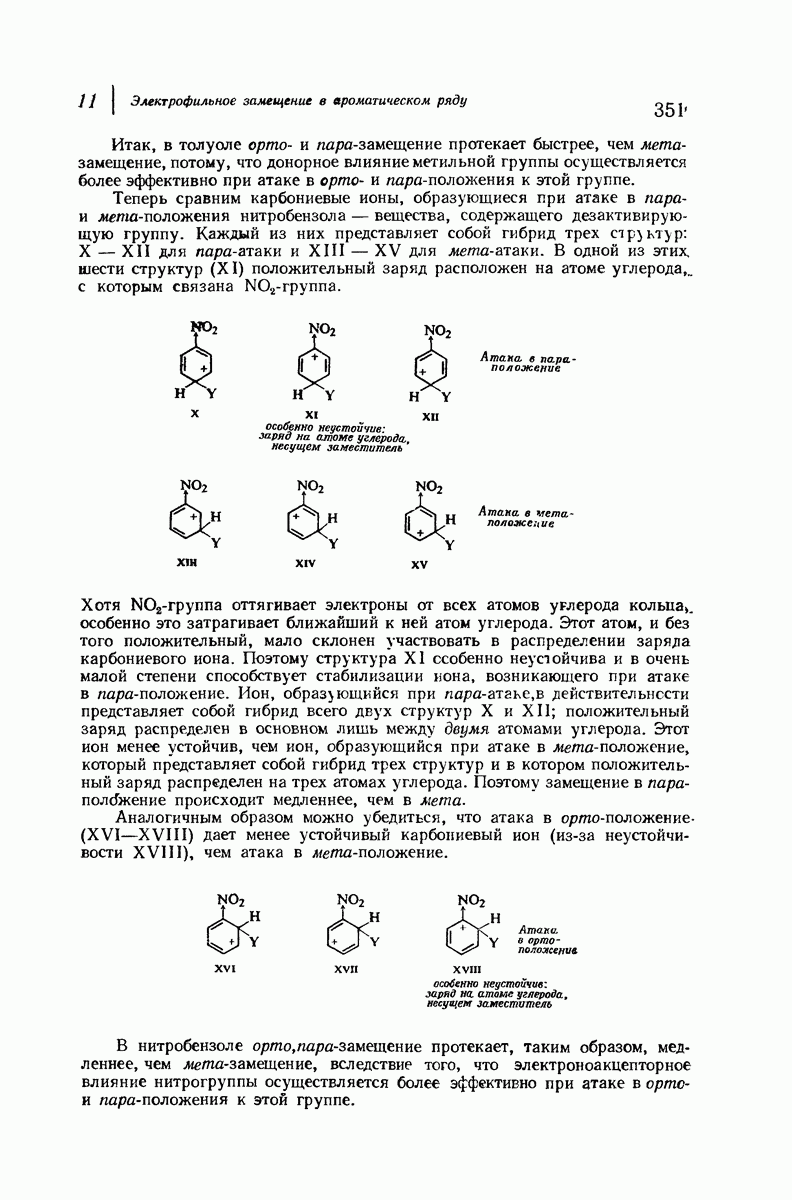
- 11.17. Теория ориентации
- 11.18. Подача электронов за счет эффекта резонанса
- 11.19. Связь с другими реакциями карбониевых ионов
- 12. Арены
- 12.1. Жирноароматические углеводороды
- 12.4. Промышленные источники алкилбензолов
- 12.5. Методы синтеза алкилбензолов
- 12.6. Алкилирование по Фриделю-Крафтсу
- 12.7. Механизм алкилирования по Фриделю-Крафтсу
- 12.8. Ограничения для реакции алкилирования по Фриделю-Крафтсу
- 12.9. Реакции алкилбензолов
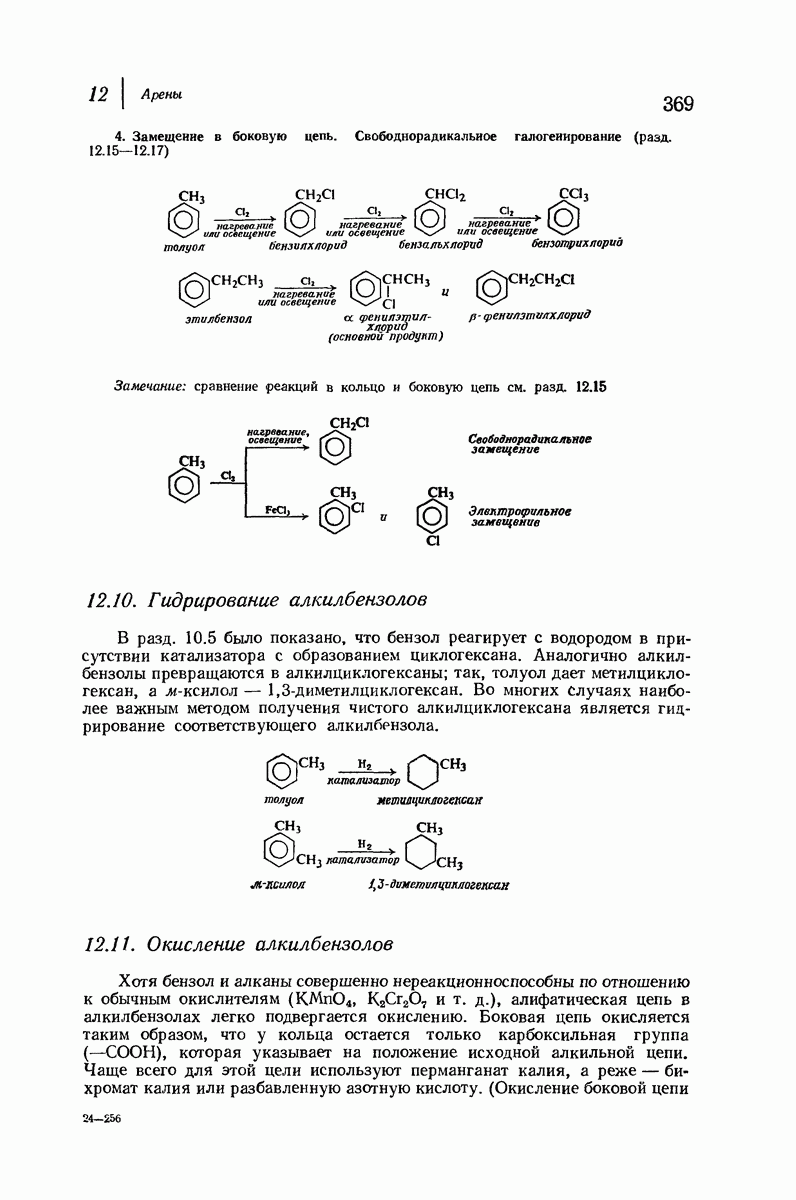
- 12.10. Гидрирование алкилбензолов
- 12.11. Окисление алкилбензолов
- 12.12. Нитрование алкилбензолов
- 12.13. Сульфирование алкилбензолов
- 12.14. Алкилирование алкилбензолов по Фриделю-Крафтсу
- 12.15. Галогенирование алкилбензолов в кольцо и в боковую цепь
- 12.16. Бромирование алкилбензолов в боковую цепь: ориентация и реакционная способность
- 12.17. Хлорирование алкилбензолов в боковую цепь: ориентация и реакционная способность. Полярные факторы при свободнорадикальных реакциях
- 12.18. Резонансная стабилизация свободного аллильного радикала
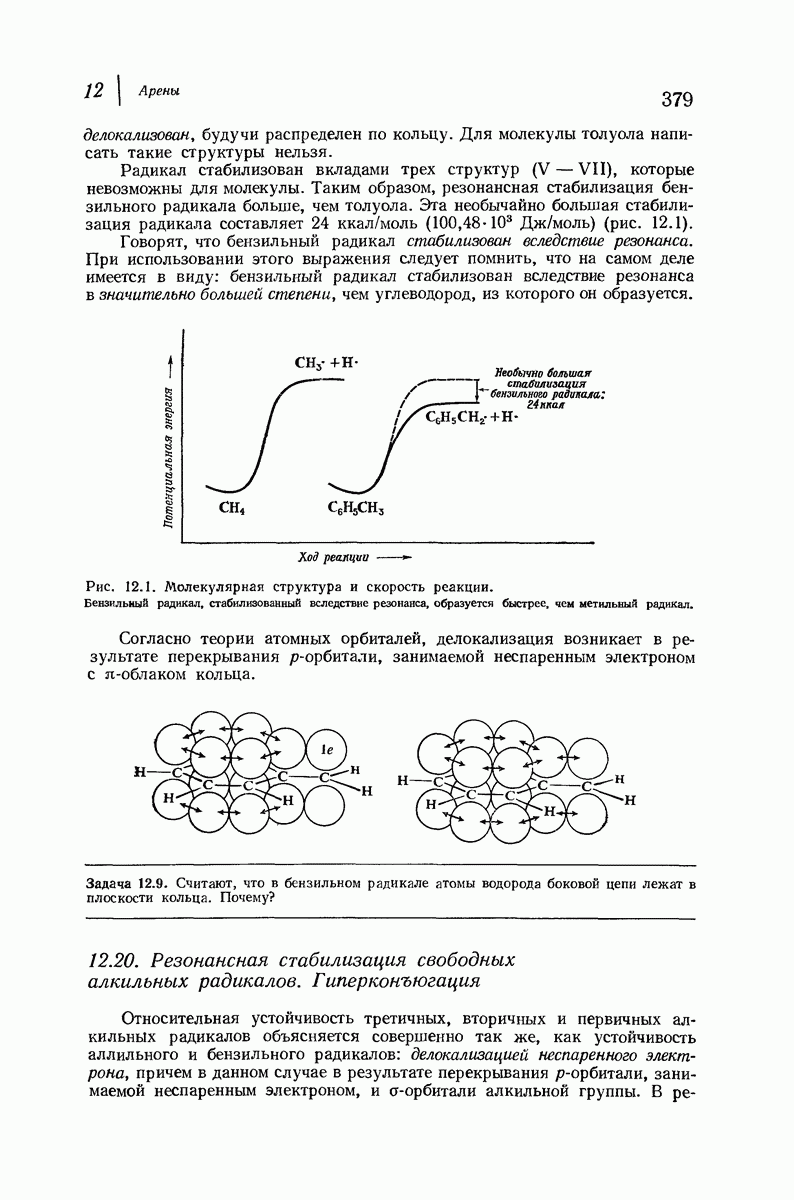
- 12.19. Резонансная стабилизация свободного бензильного радикала
- 12.20. Резонансная стабилизация свободных алкильных радикалов. Гиперконъюгация
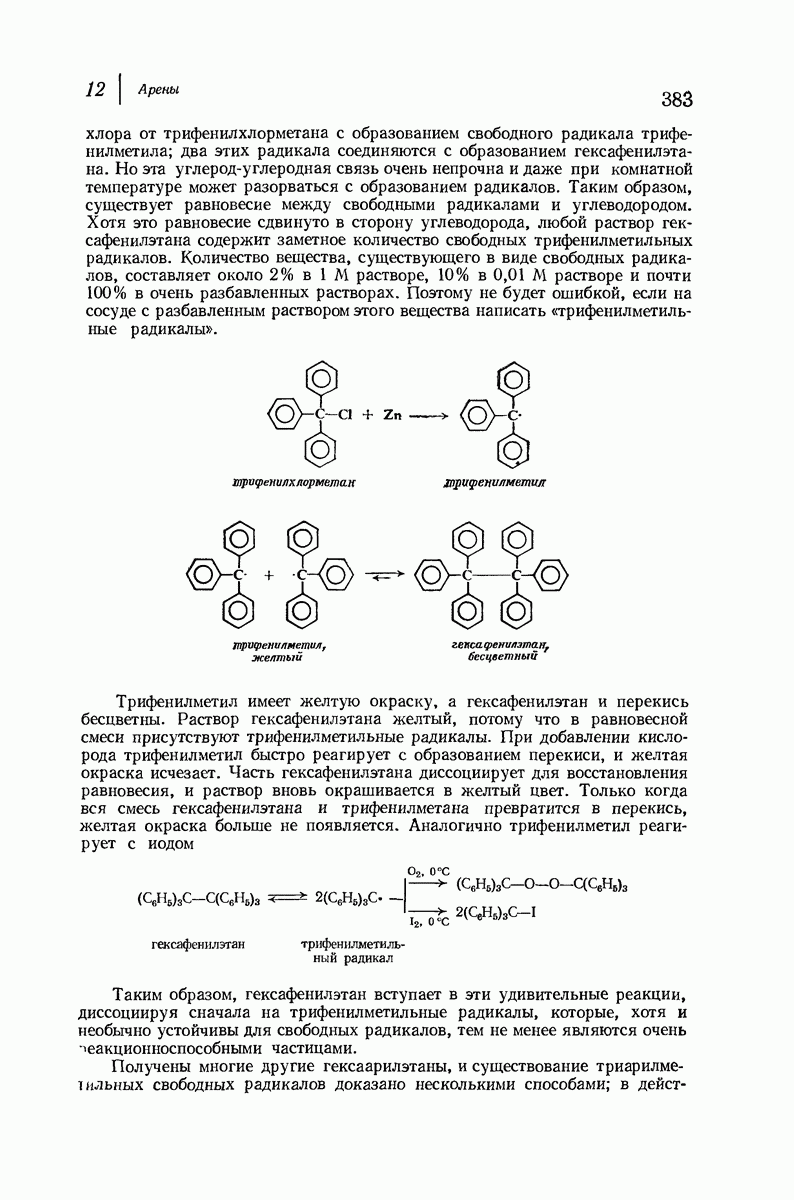
- 12.21. Трифенилметил: устойчивый свободный радикал
- 12.22. Получение алкилбензолов. Сопряжение с кольцом
- 12.23. Реакции алкенилбензолов
- 12.24. Присоединение к сопряженным алкенилбензолам: ориентация. Устойчивость бензильного карбониевого иона
- 12.25. Присоединение к сопряженным алкенилбензолам: реакционная способность
- 12.26. Полимеризация стирола
- 12.27. Алкинилбензолы
- 12.28. Анализ алкилбензолов
- 12.29. Анализ алкенил- и алкинилбензолов
- 13. Спектроскопия и строение органических соединений
- 13.2. Масс-спектры
- 13.3. Электромагнитный спектр
- 13.4. Инфракрасный спектр
- 13.5. Ультрафиолетовый спектр
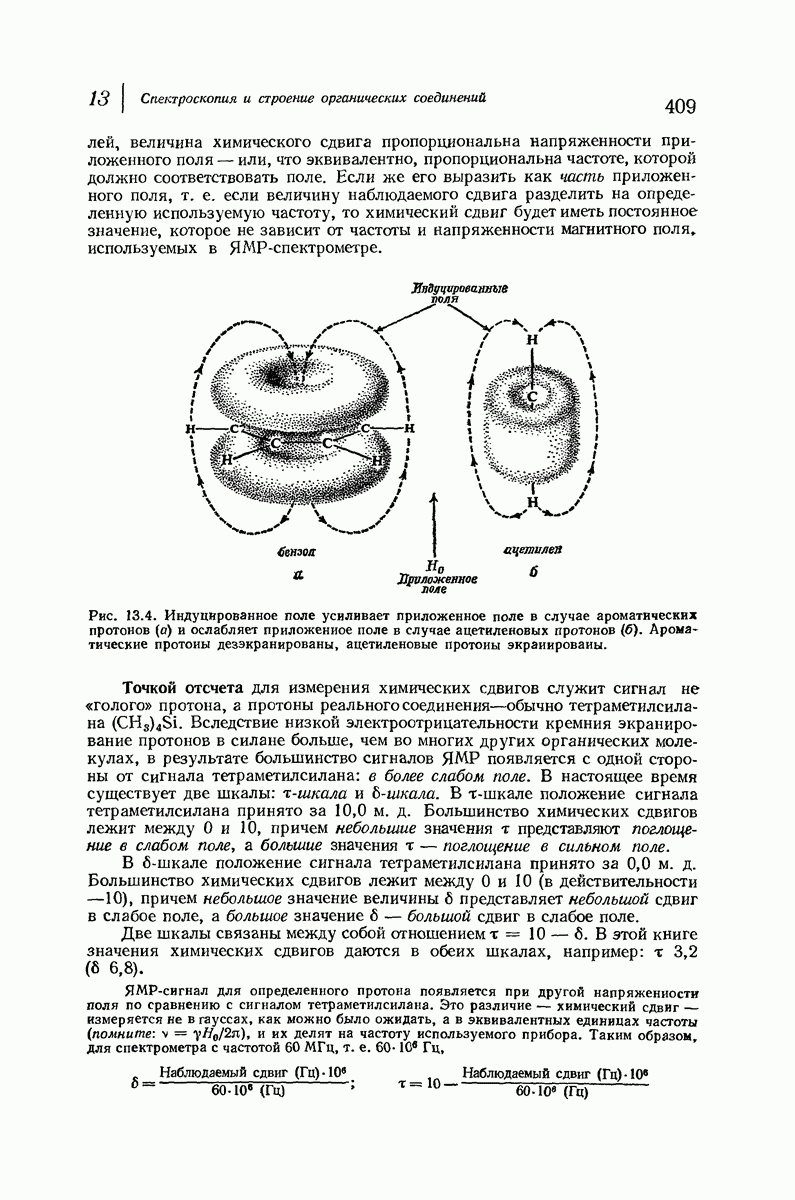
- 13.6. Спектр ядерного магнитного резонанса (ЯMP)
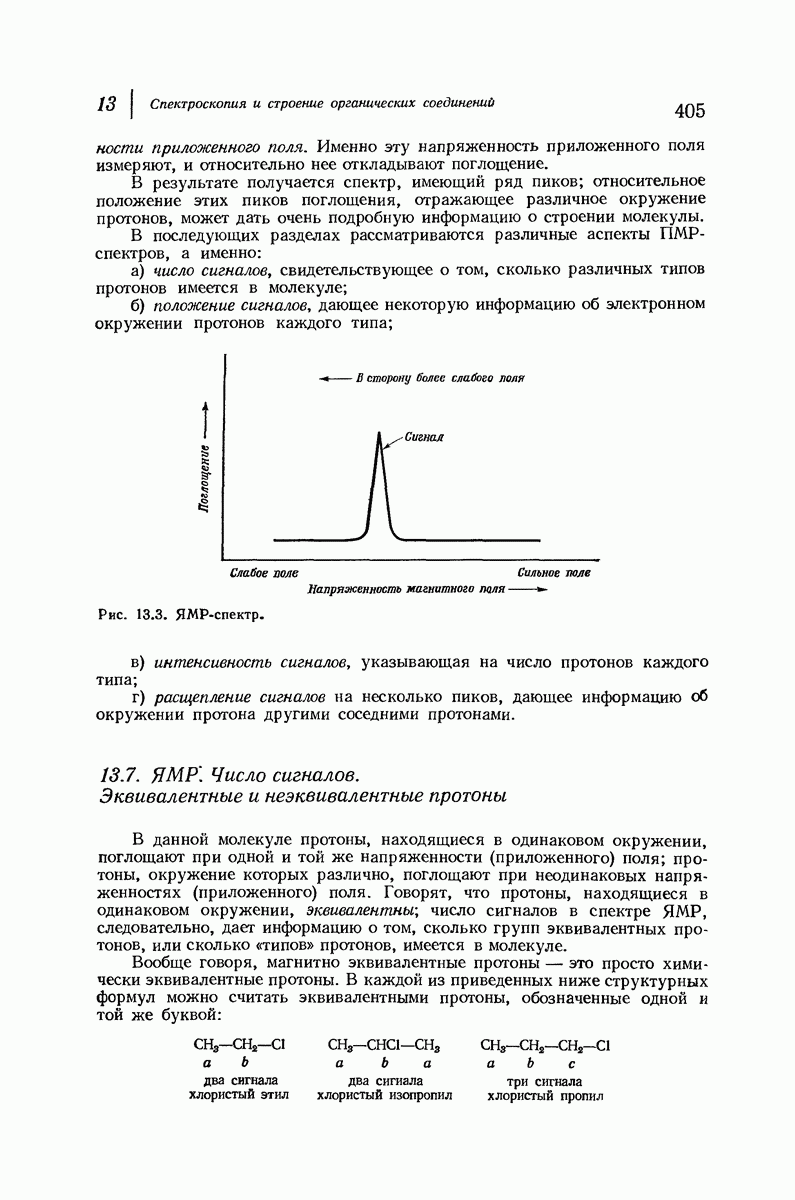
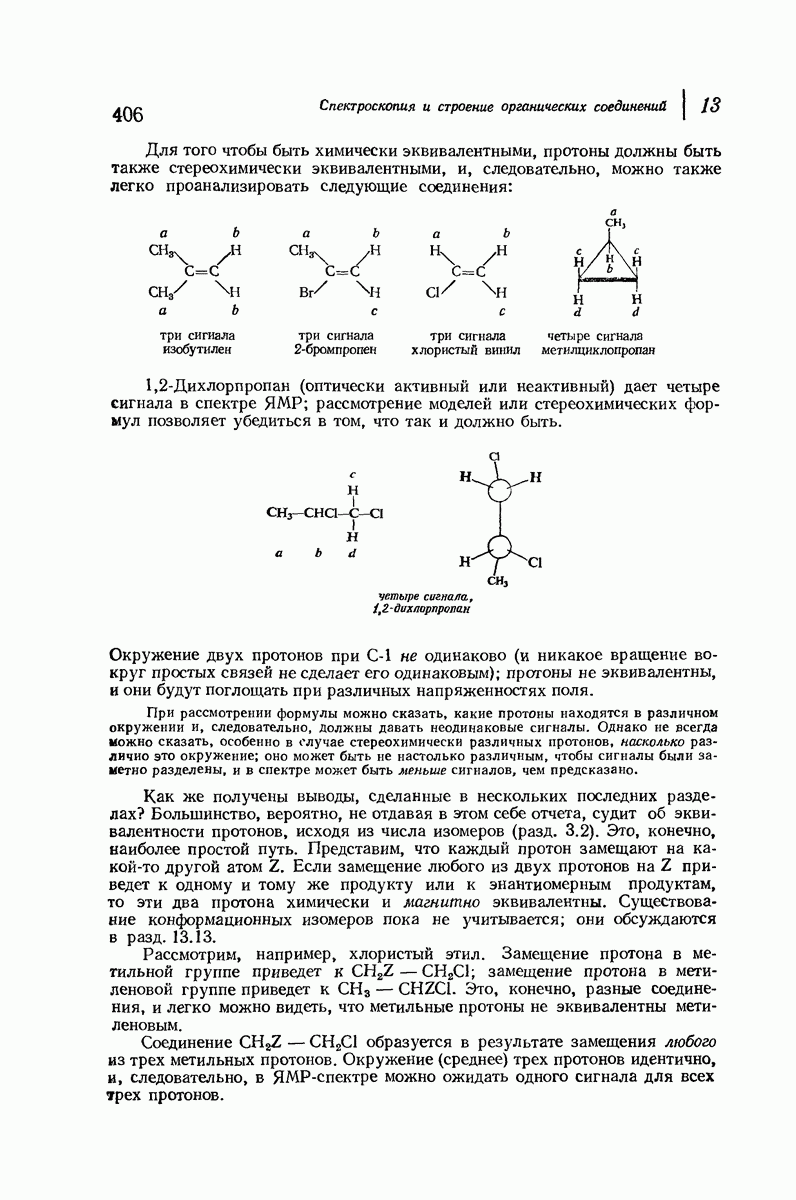
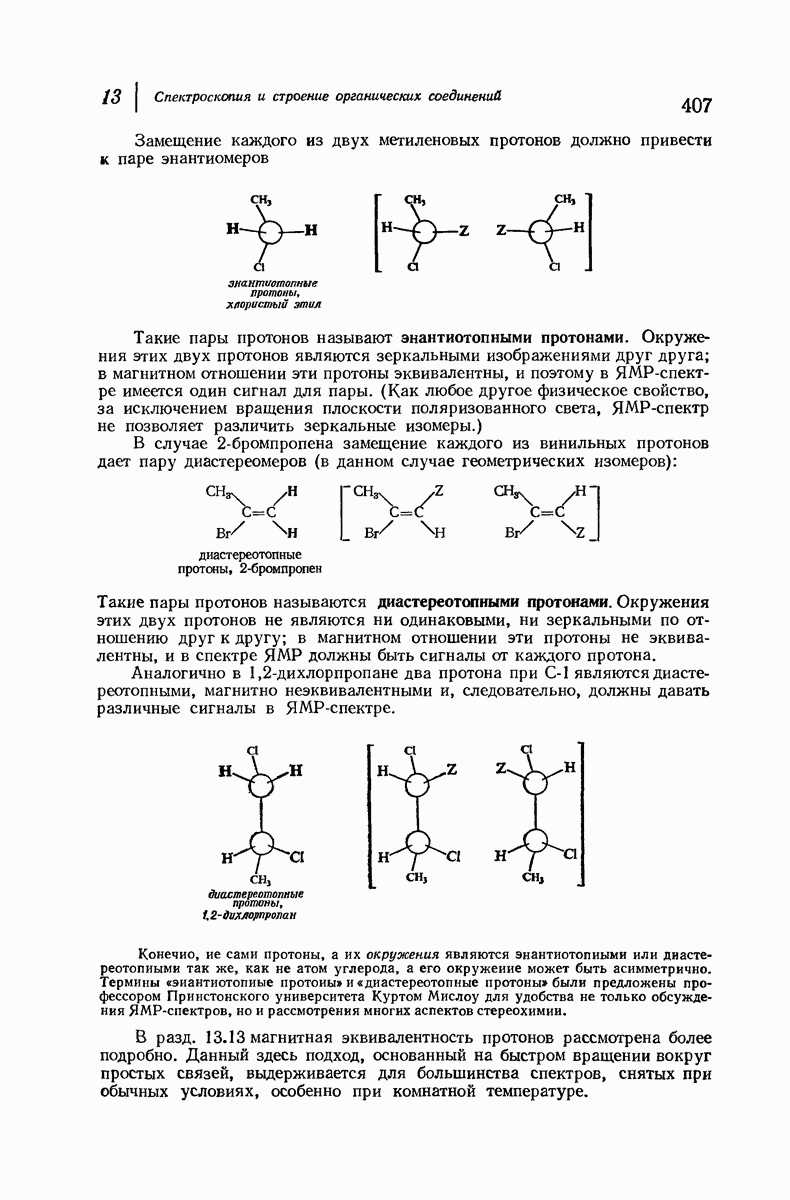
- 13.7. ЯМР. Число сигналов. Эквивалентные и неэквивалентные протоны
- 13.8. ЯМР. Положение сигналов. Химический сдвиг
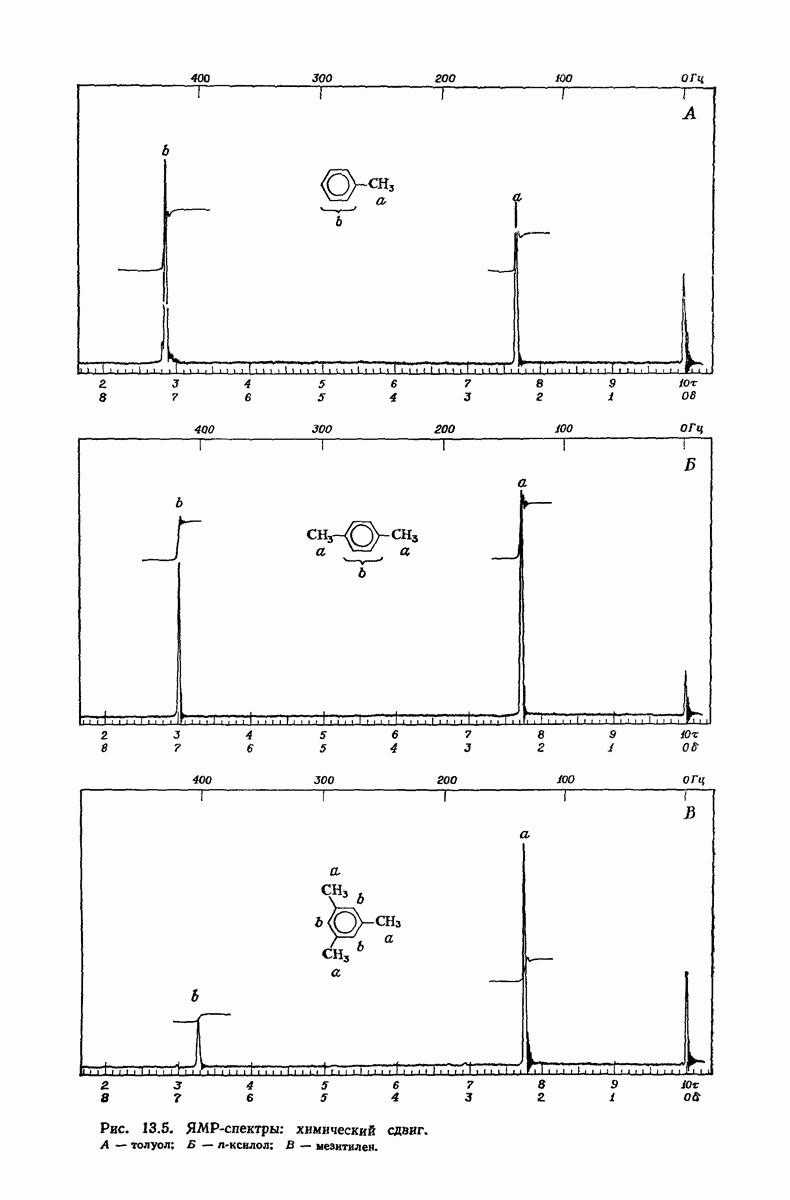
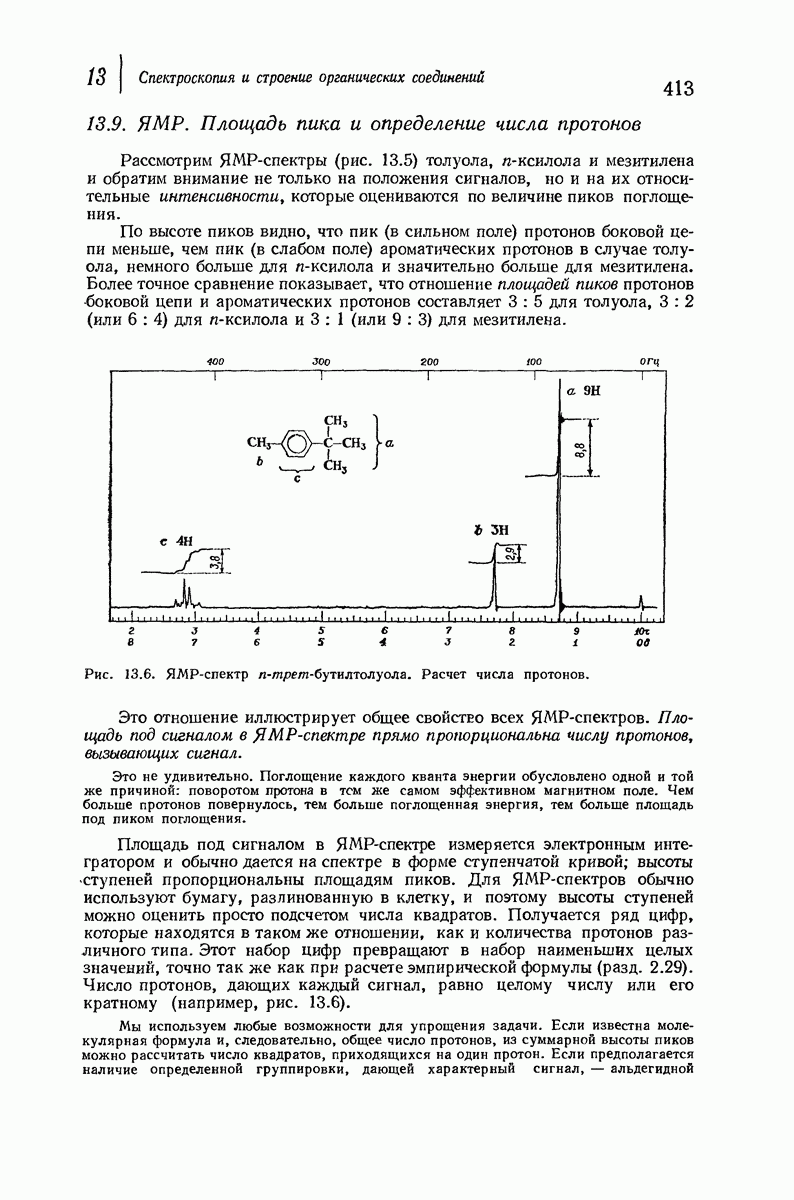
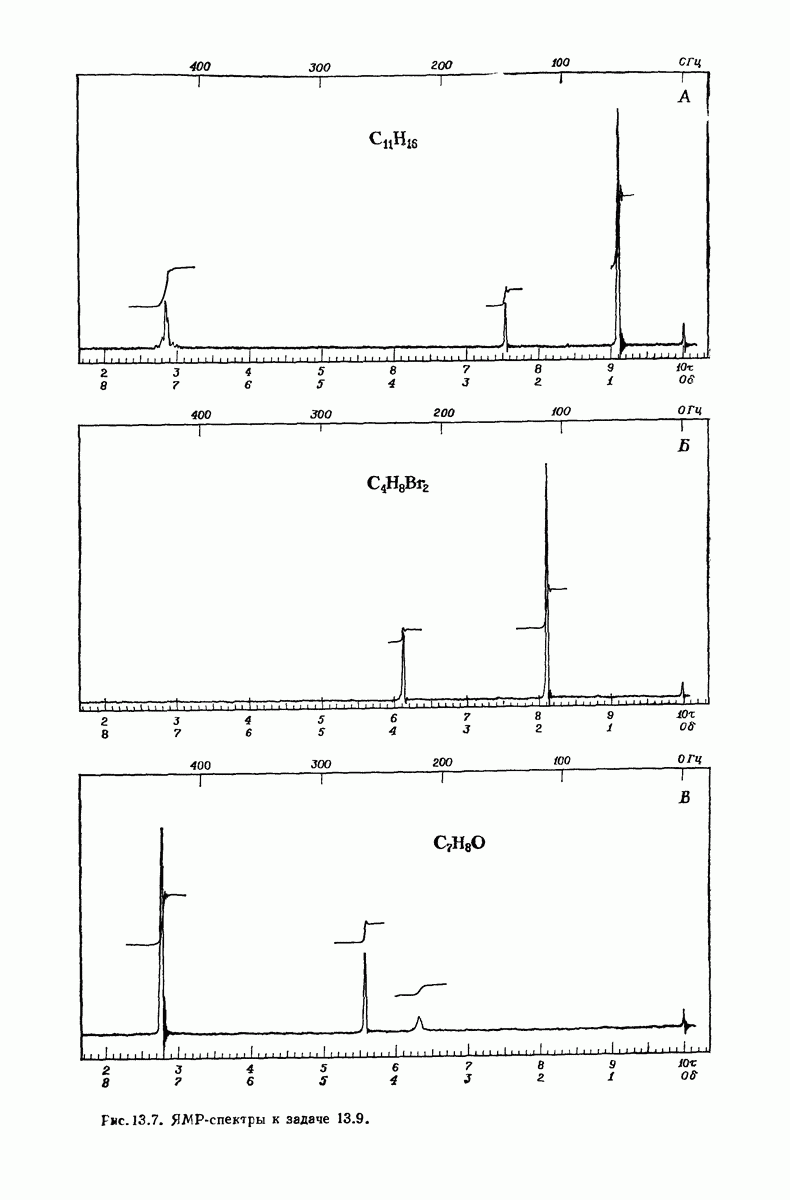
- 13.9. ЯМР. Площадь пика и определение числа протонов
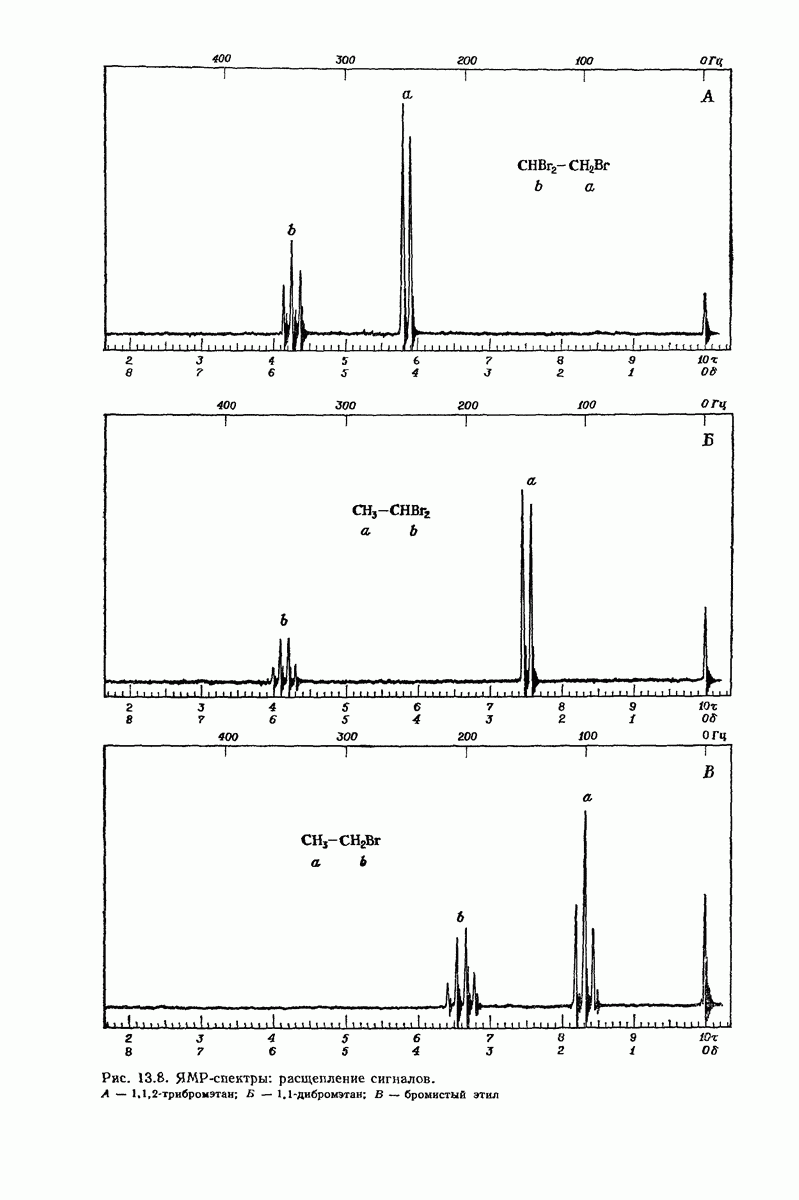
- 13.10. ЯМР. Расщепление сигналов. Спин-спиновое взаимодействие
- 13.11. ЯМР. Константы взаимодействия
- 13.12. ЯМР. Сложные спектры. Дейтериееая метка
- 13.13. Магнитная эквивалентность протонов: более подробное рассмотрение
- 13.14. ЯМР и конформационный анализ
- 13.15. Спектр электронного парамагнитного резонанса (ЭПР)
- 13.16. Спектральный анализ углеводородов. Масс-спектры
- 13.17. Спектральный анализ углеводородов. Инфракрасные спектры
- 13.18. Спектральный анализ углеводородов. ЯМР-спектры
- 14. Алкилгалогениды. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АЛИФАТИЧЕСКОМ РЯДУ
- 14.8. Кинетика реакции нуклеофильного замещения в алифатическом ряду. Реакции первого и второго порядка
- 14.9. SN2-Реакция: механизм и кинетика
- 14.10. SN2-Реакция: стереохимия
- 14.11. SN2-Реакция: реакционная способность
- 14.12. SN1-Реакция: механизм и кинетика. Стадия, определяющая скорость
- 14.13. Стереохимия SN1-реакций
- 14.14. SN1-Реакция: реакционная способность
- 14.15. SN1-Реакция: перегруппировки
- 14.16. Сравнение SN1- и SN2-реакций
- 14.17. Элиминирование (отщепление): Е2 и Е1
- 14.18. Доказательства Е1-механизма
- 14.19. Доказательства E2-механизма
- 14.20. Сравнение реакций элиминирования и замещения
- 14.21. Апротонные растворители
- 14.22 Анализ алкилгалогенидов
- 14.23. Спектральный анализ алкилгалогенидов
- 15. Спирты. I. Получение и физические свойства
- 15.5. Водородная связь. Ассоциация
- 15.6. Промышленные источники
- 15.7. Этиловый спирт
- 15.8. 95%-ный спирт: азеотропная смесь
- 15.9. Абсолютный спирт
- 15.10. Методы синтеза
- 15.11. Гидроборирование — окисление
- 15.12. Направление присоединения в реакции гидроборирования
- 15.13. Механизм реакции гидроборирования
- 15.14. Синтез спиртов с помощью реактивов Гриньяра
- 15.15. Продукты синтезов Гриньяра
- 15.16. Планирование синтезов Гриньяра
- 15.17. Ограничения синтеза Гриньяра
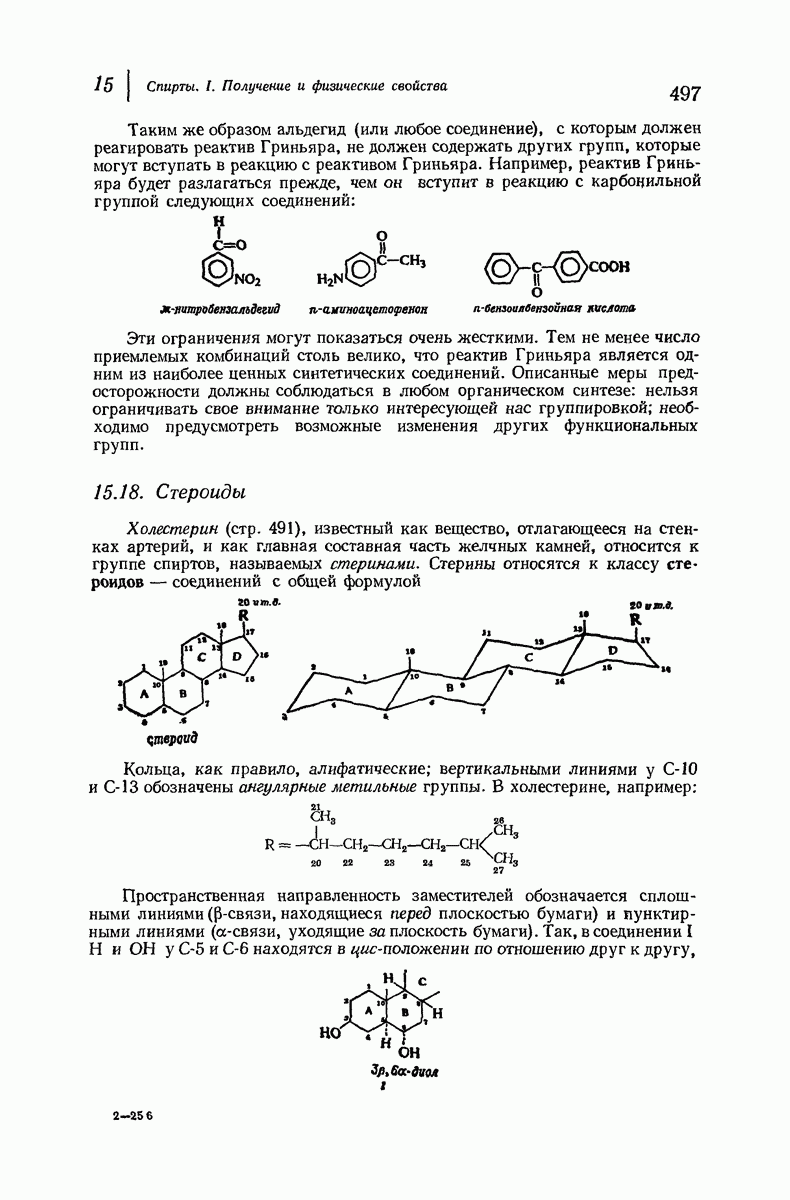
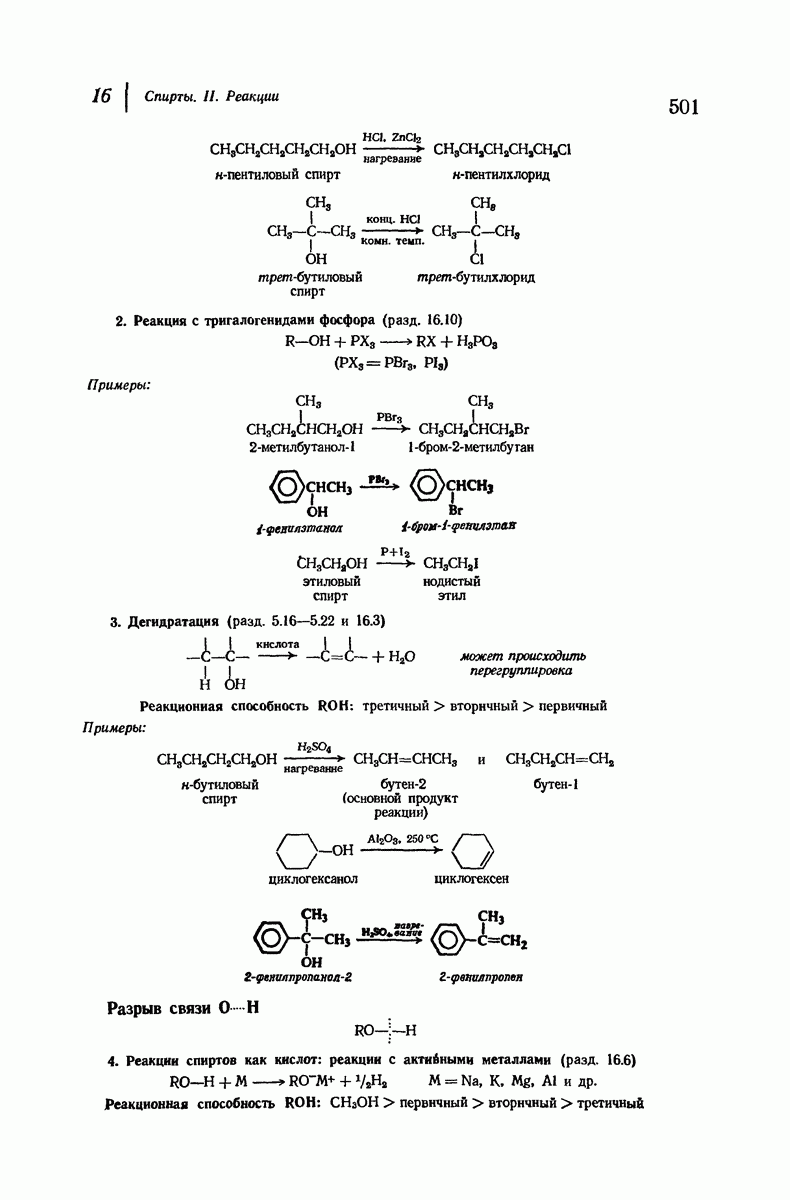
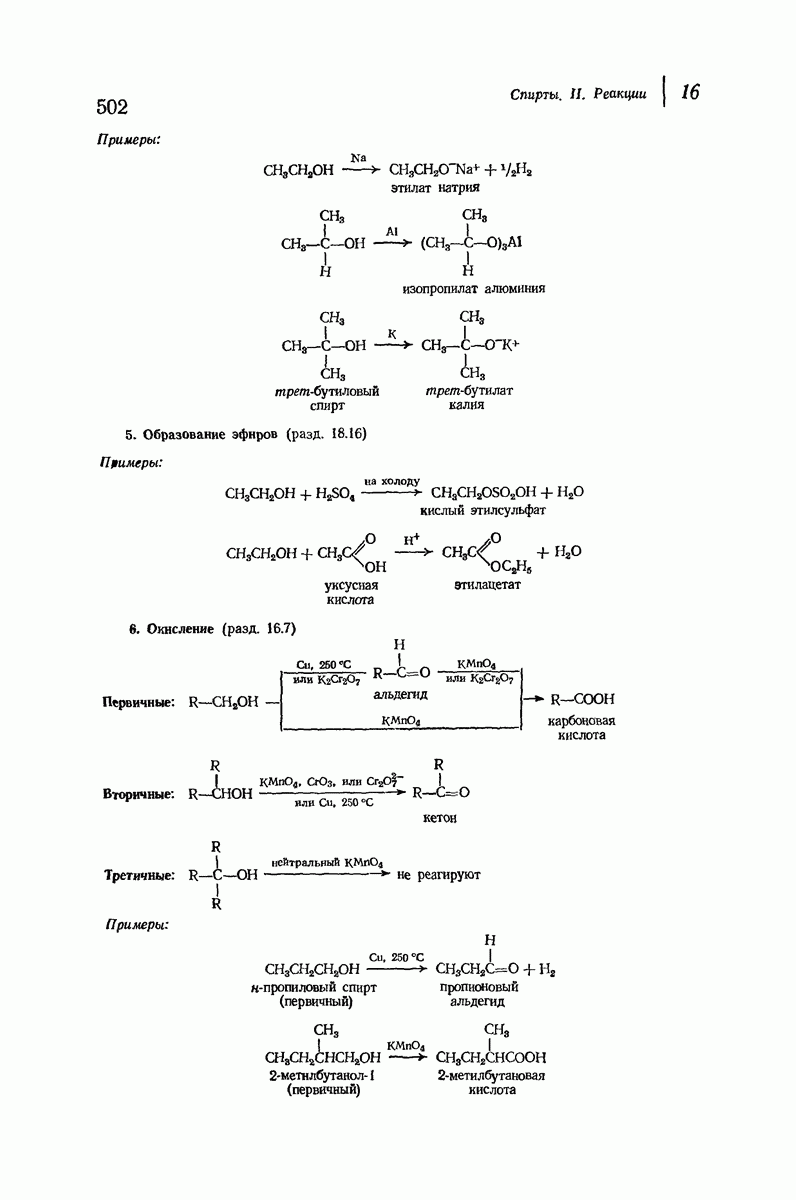
- 15.18. Стероиды
- 16. Спирты. II. Реакции
- 16.4. Реакции с галогеноводородами
- 16.5. Реакция с галогеноводородами: механизм
- 16.6. Спирты как кислоты
- 16.7. Окисление спиртов
- 16.8. Уравнивание окислительно-восстановительных реакций
- 16.9. Методы синтеза
- 16.10. Синтезы с использованием спиртов
- 16.11. Анализ спиртов. Характерные реакции. Проба Лукаса. Иодоформная реакция
- 16.12. Спектральный анализ
- 17. Простые эфиры
- 17.4. Перекиси в эфирах
- 17.5. Абсолютный эфир
- 17.6. Опасности при работе с диэтиловым эфиром
- 17.7. Синтез Вильямсона
- 17.8. Получение замещенных эфиров
- 17.9. Реакции простых эфиров. Расщепление кислотами
- 17.10. Электрофильное замещение в ароматических эфирах
- 17.11. Циклические эфиры
- 17.12. Анализ простых эфиров
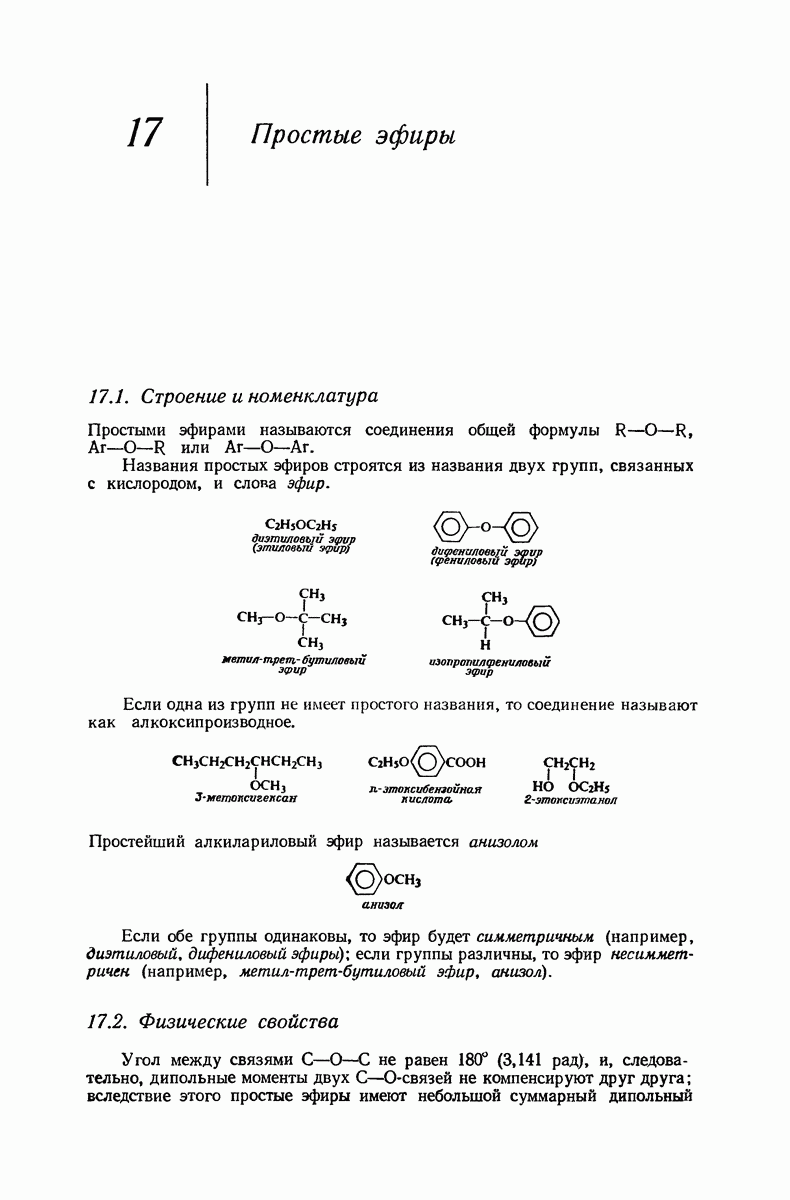
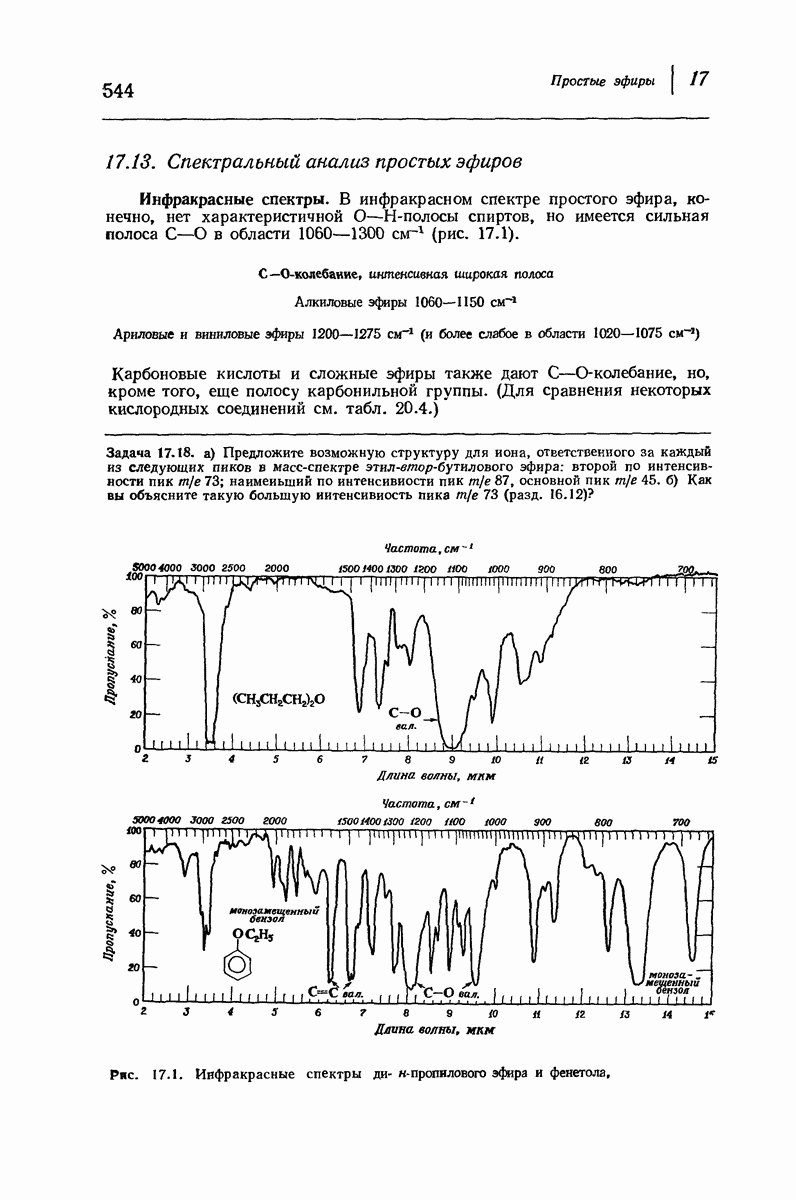
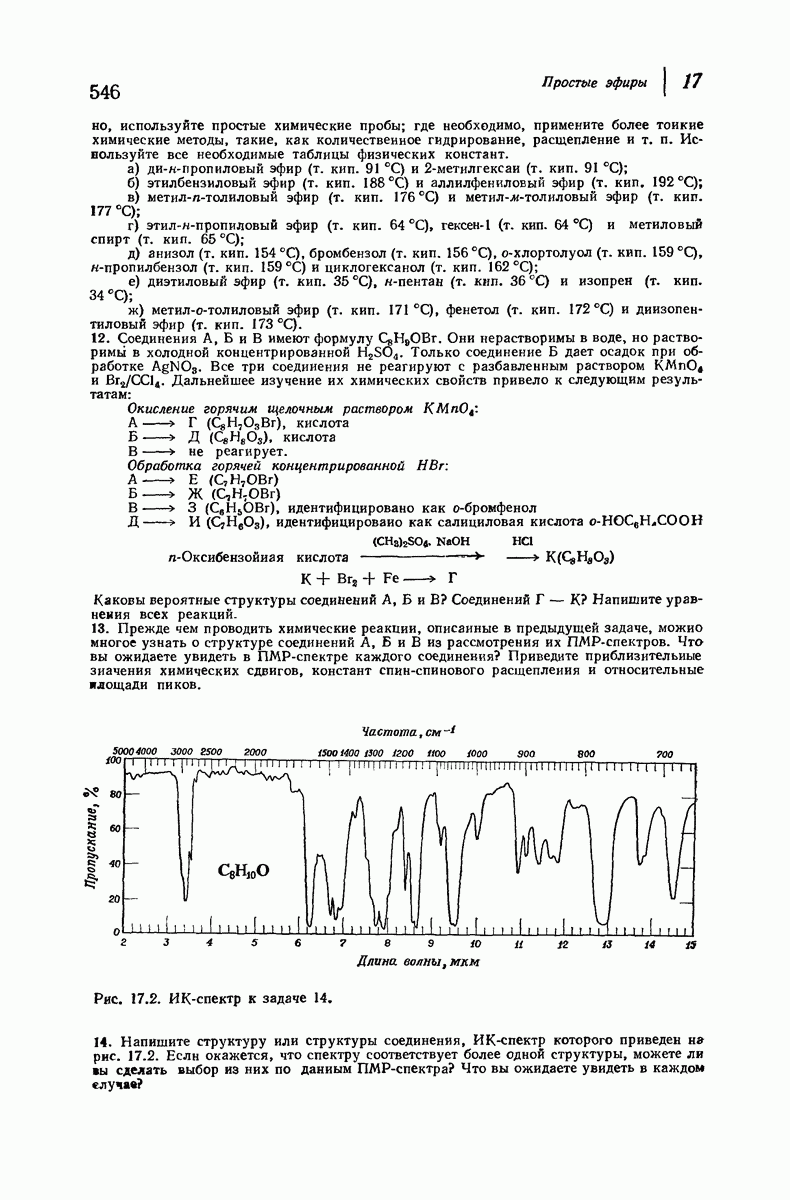
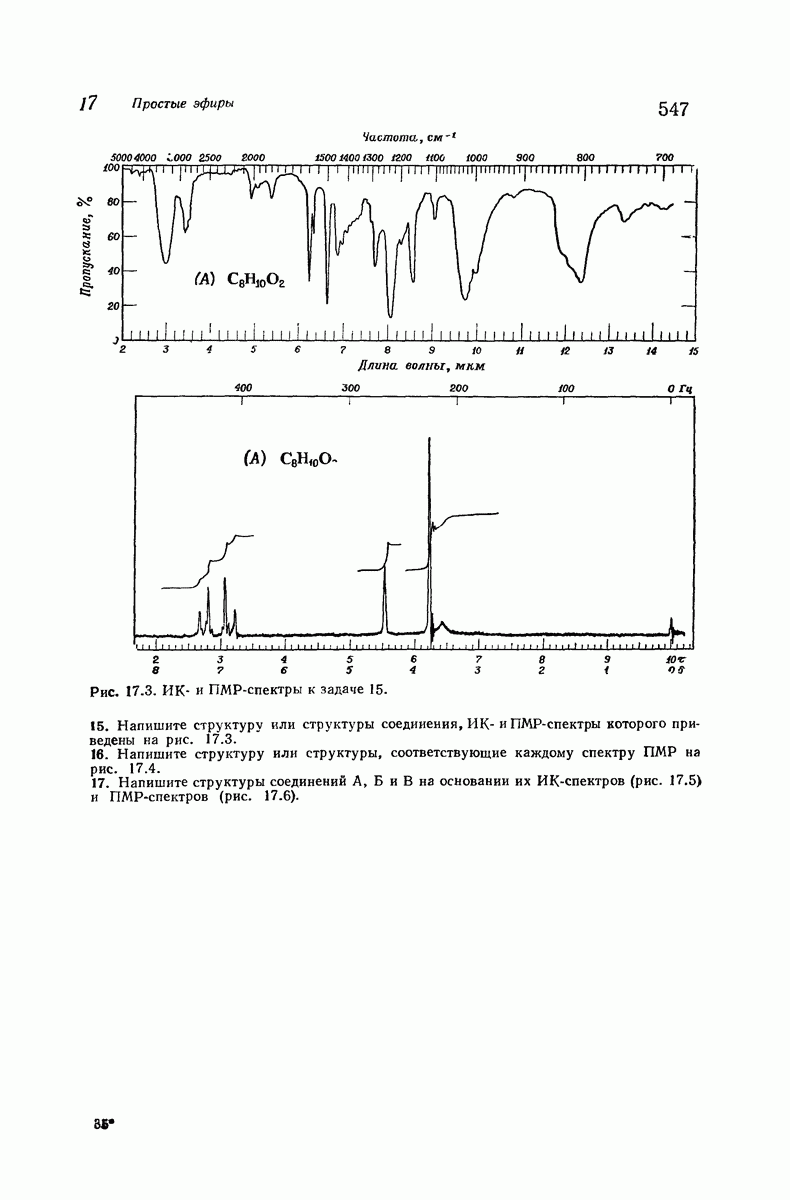
- 17.13. Спектральный анализ простых эфиров
- 18. Карбоновые кислоты
- 18.4. Соли карболовых кислот
- 18.7. Синтез Гриньяра
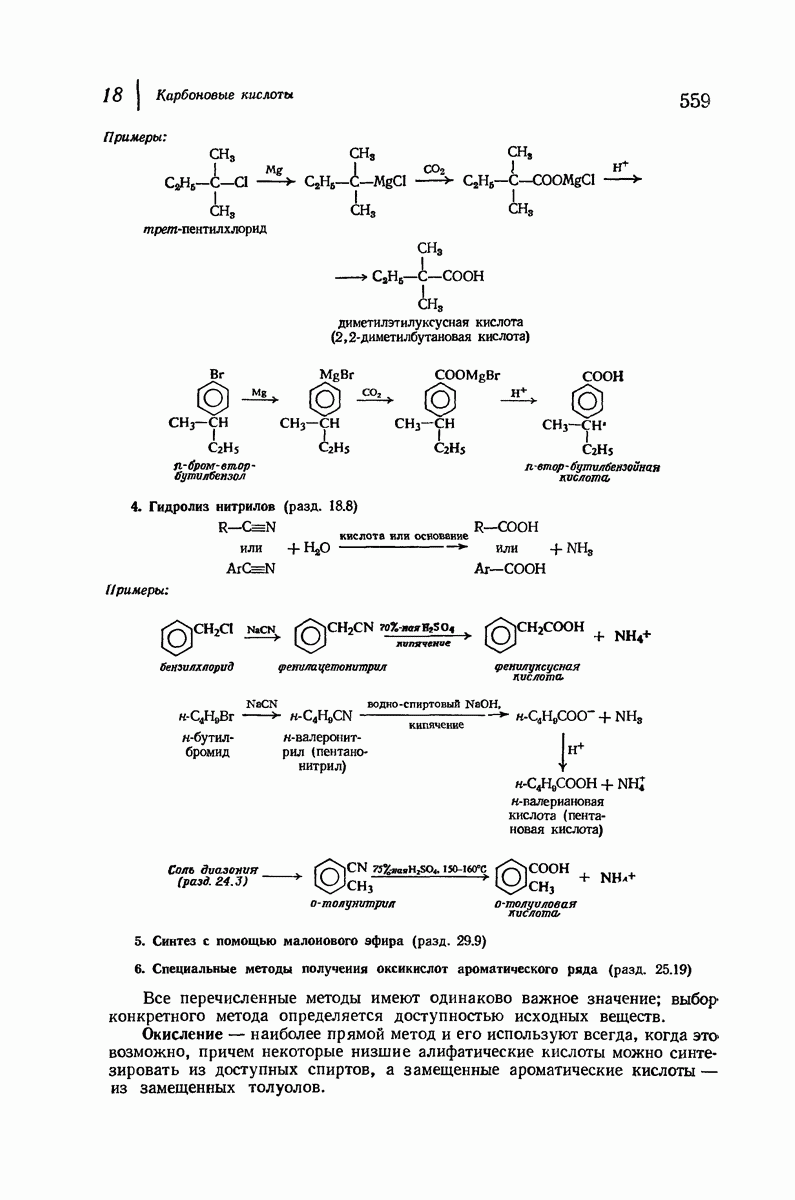
- 18.8. Нитрильный синтез
- 18.9. Реакции
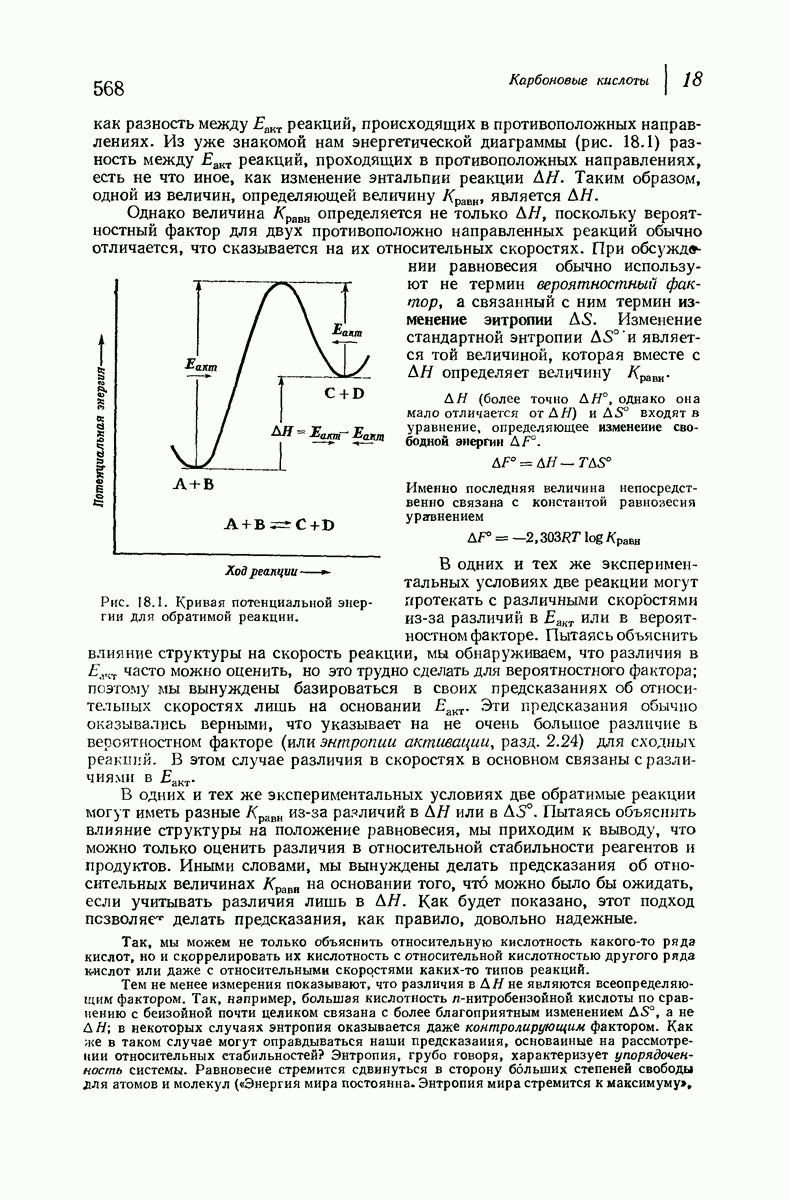
- 18.10. Ионизация карбоновых кислот. Константа кислотности
- 18.11. Равновесие
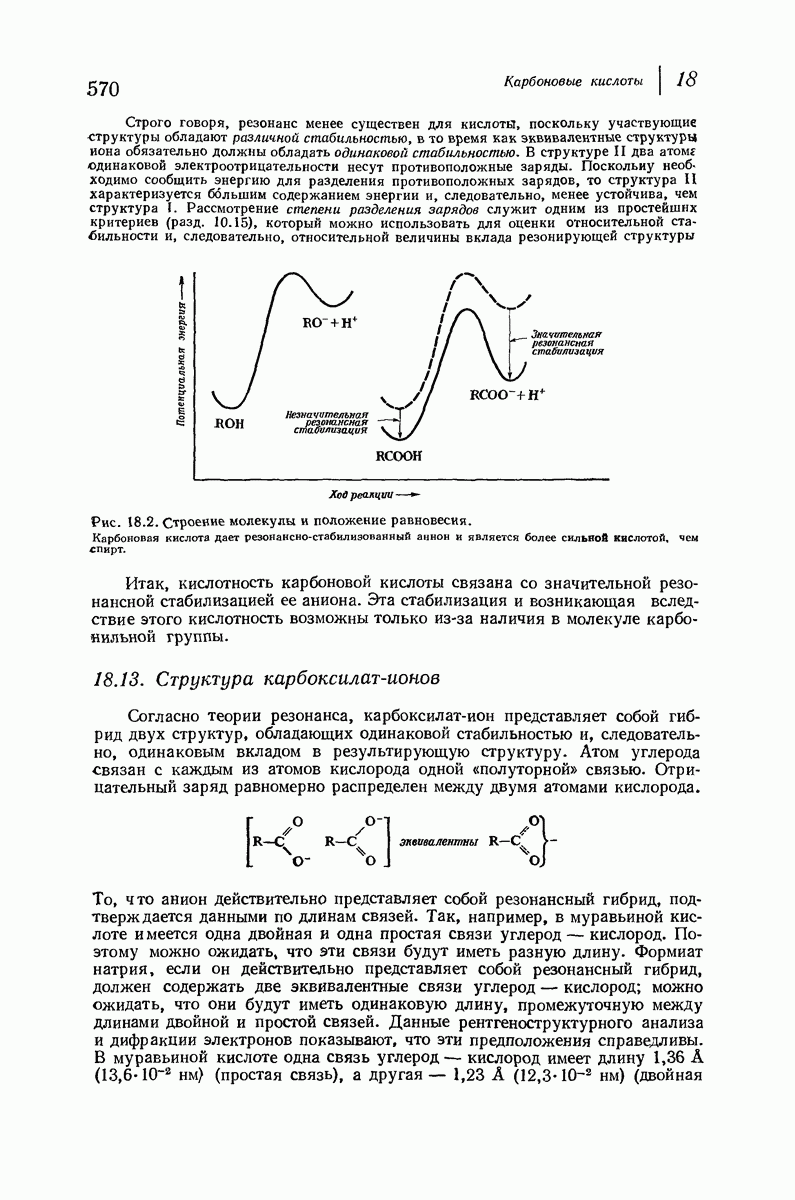
- 18.12. Кислотность карбоновых кислот
- 18.13. Структура карбоксилат-ионов
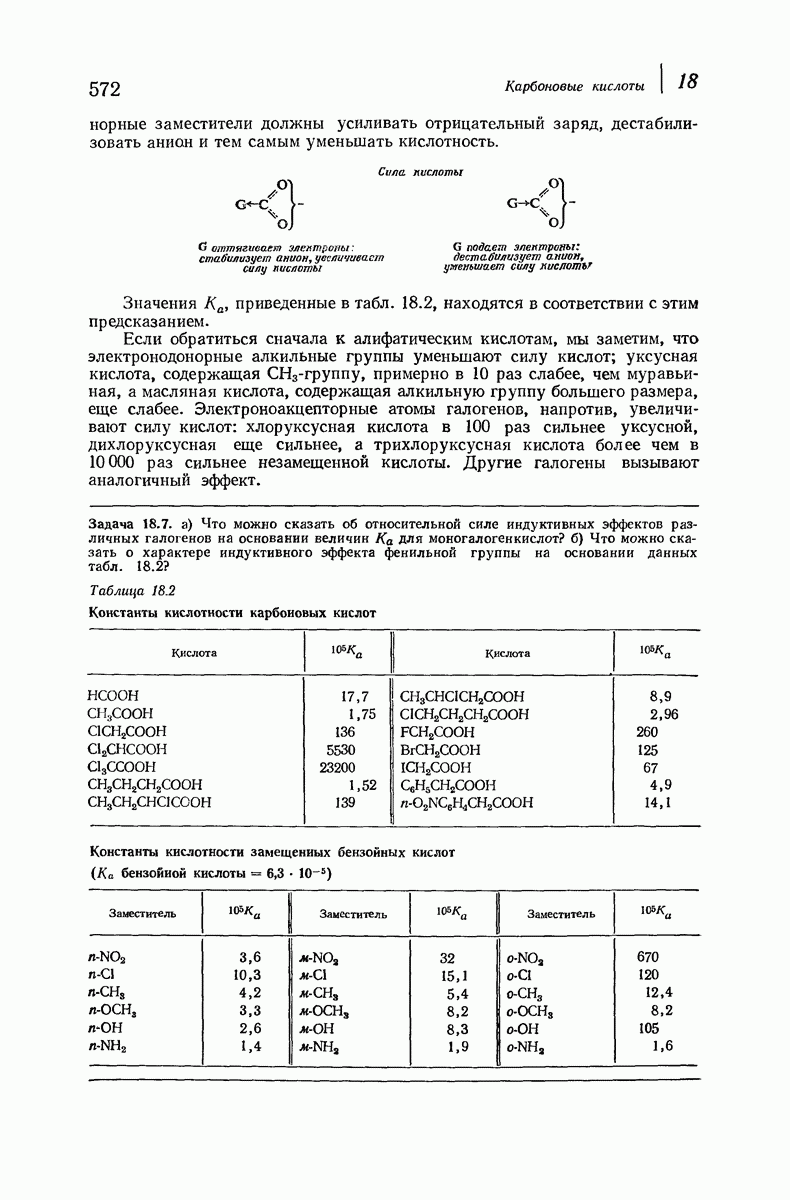
- 18.14. Влияние заместителей на кислотность
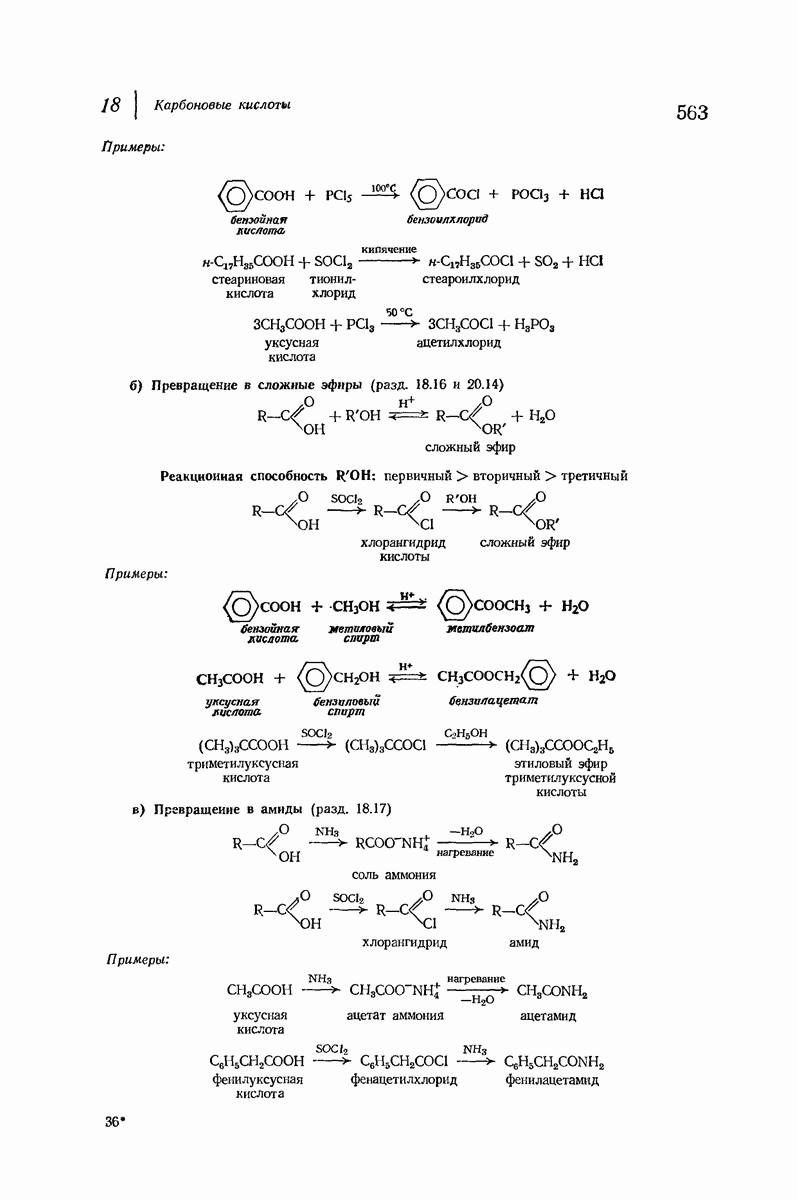
- 18.15. Превращение в хлорангидриды кислот
- 18.16. Превращение в сложные эфиры
- 18.17. Превращение в амиды
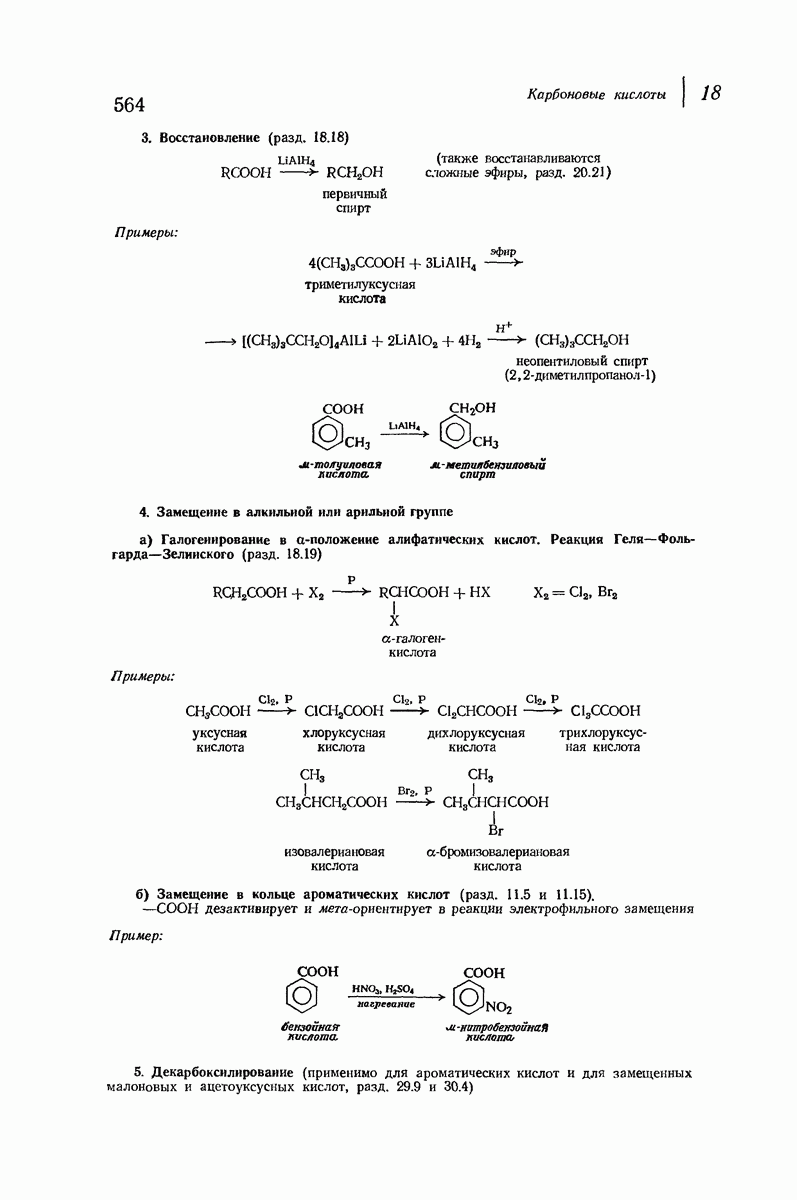
- 18.18. Восстановление кислот в спирты
- 18.19. Галогенирование алифатических кислот. Реакция Геля — Фольгарда — Зелинского
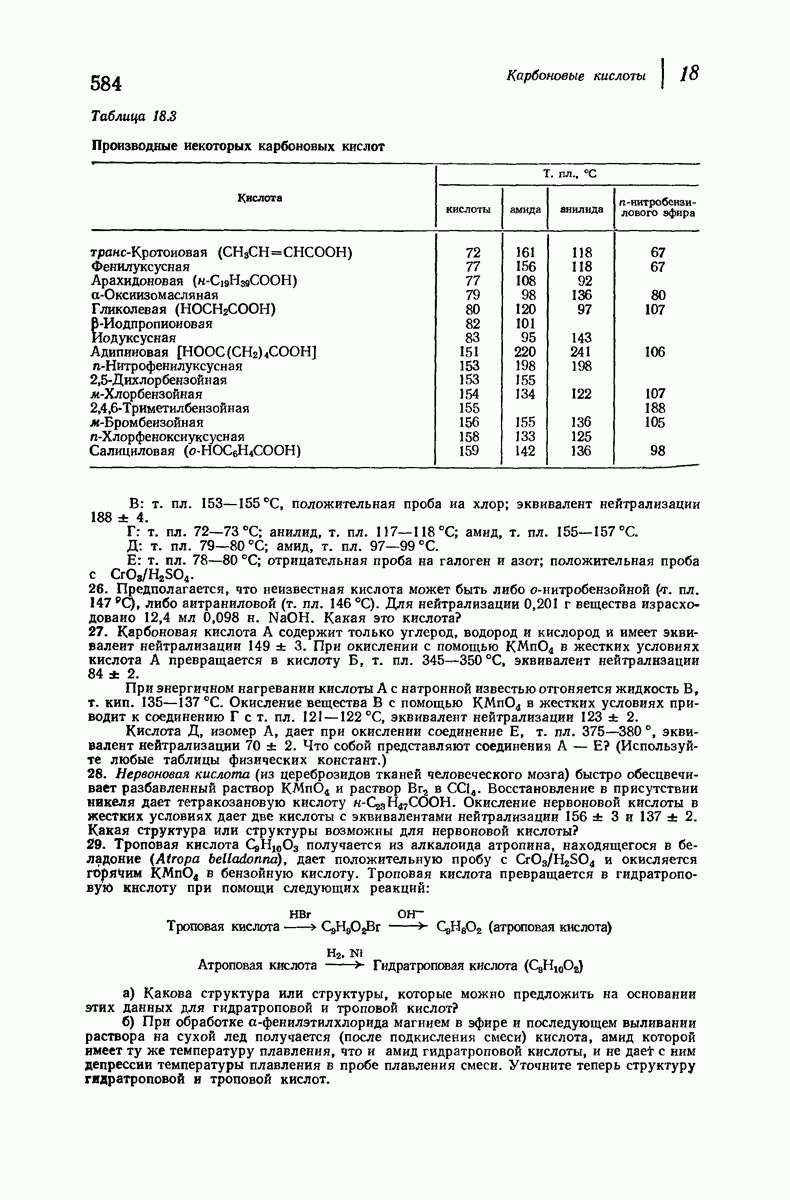
- 18.20. Анализ карбоновых кислот. Эквивалент нейтрализации
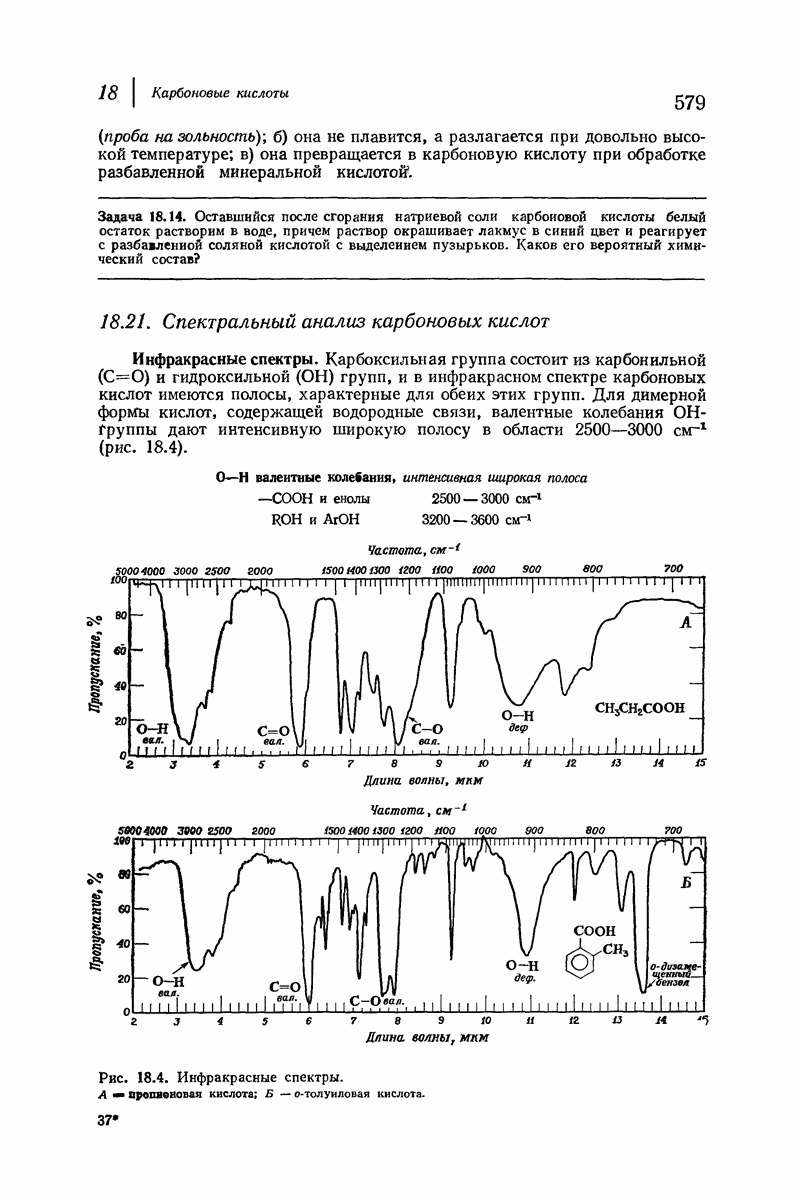
- 18.21. Спектральный анализ карбоновых кислот
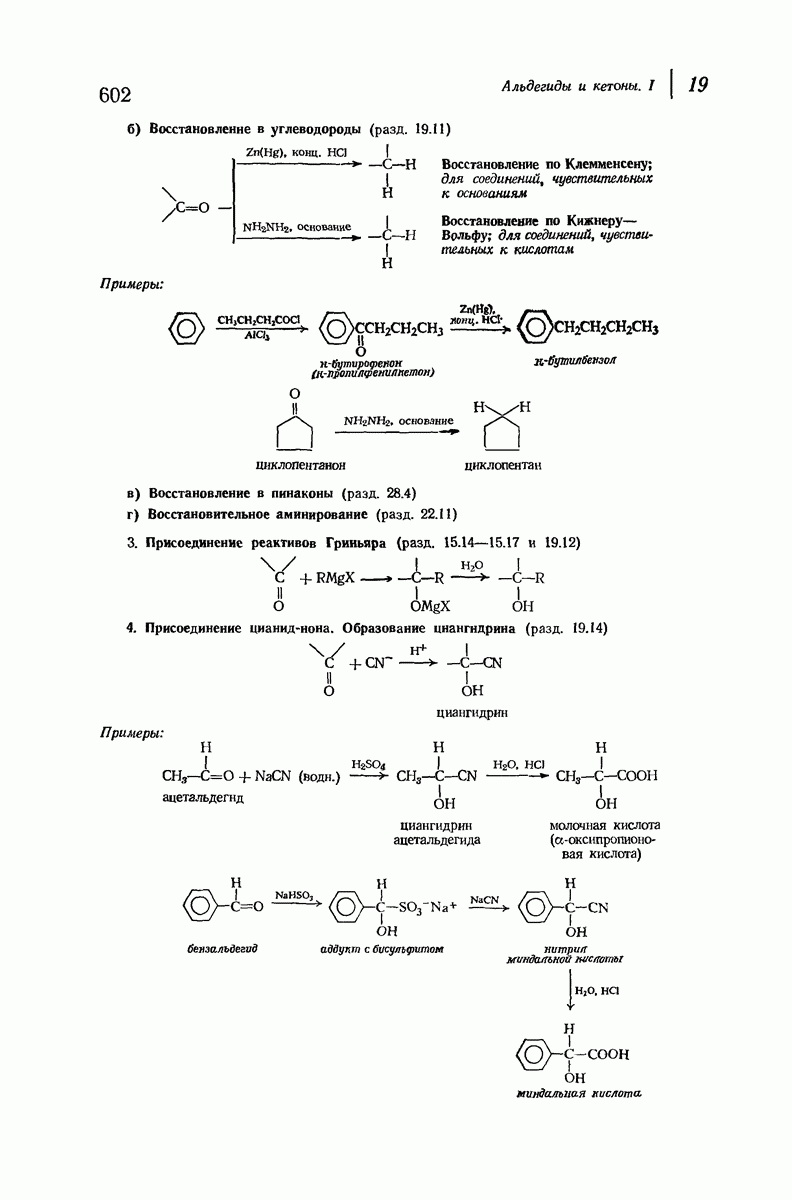
- 19. Альдегиды и кетоны. I НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ
- 19.6. Синтез альдегидов окислением
- 19.7. Синтез кетонов ацилированием по Фриделю — Крафтсу
- 19.8. Синтез кетонов с использованием кадмийорганических соединений
- 19.9. Реакции. Нуклеофильное присоединение
- 19.10. Окисление
- 19.11. Восстановление
- 19.12. Присоединение реактивов Гриньяра
- 19.13. Восстановление гидридами металлов
- 19.14. Присоединение цианид-иона
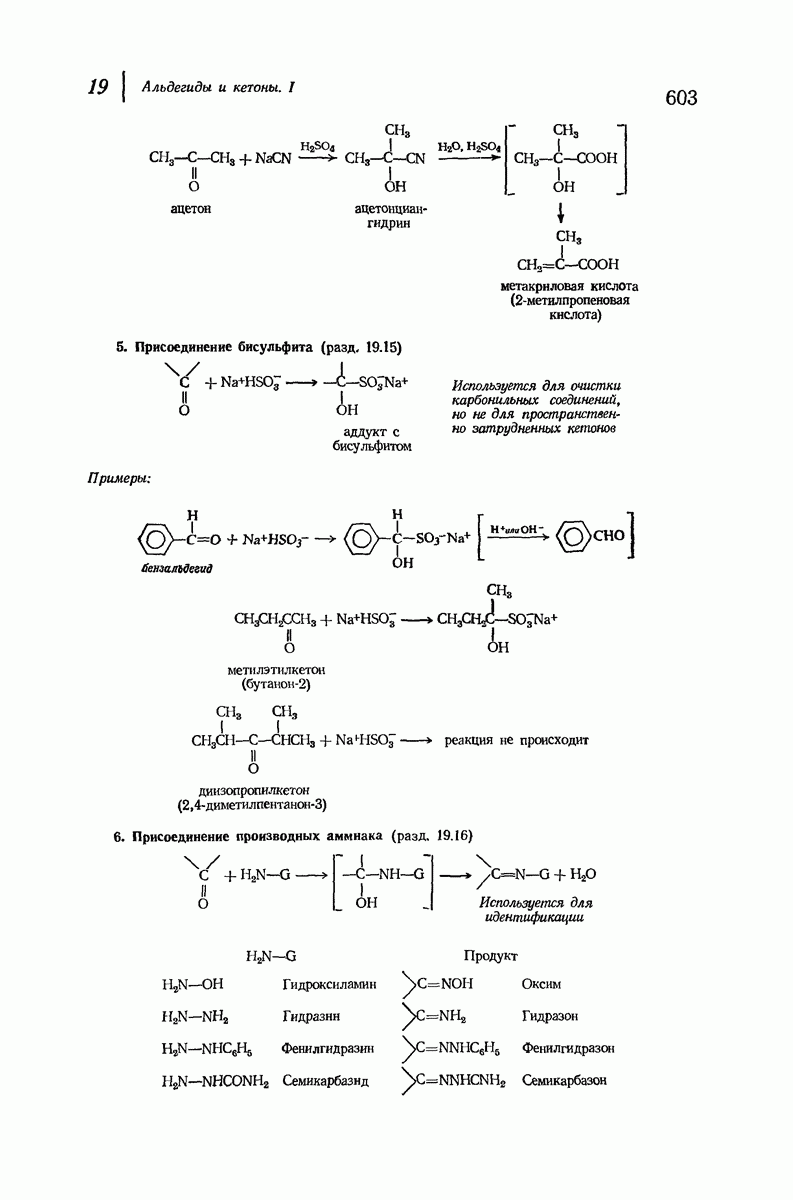
- 19.15. Присоединение бисульфита
- 19.16. Присоединение производных аммиака
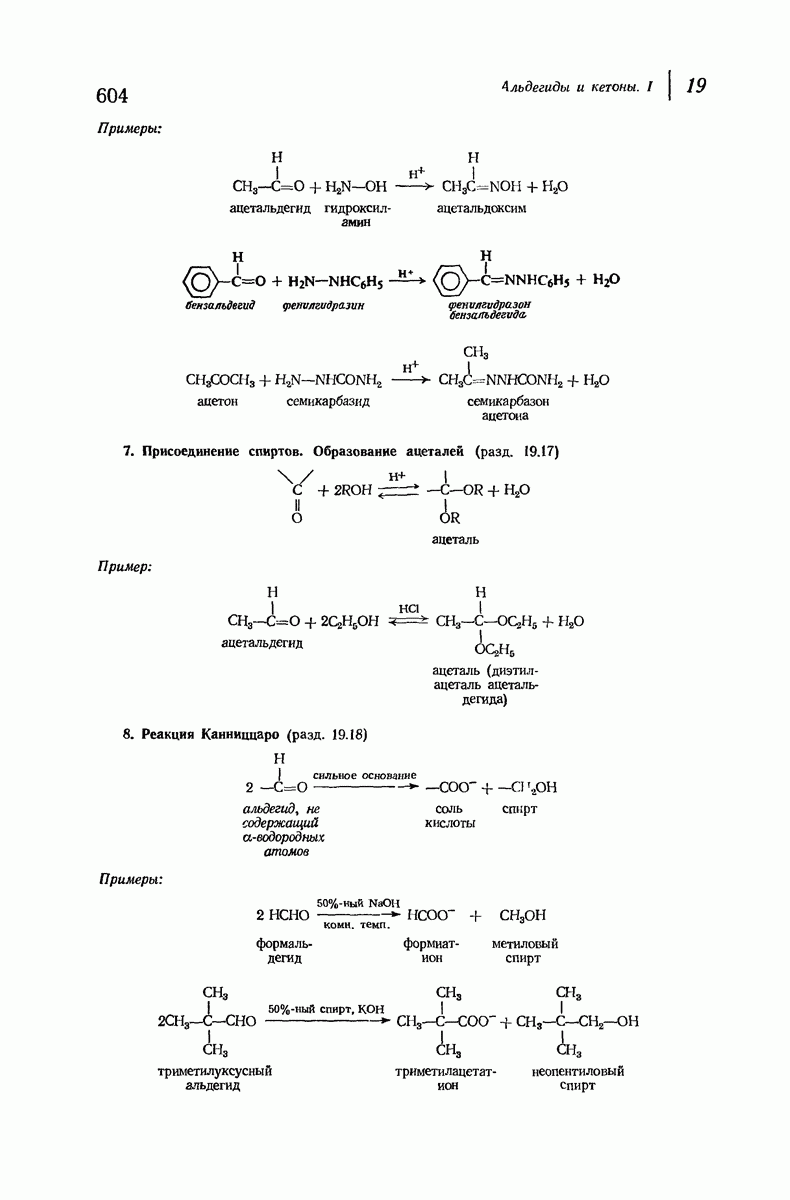
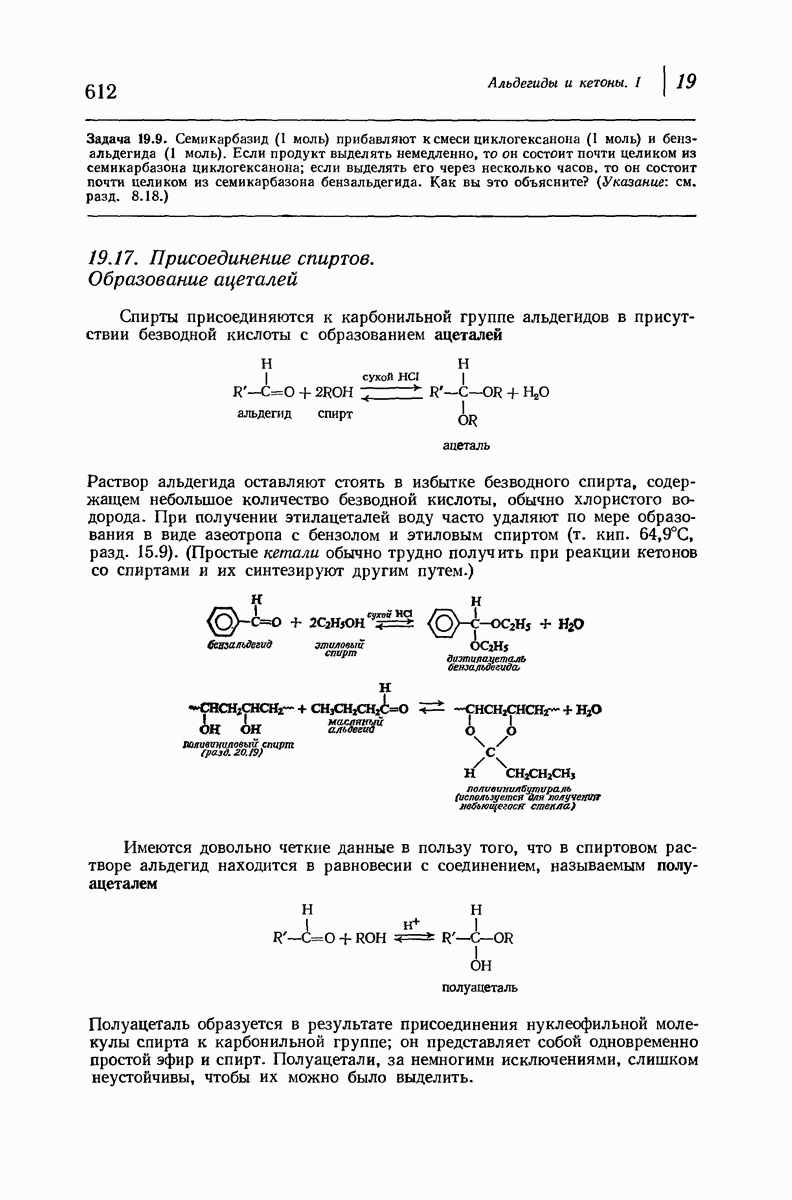
- 19.17. Присоединение спиртов. Образование ацеталей
- 19.18. Реакция Канниццаро
- 19.19. Анализ альдегидов и кетонов
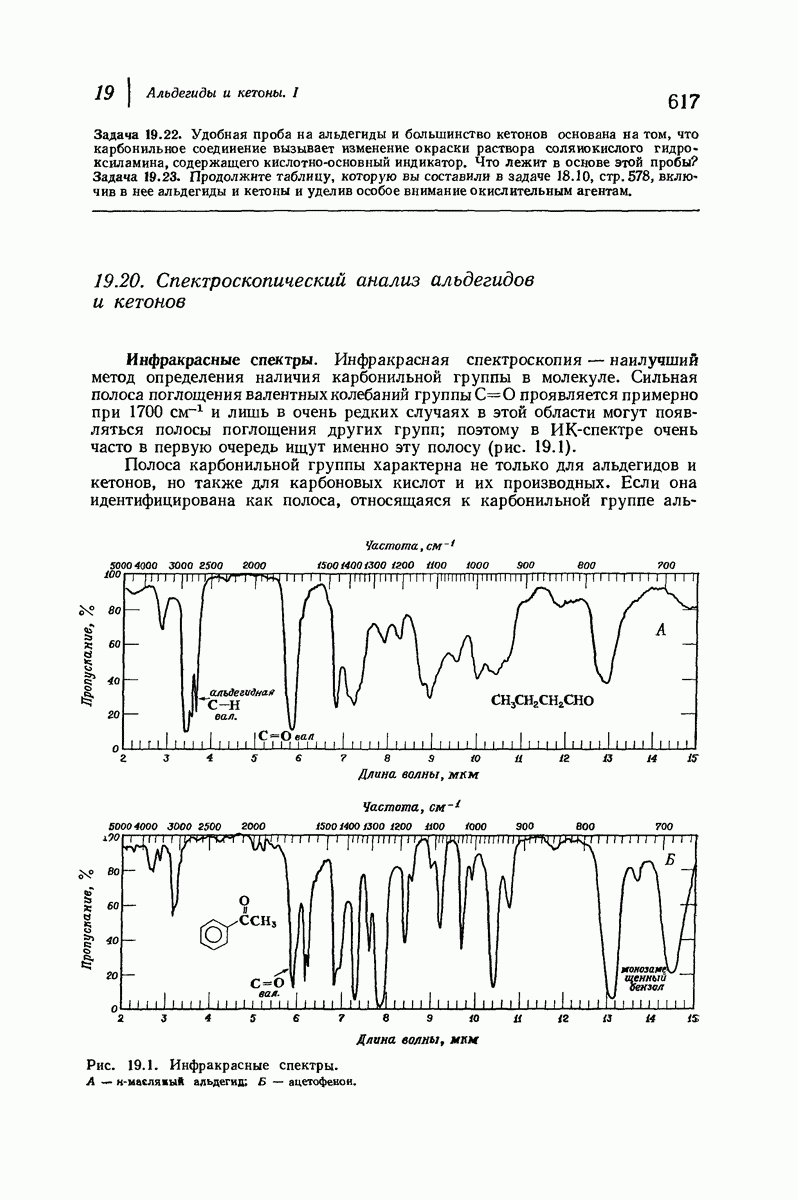
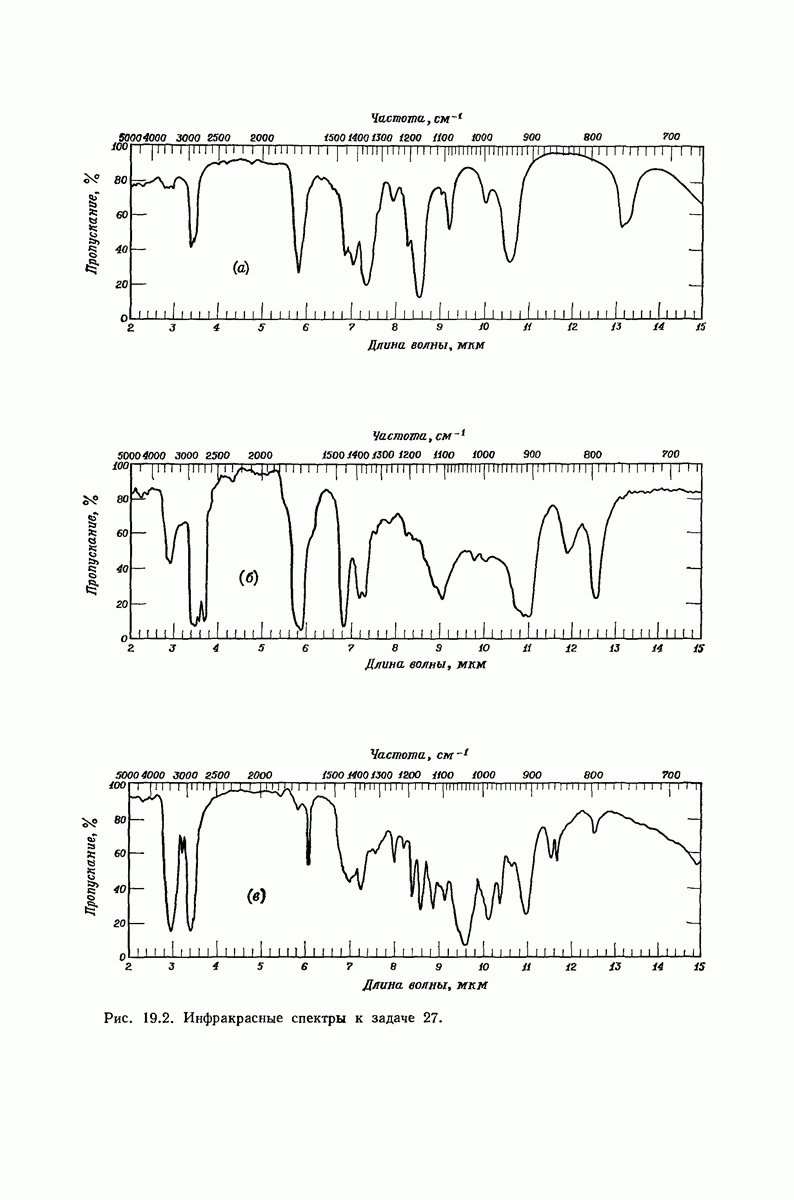
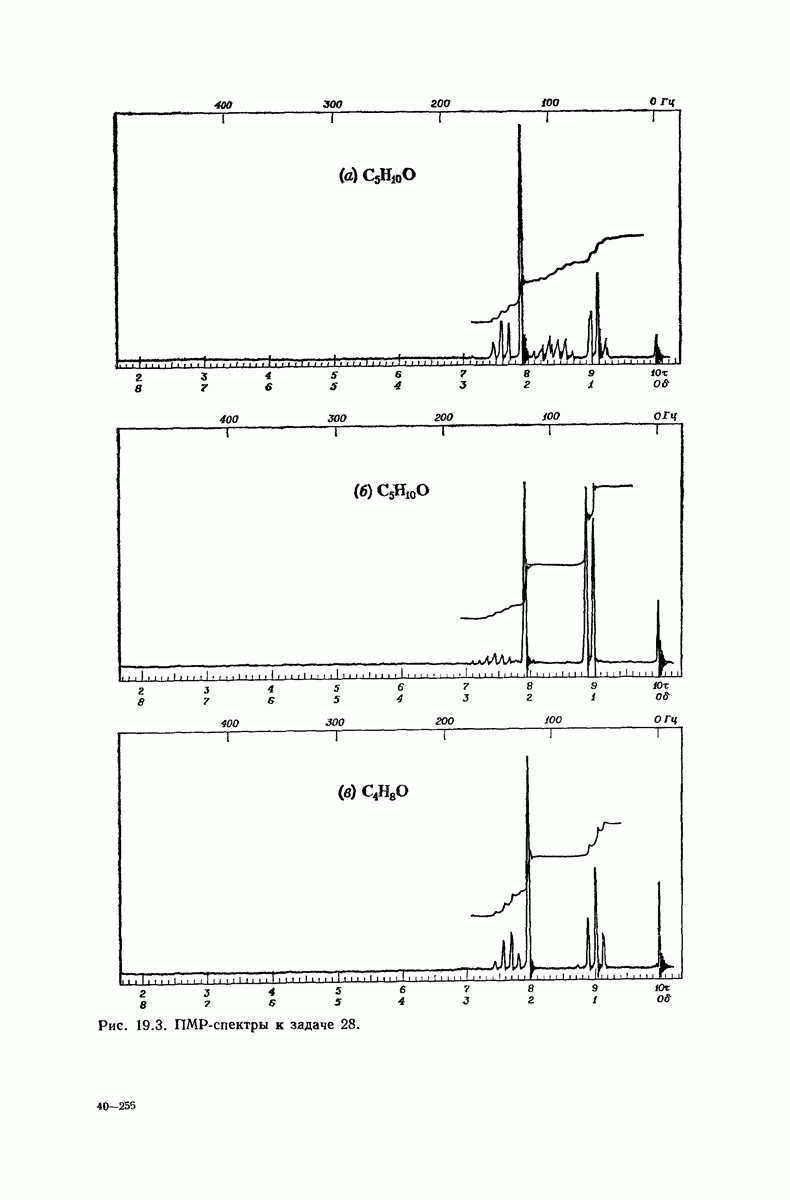
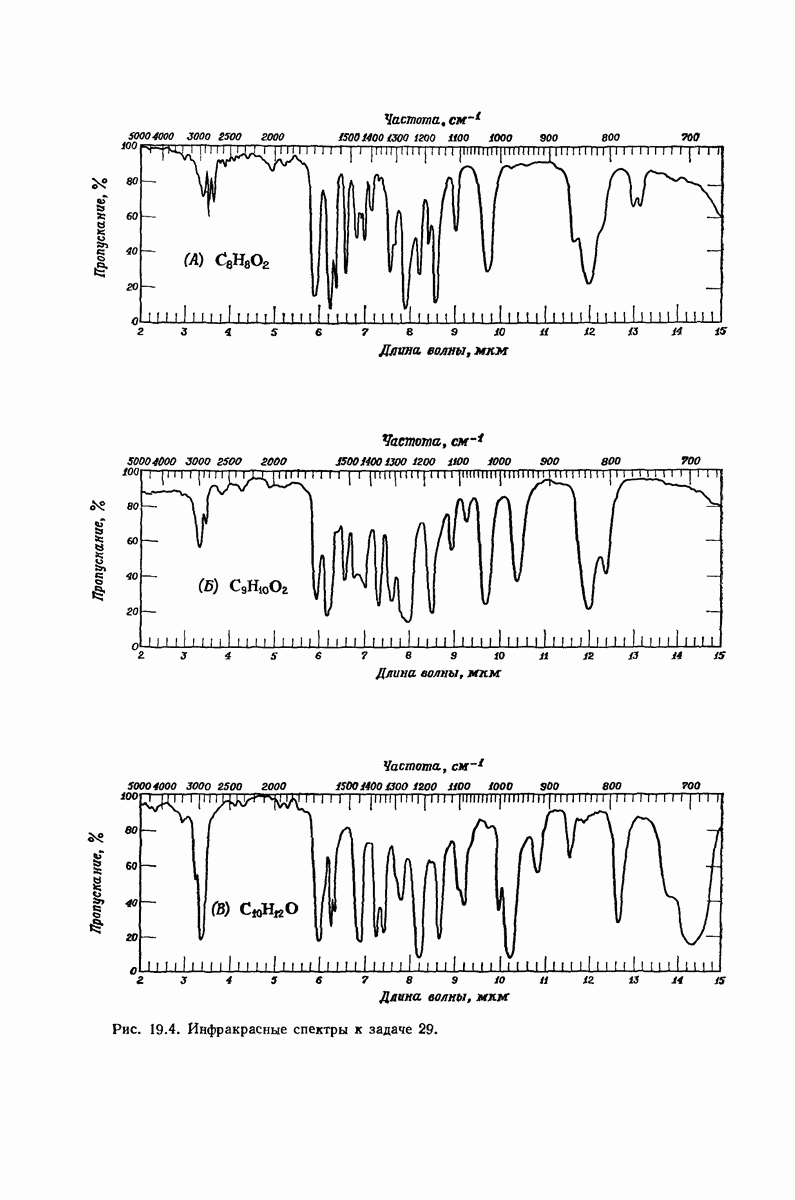
- 19.20. Спектроскопический анализ альдегидов и кетонов
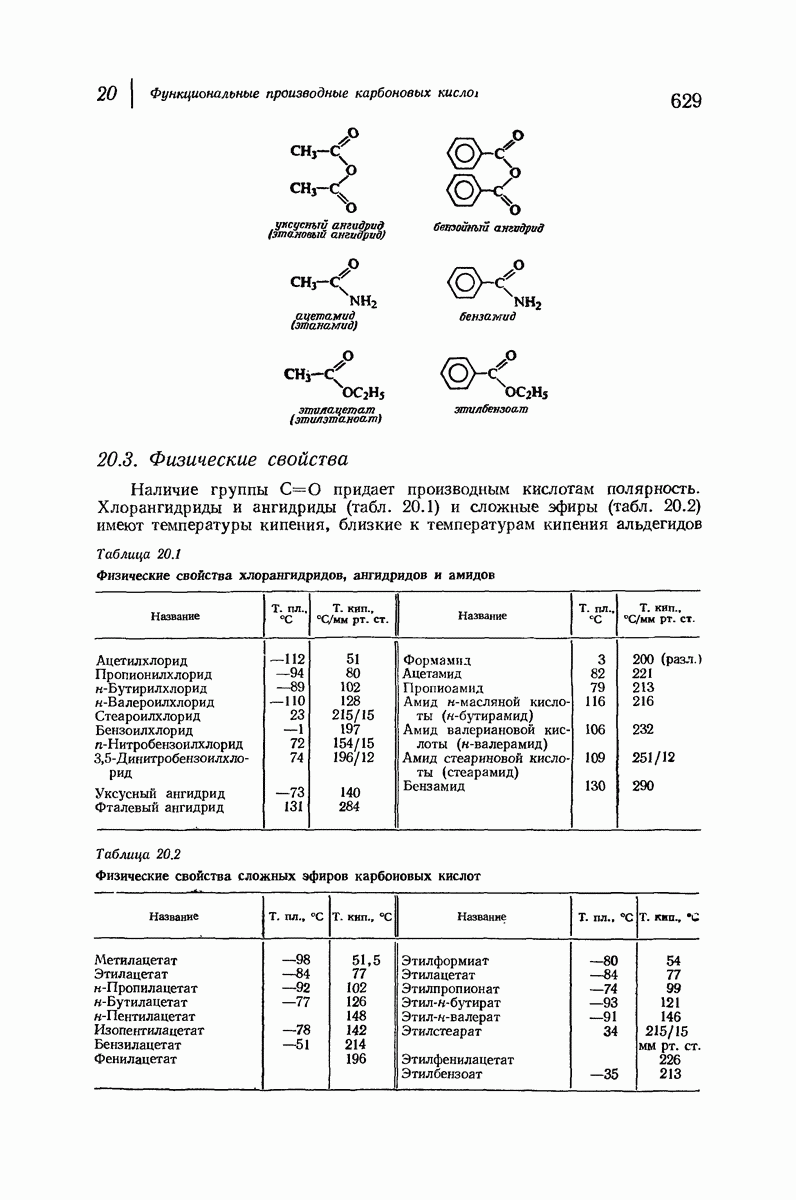
- 20. Функциональные производные карбоновых кислот. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АЦИЛЬНОИ ГРУППЕ
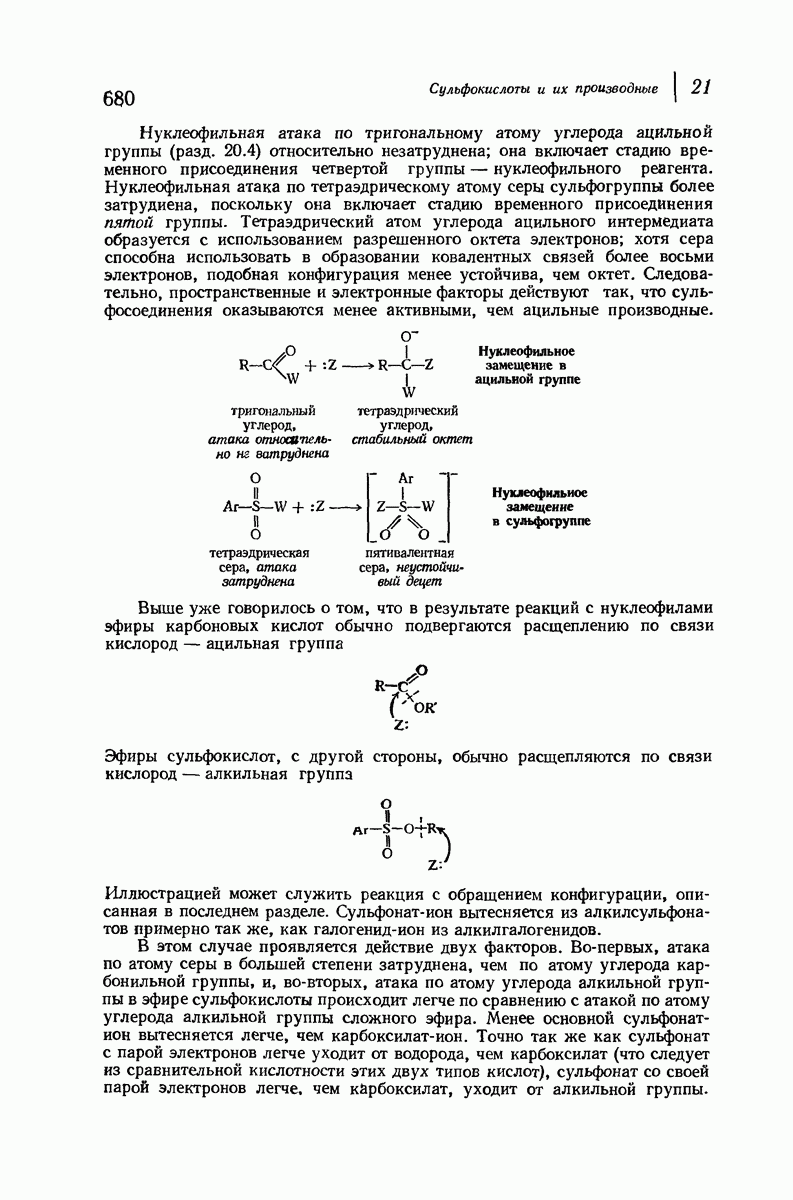
- 20.4. Нуклеофильное замещение в ацильной группе. Роль карбонильной группы
- 20.5. Нуклеофилъное замещение: сравнение алкильной и ацильной групп
- ХЛОРАНГИДРИДЫ
- 20.6. Получение хлорангидридов
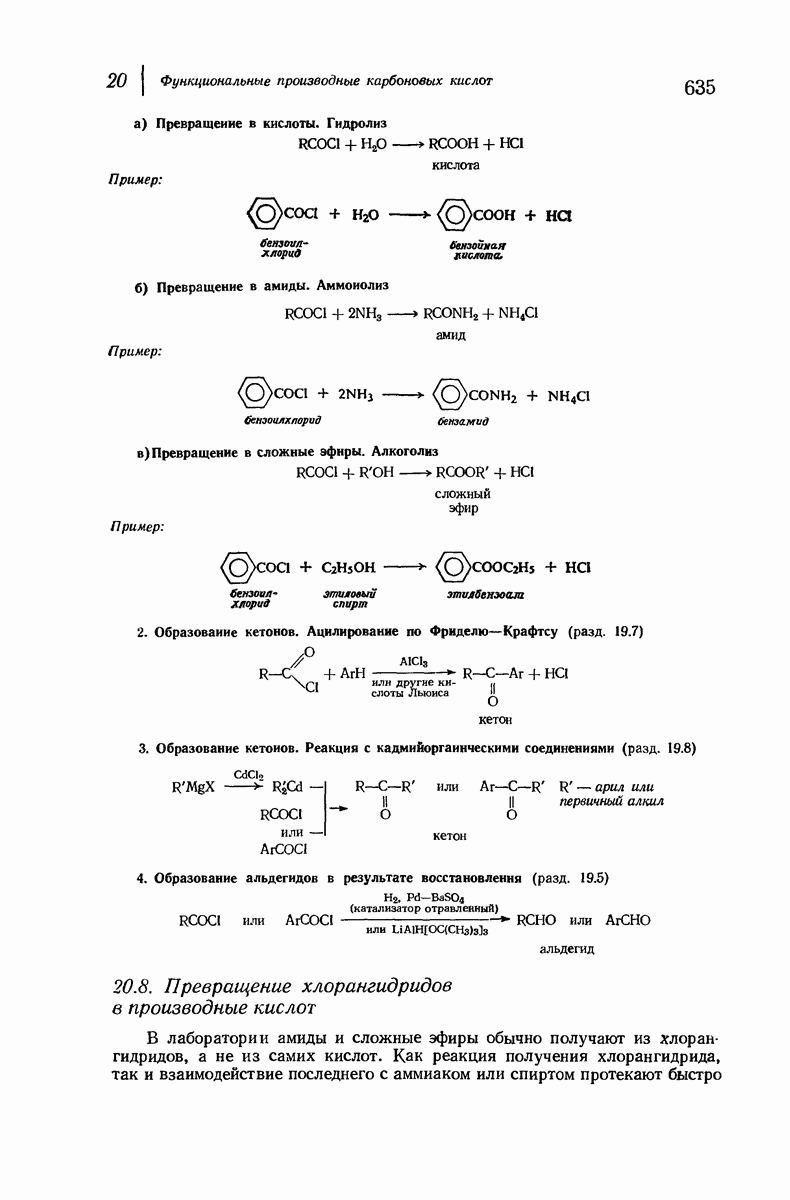
- 20.8. Превращение хлорангидридов в производные кислот
- АНГИДРИДЫ КИСЛОТ
- 20.9. Методы синтеза уксусного ангидрида
- 20.10. Реакции ангидридов кислот
- АМИДЫ
- СЛОЖНЫЕ ЭФИРЫ
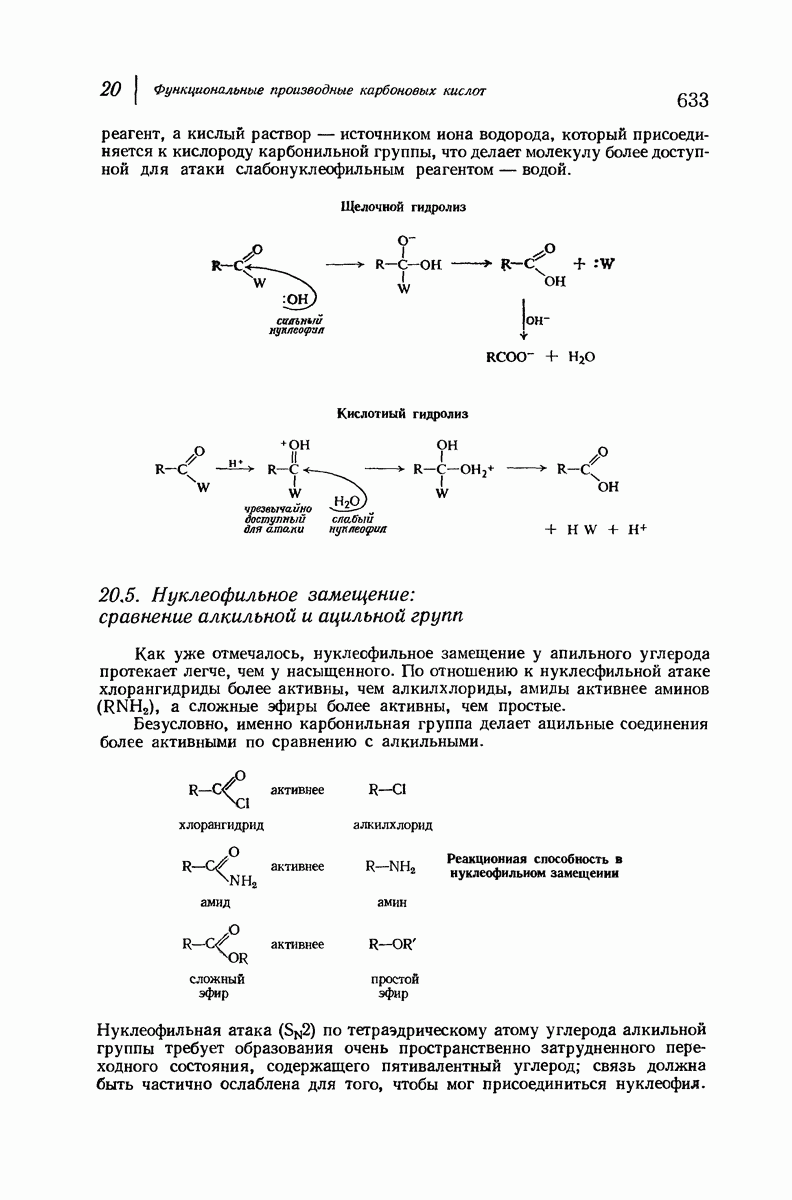
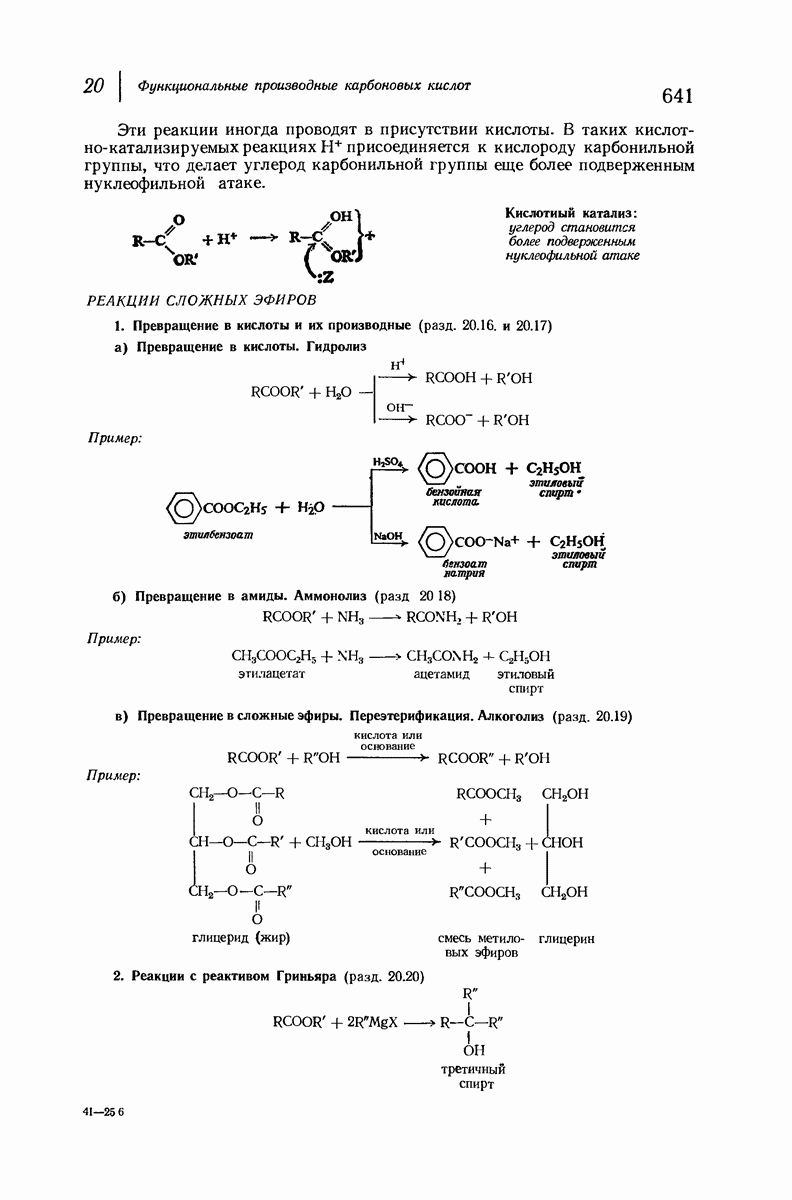
- 20.16. Щелочной гидролиз сложных эфиров
- 20.17. Кислотный гидролиз сложных эфиров
- 20.18. Аммонолиз сложных эфиров
- 20.19. Переэтерификация
- 20.20. Реакции сложных эфиров с реактивом Гриньяра
- 20.21. Восстановление сложных эфиров
- ЖИРЫ
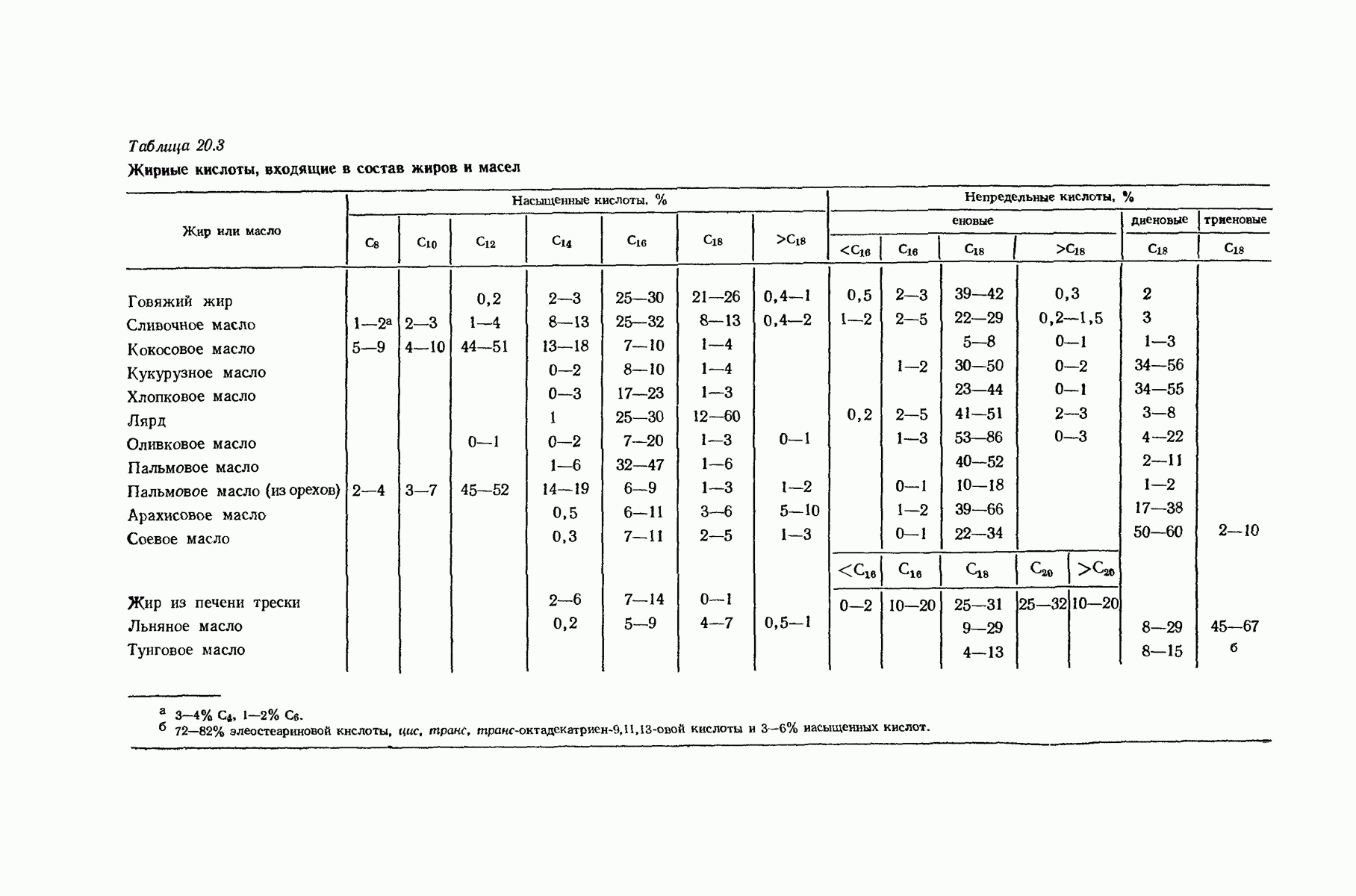
- 20.22. Нахождение жиров в природе и их состав
- 20.23. Гидролиз жиров. Омыление. Мыло
- 20.24. Жиры как источники чистых кислот и спиртов
- 20.25. Детергенты
- 20.26. Непредельные жиры. Отвердение жиров. Высыхающие масла
- 20.27. Анализ производных карбоновых кислот. Эквивалент омыления
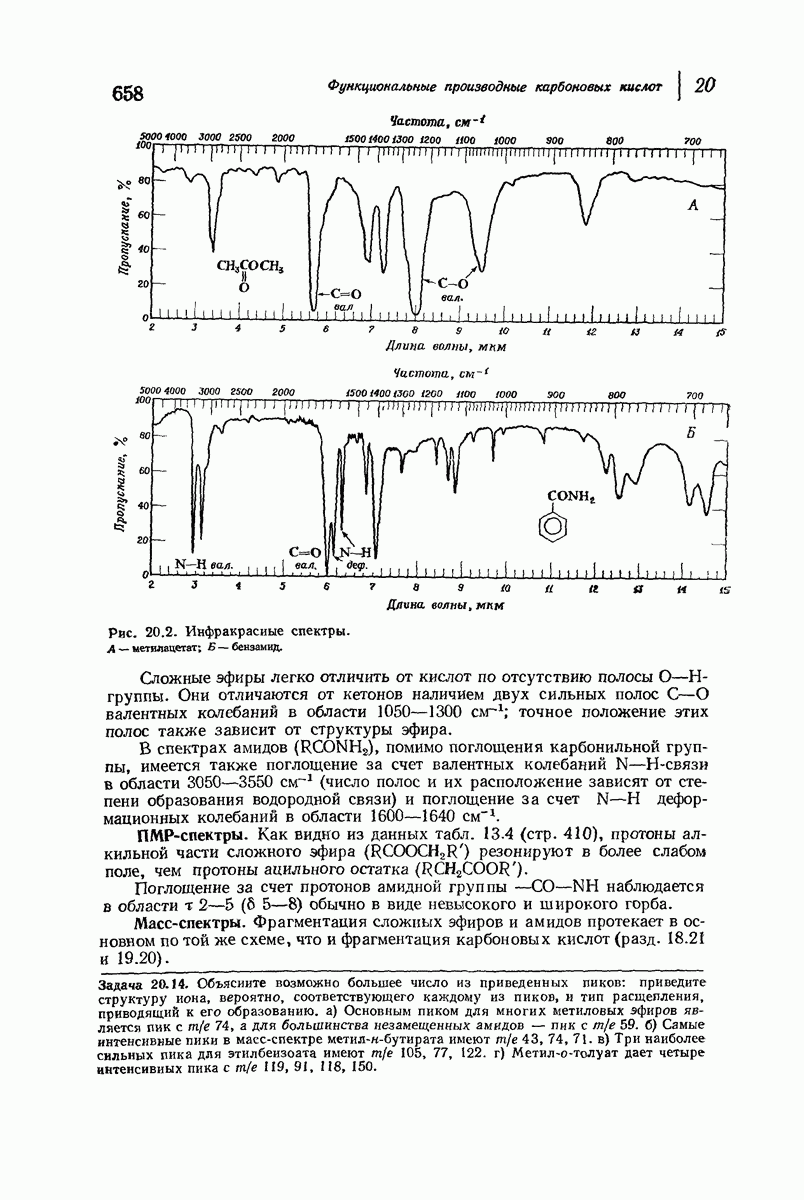
- 20.28. Спектральный анализ производных карбоновых кислот
- 21. Сульфокислоты и их производные
- 21.3. Методы синтеза сульфокислот
- 21.4. Реакции сульфокислот
- 21.5. Десульфирование
- 21.6. Сульфохлориды
- 21.7. Амиды сульфокислот
- 21.8. Эфиры сульфокислот
- 21.9. Стереохимическое обращение
- 21.10. Сравнение производных сульфокислот с производными карбоновых кислот
- 21.11. Анализ сульфокислот
- 21.12. Спектральный анализ сульфокислот
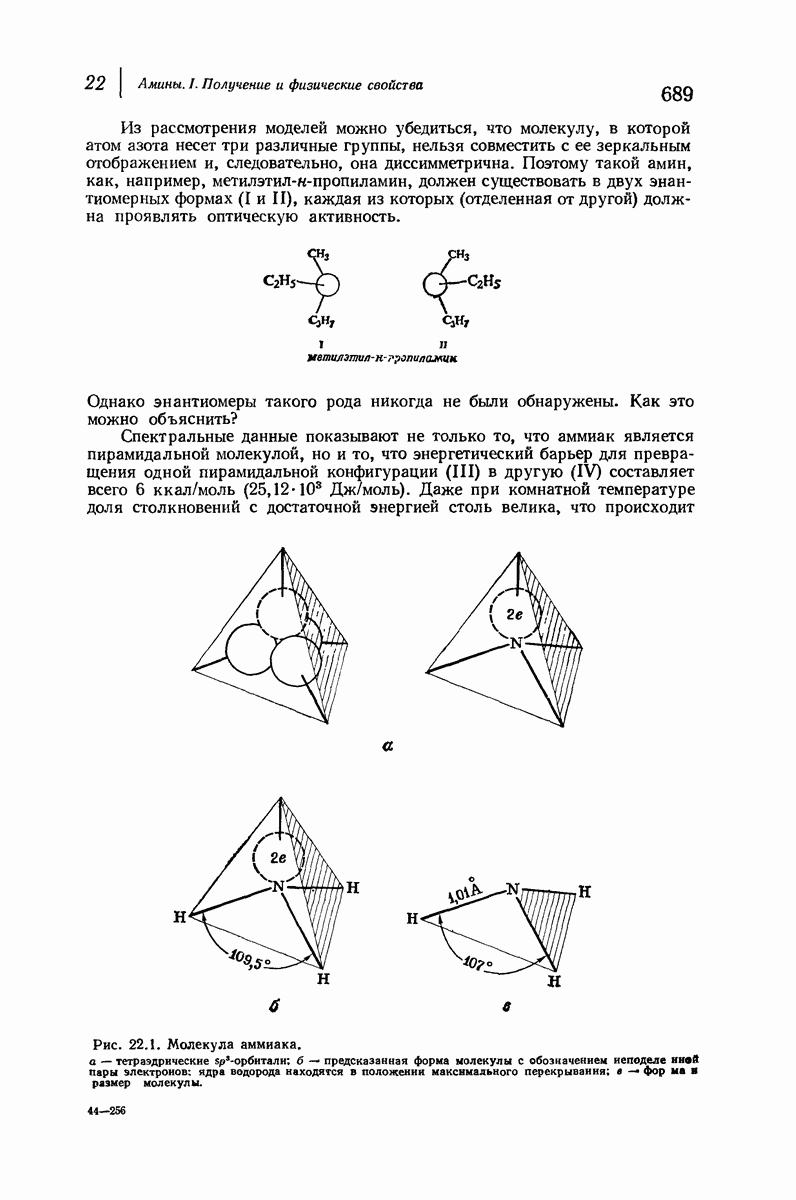
- 22. Амины. I. Получение и физические свойства
- 22.5. Соли аминов
- 22.6. Стереохимия азота
- 22.7. Промышленные источники аминов
- 22.8. Методы синтеза аминов
- 22.9. Восстановление нитросоединений
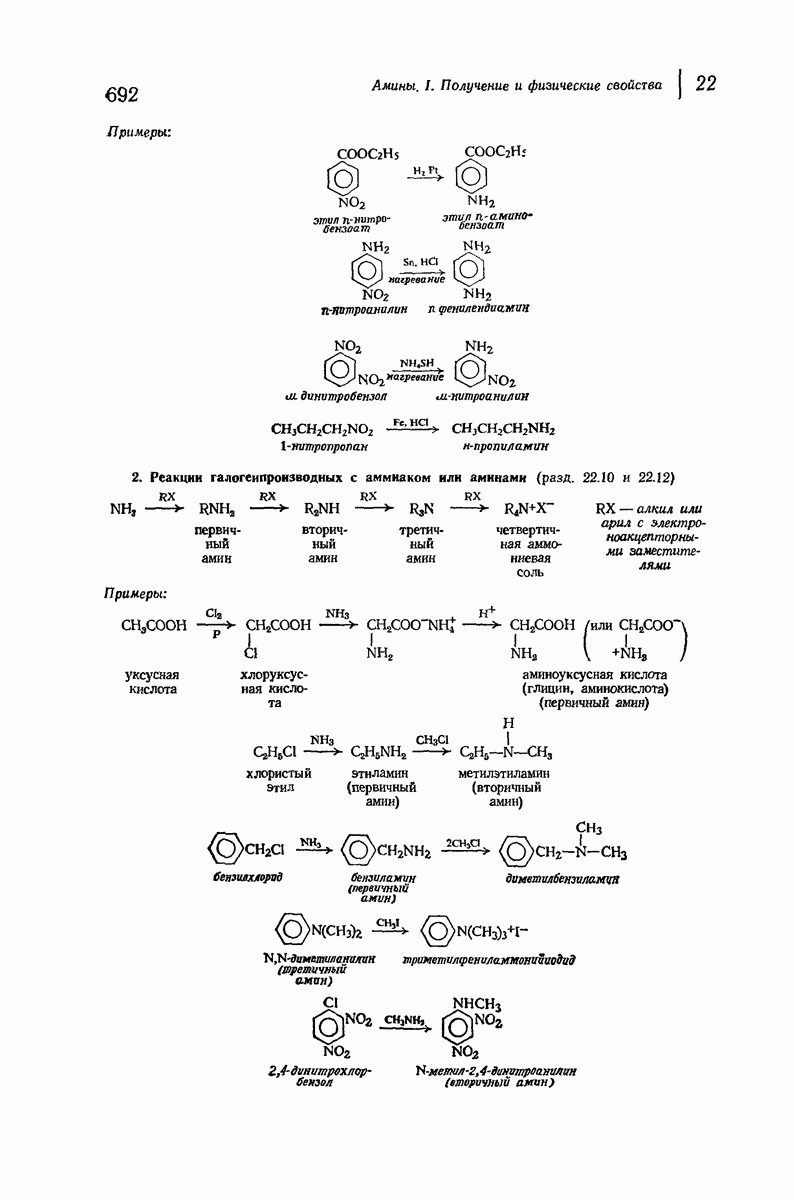
- 22.10. Аммонолиз галогенпроизводных
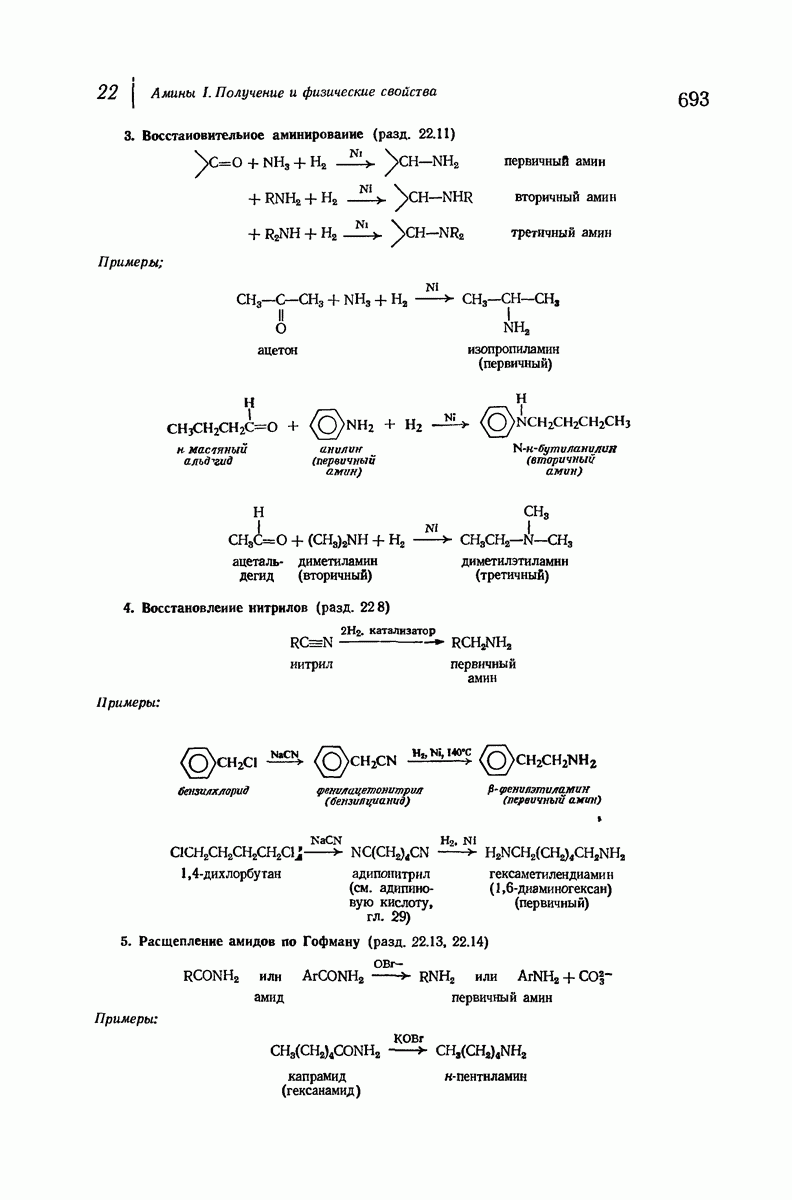
- 22.11. Восстановительное аминирование
- 22.12. Методы синтеза вторичных и третичных аминов
- 22.13. Расщепление амидов по Гофману
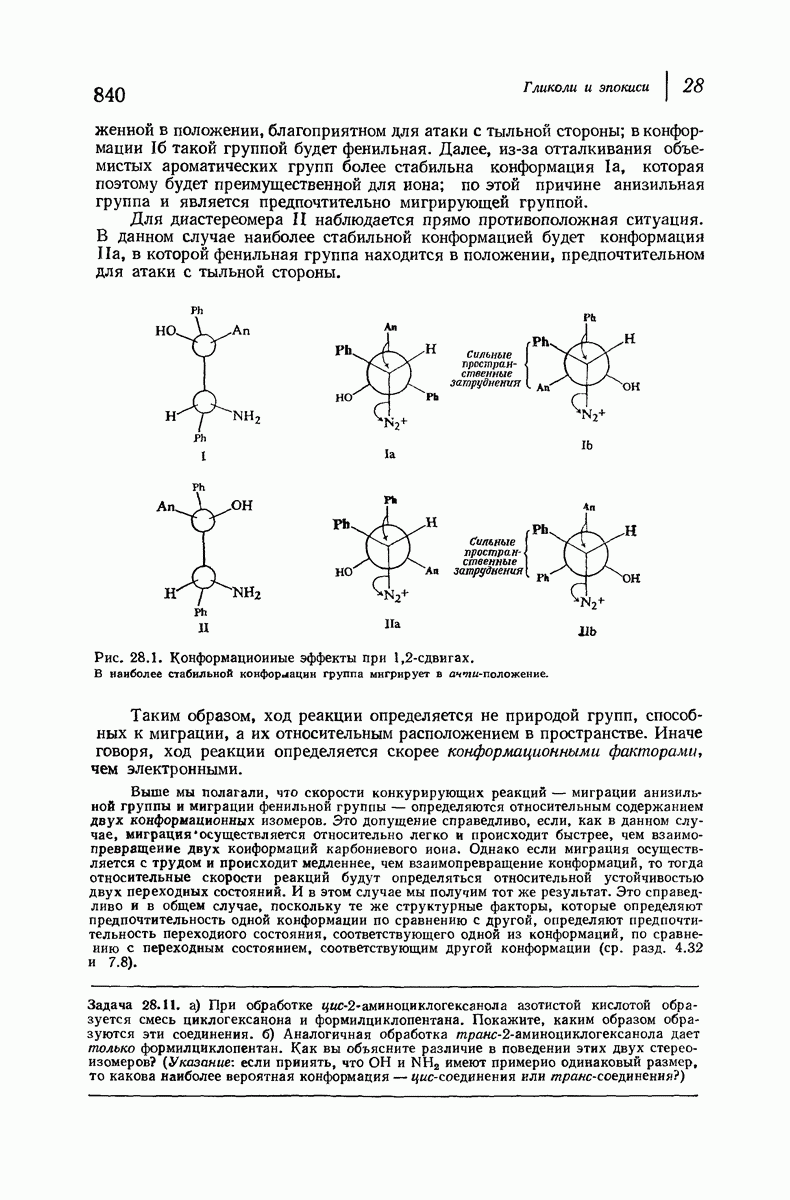
- 22.14. Стереохимия 1,2-сдвигов. Мигрирующая группа
- 22.15. Миграция арилъных групп
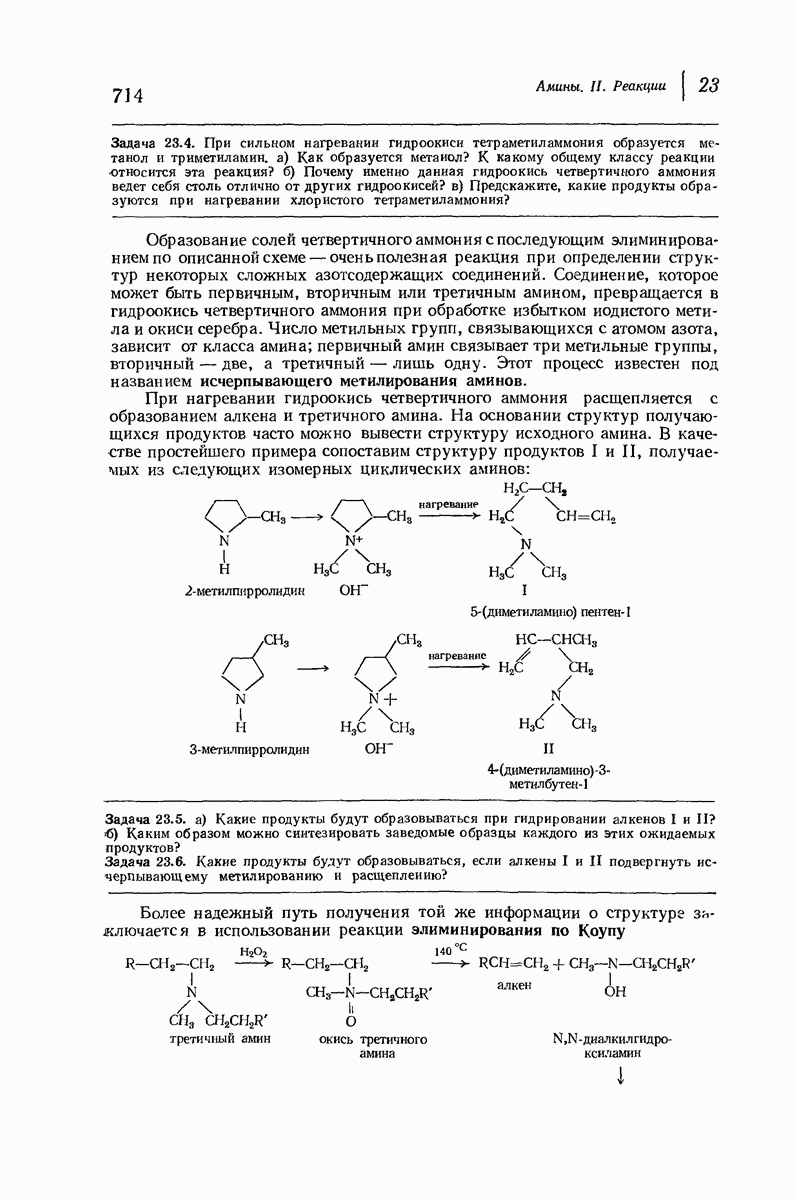
- 23. Амины. II. Реакции
- 23.2. Основность аминов. Константа основности
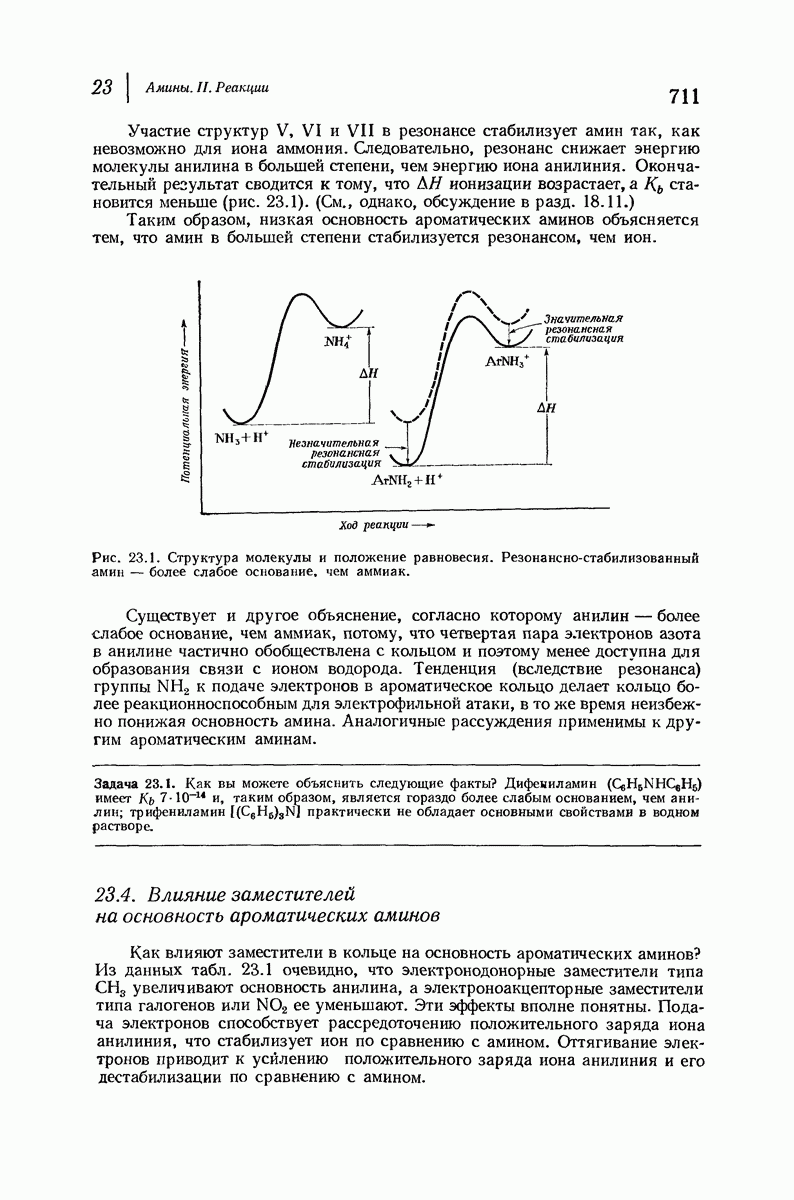
- 23.3. Структура и основность
- 23.4. Влияние заместителей на основность ароматических аминов
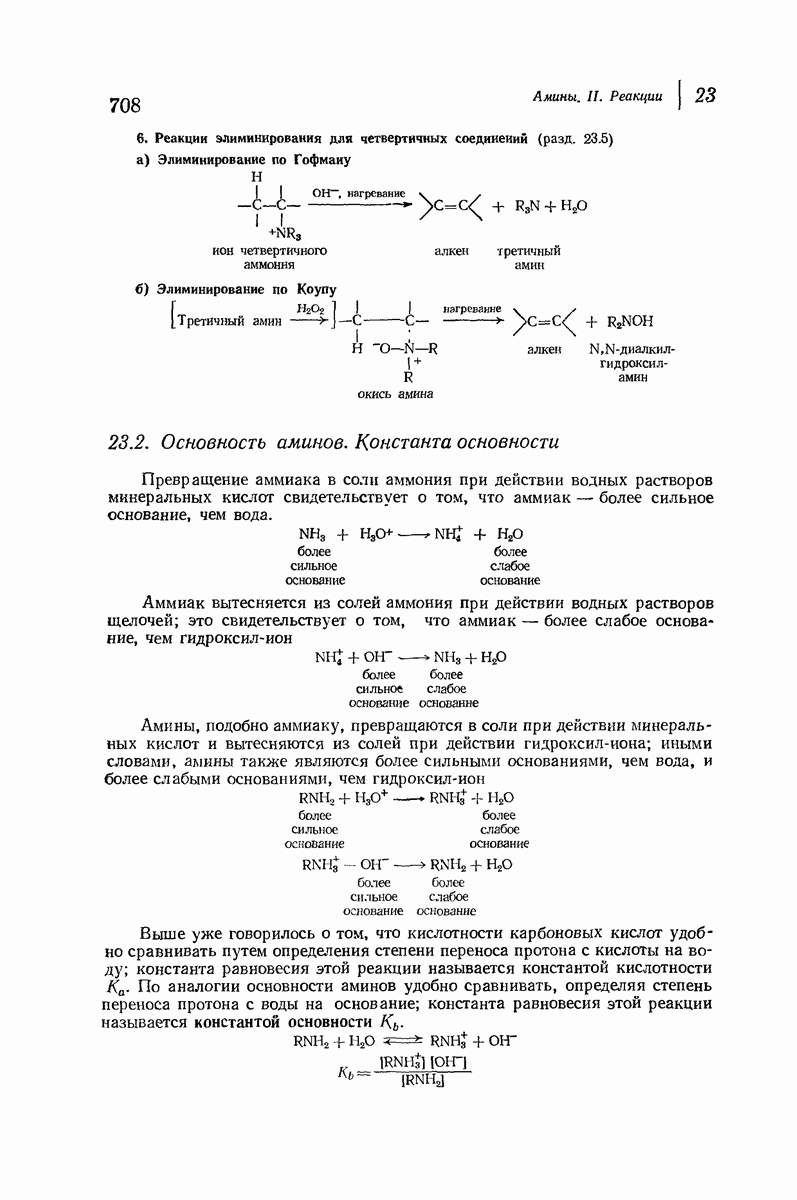
- 23.5. Соли четвертичного аммония. Исчерпывающее метилирование. Элиминирование по Гофману
- 23.6. Превращение аминов в замещенные амиды
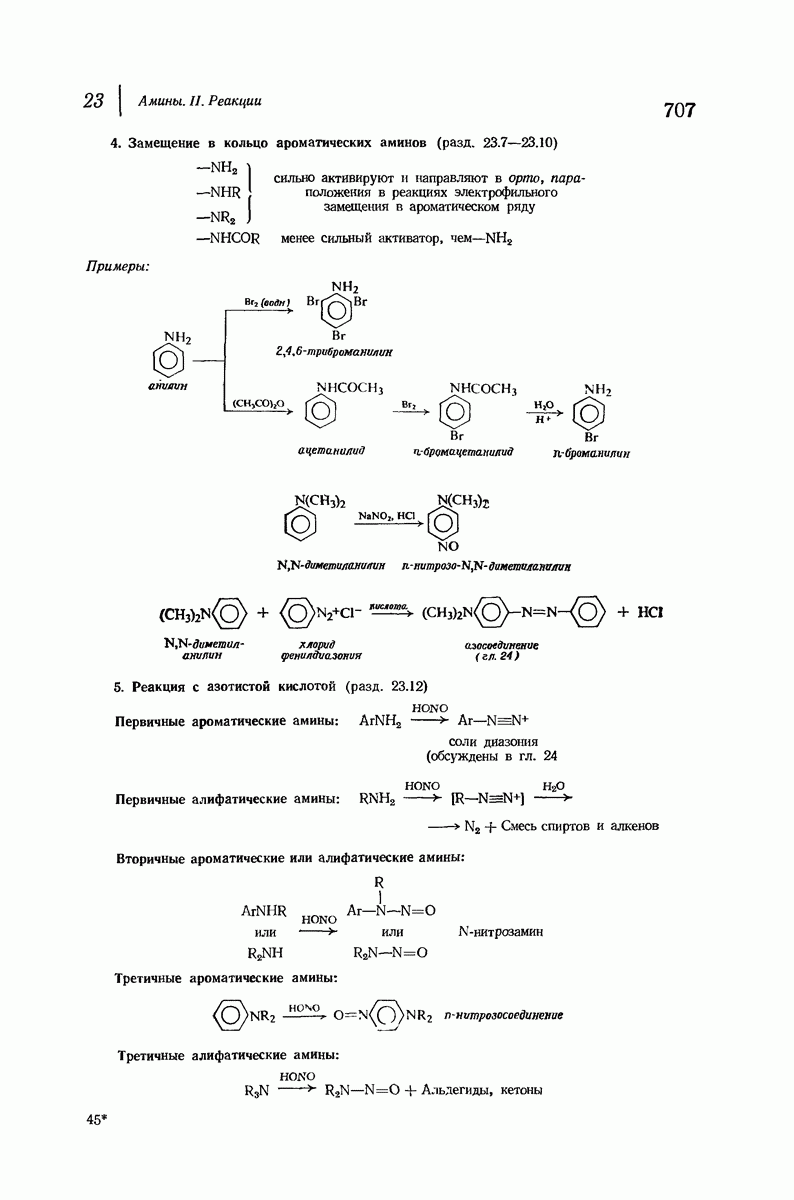
- 23.7. Замещение в кольцо ароматических аминов
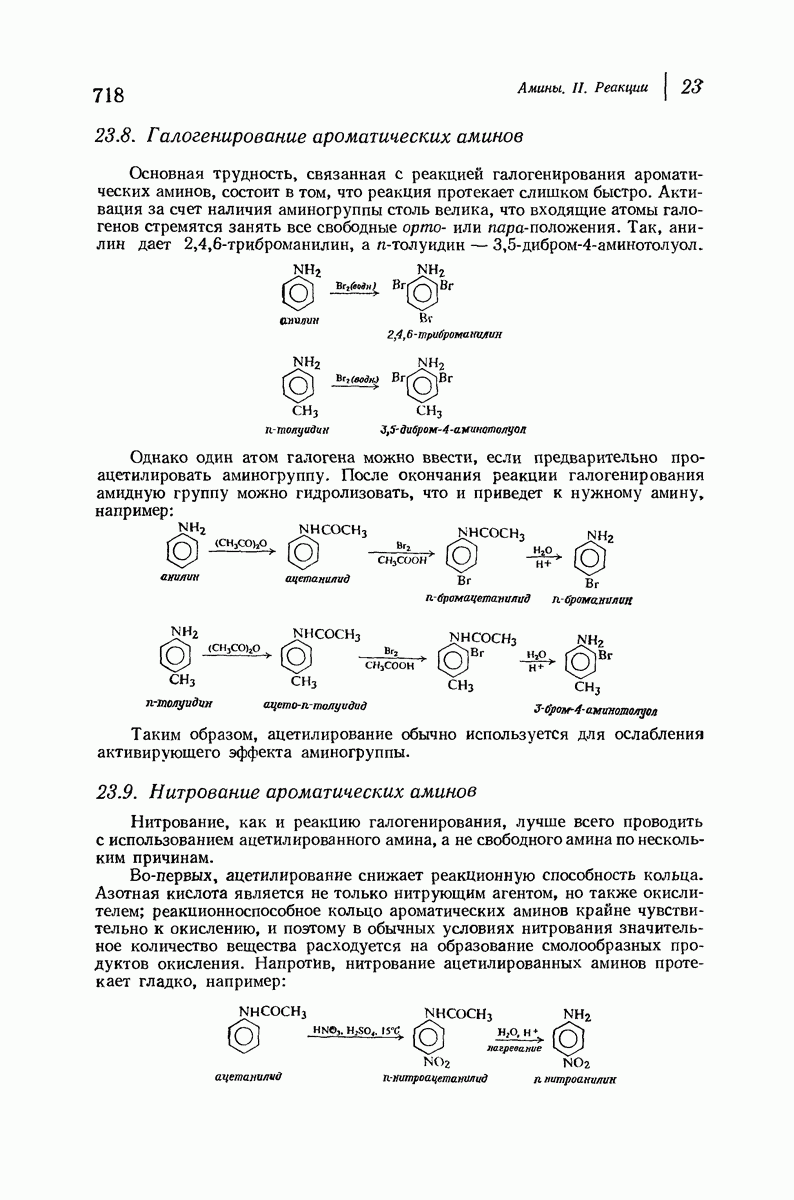
- 23.8. Галогенирование ароматических аминов
- 23.10. Сульфирование ароматических аминов. Диполярные ионы
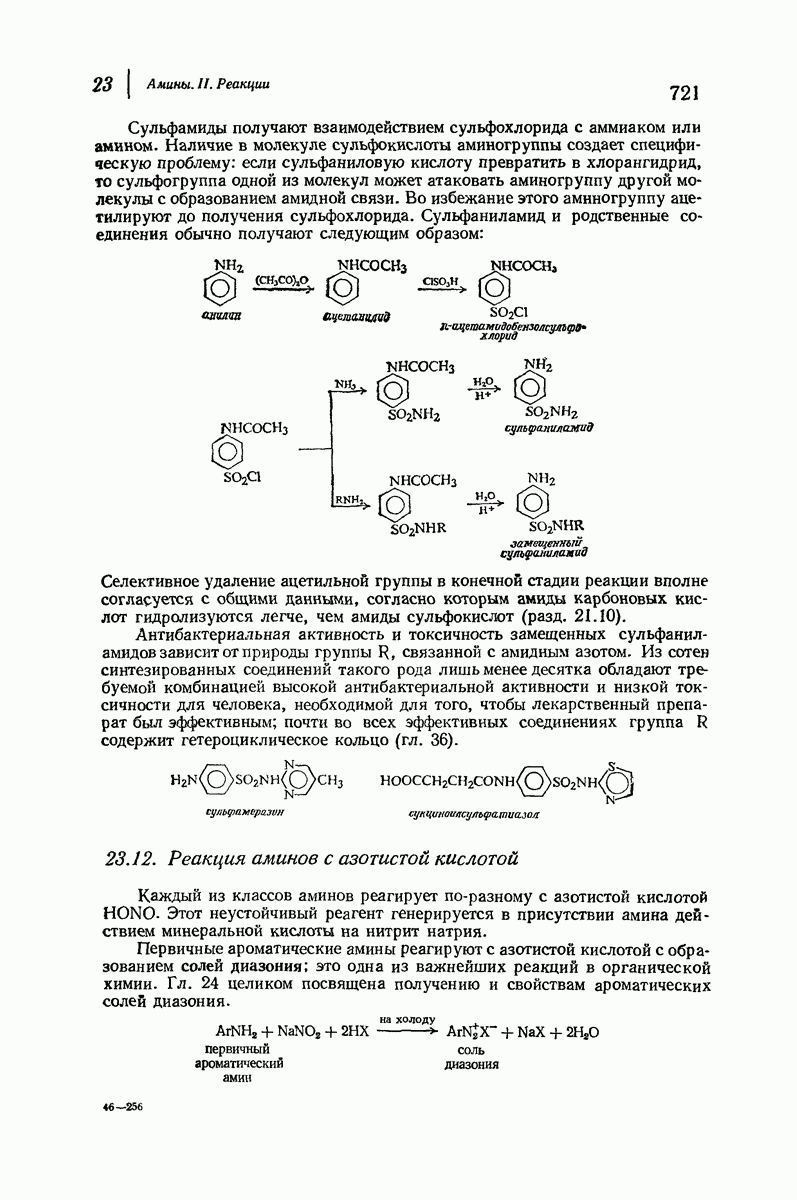
- 23.11. Сульфамиды. Сульфамидные препараты
- 23.12. Реакция аминов с азотистой кислотой
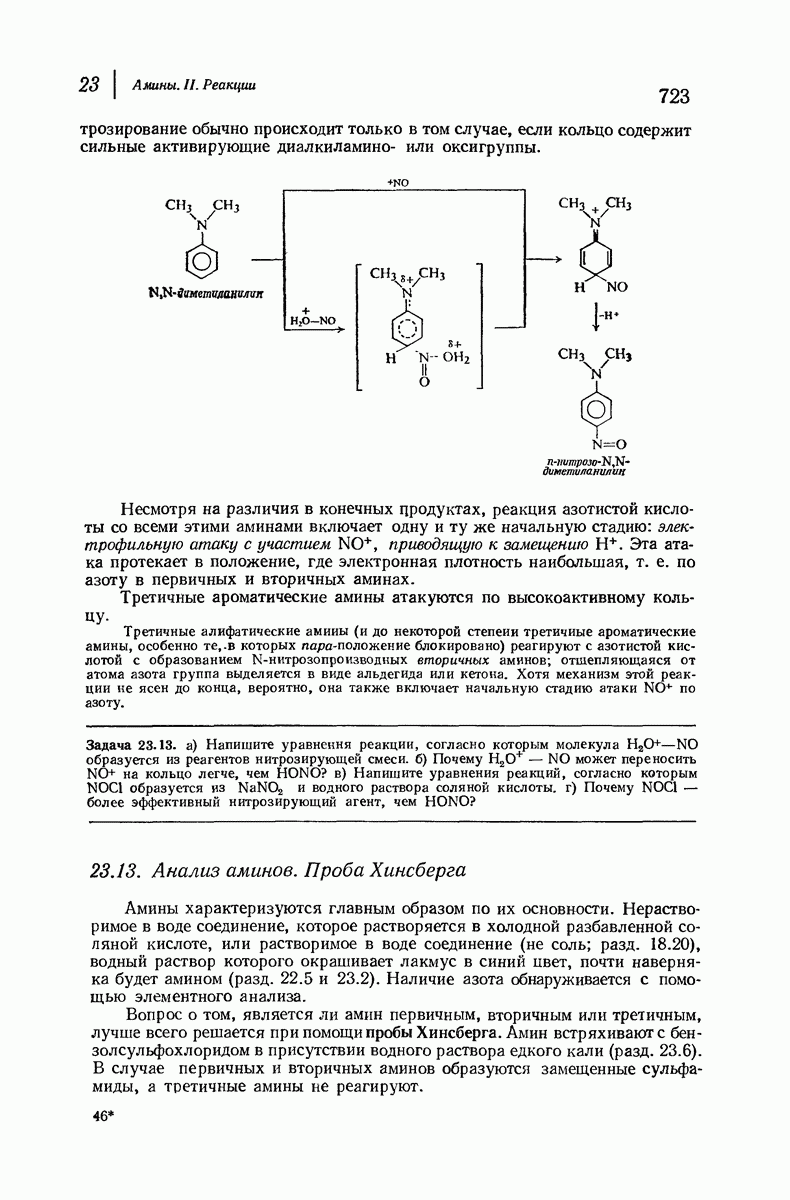
- 23.13. Анализ аминов. Проба Хинсберга
- 23.14. Анализ замещенных амидов
- 23.15. Спектральный анализ аминов и замещенных амидов
- 24. Соли диазония
- 24.5. Замещение на галоген. Реакция Зандмейера
- 24.6. Замещение на CN. Синтез карбоновых кислот
- 24.7. Замещение на OH. Синтез фенолов
- 24.8. Замещение на Н
- 24.9. Синтезы с использованием солей диазония
- 24.10. Реакция сочетания. Синтез азосоединений
- 24.11. Азосоединения
- 24.12. Гидразосоединения. Бензидиновая перегруппировка
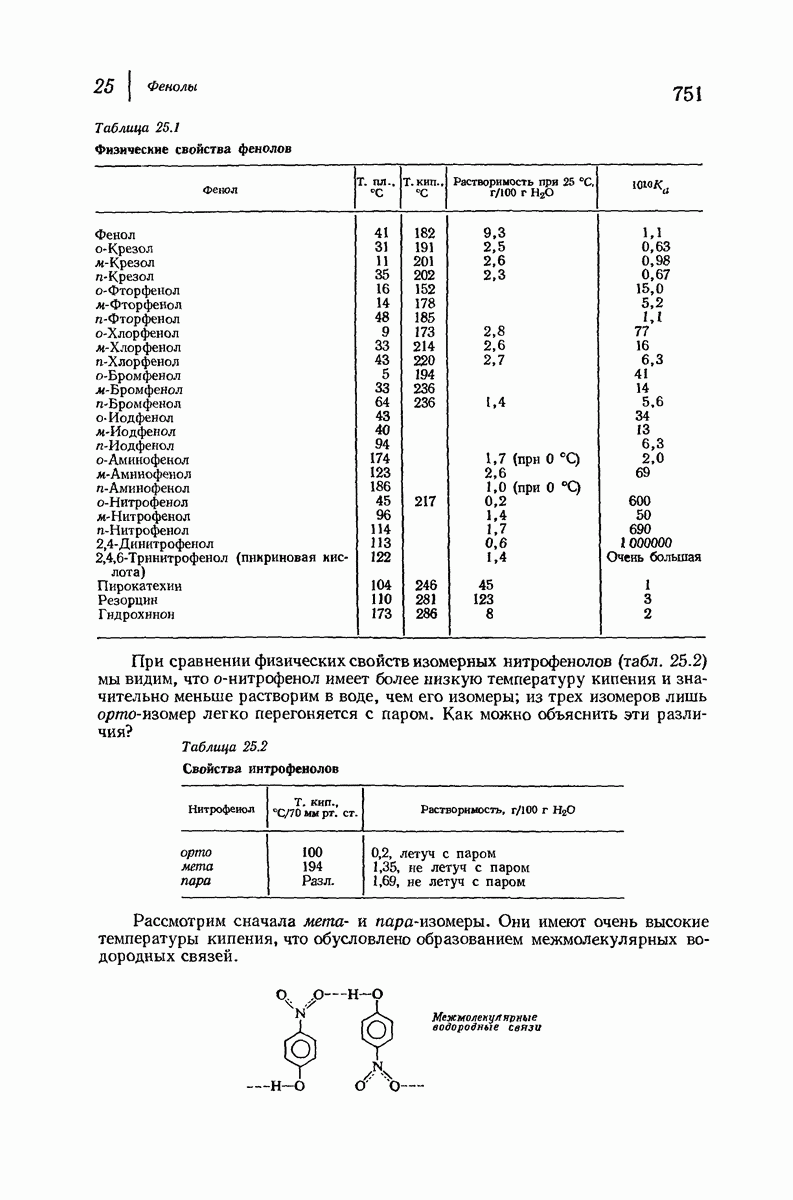
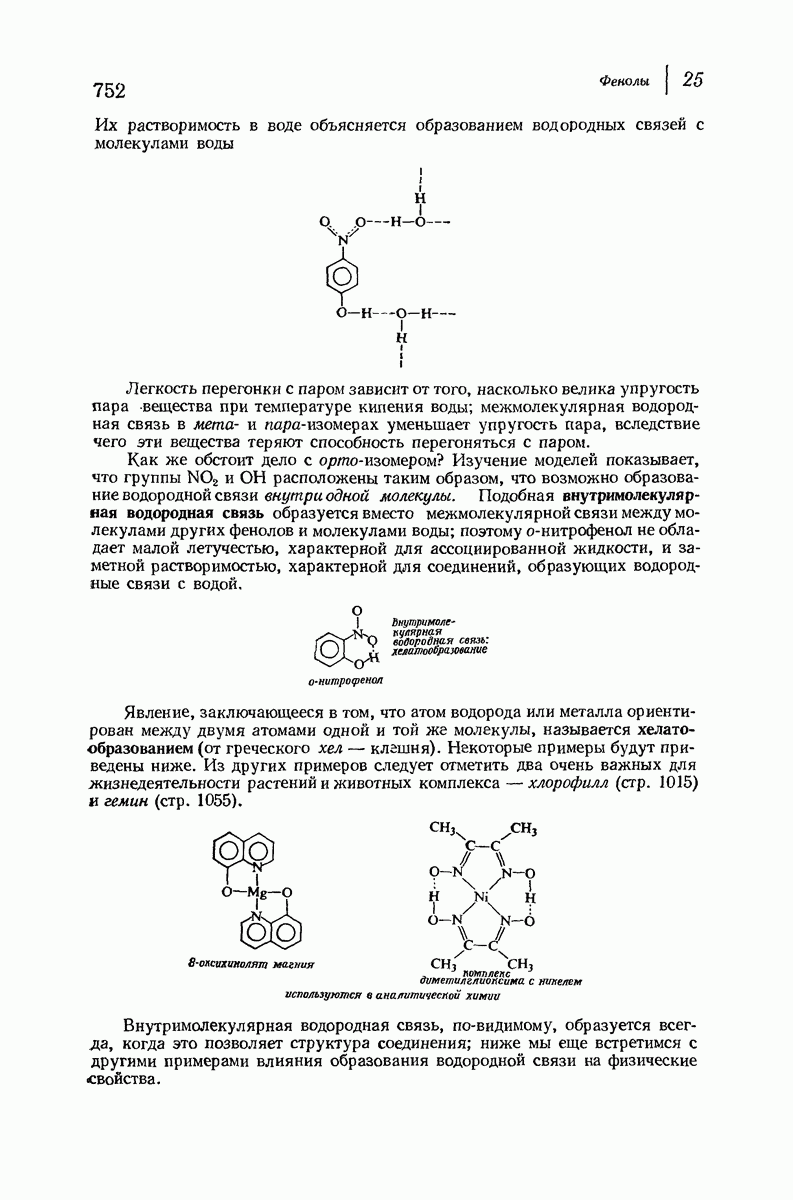
- 25. Фенолы
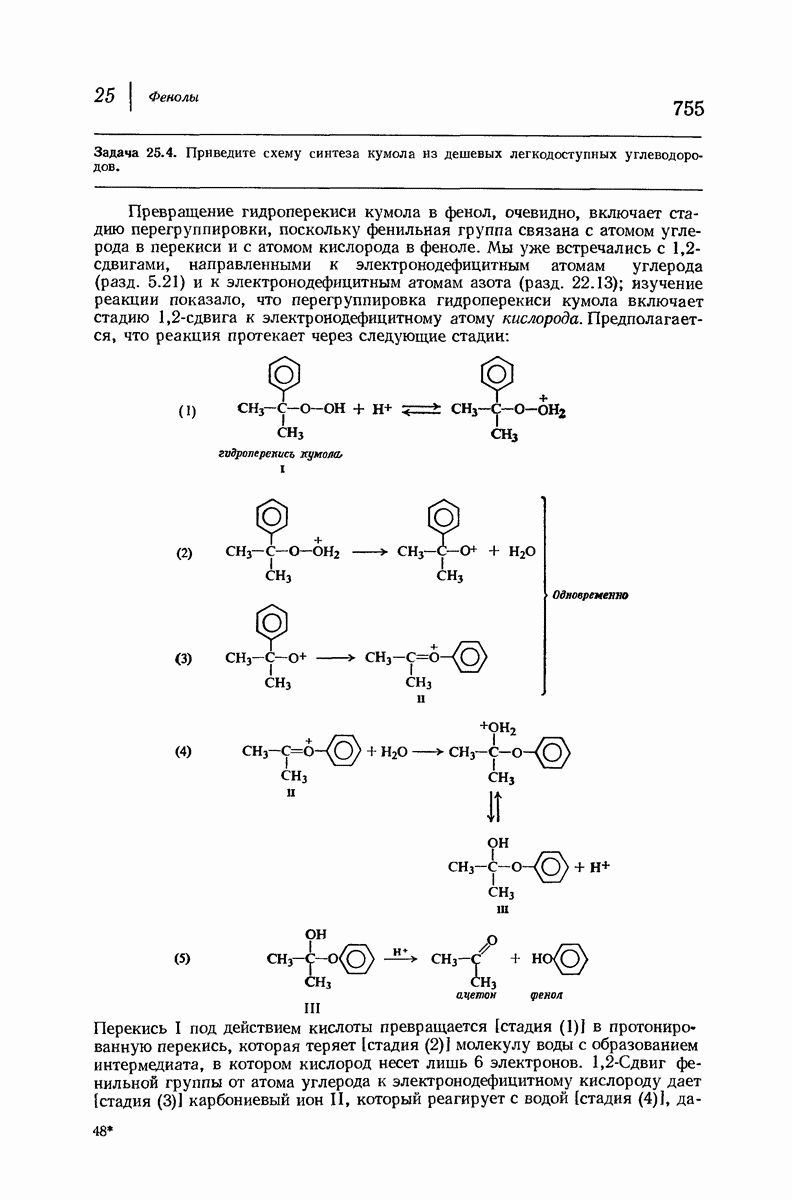
- 25.5. Фенол из гидроперекиси кумола. Миграция к электронодефицитному атому кислорода
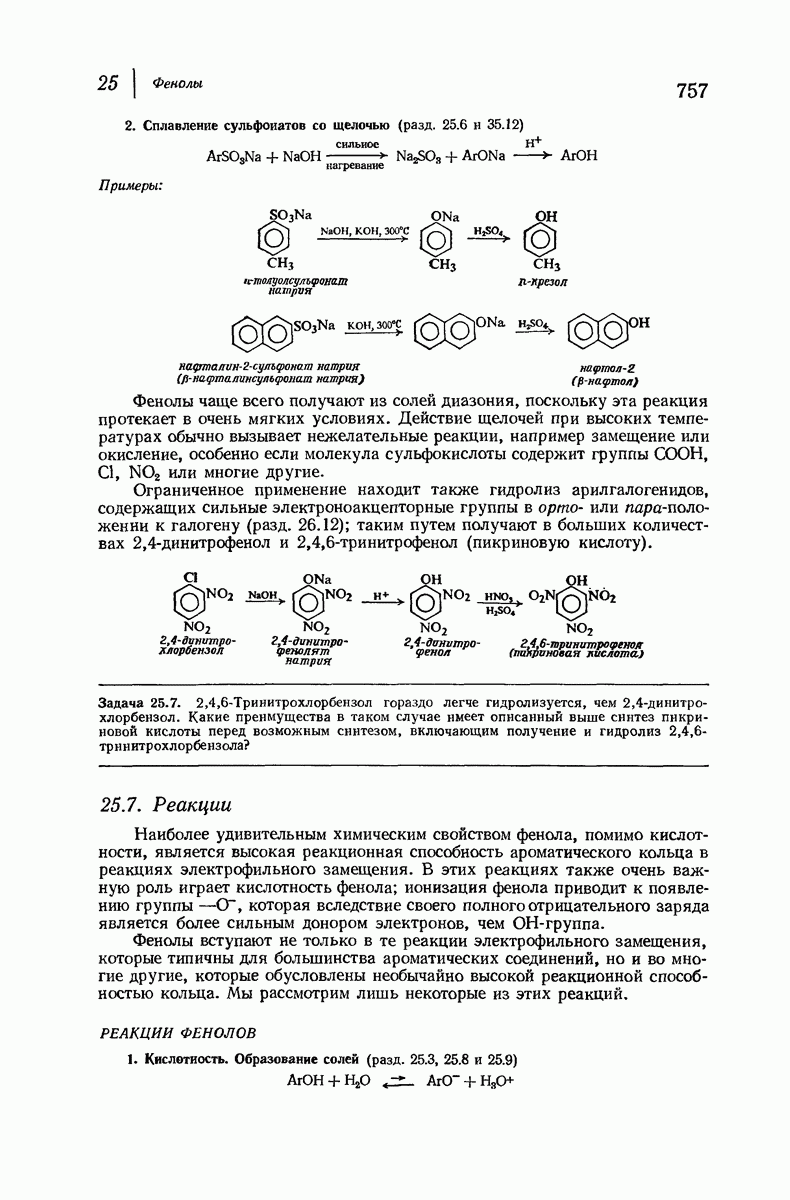
- 25.6. Методы синтеза фенолов
- 25.7. Реакции фенолов
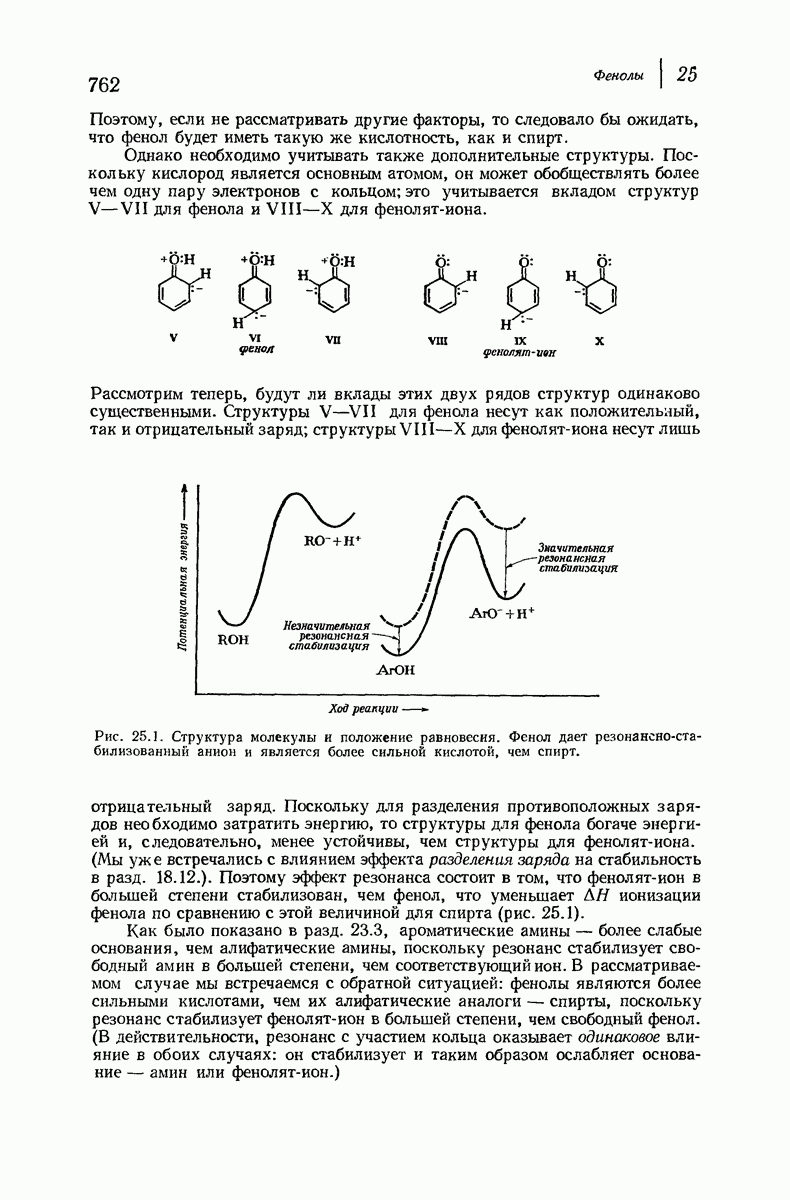
- 25.8. Кислотность фенолов
- 25.9. Влияние заместителей на кислотность
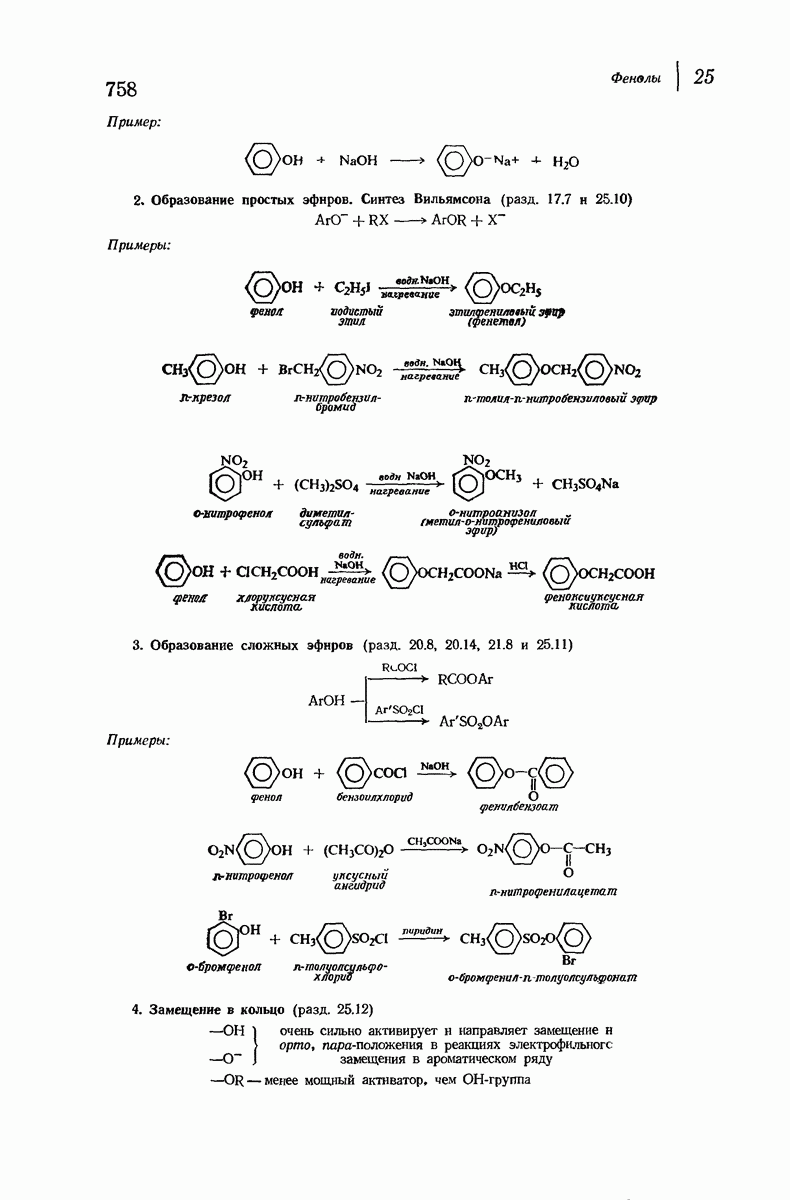
- 25.10. Образование простых эфиров. Синтез Вильямсона
- 25.11. Образование сложных эфиров. Перегруппировка Фриса
- 25.12. Замещение в кольцо
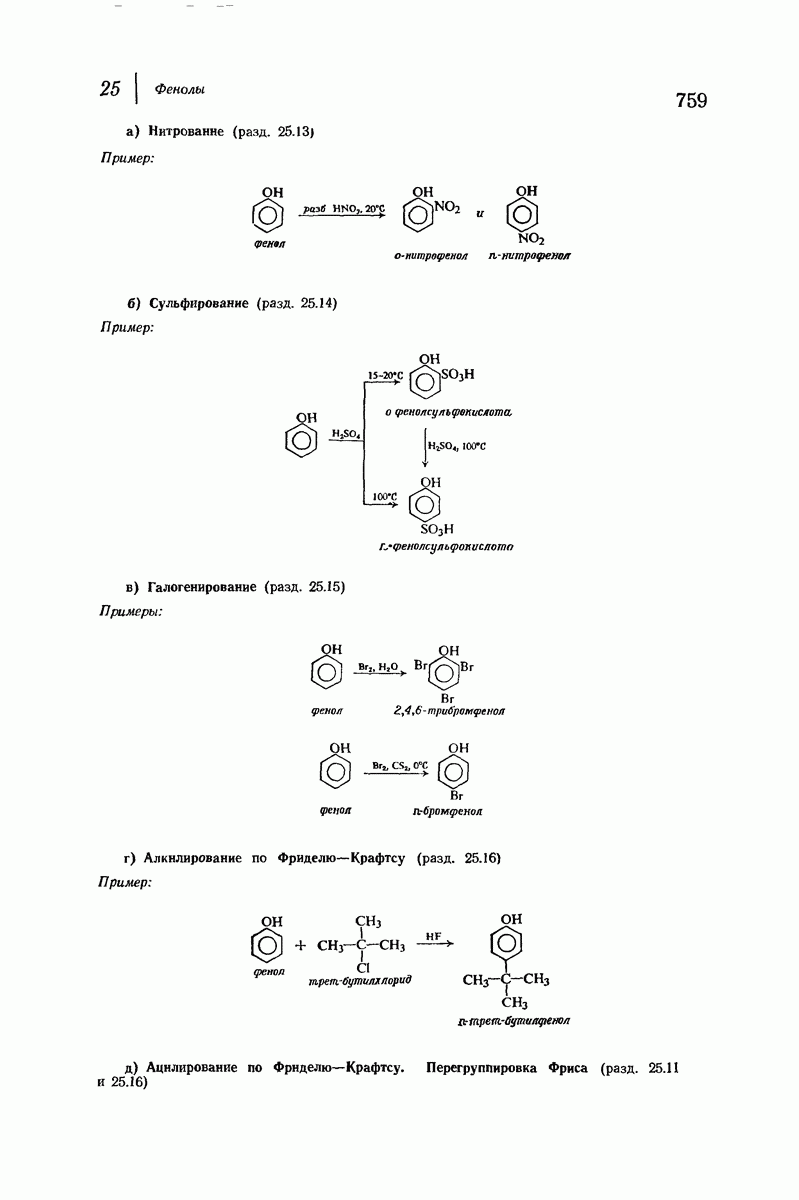
- 25.13. Нитрование фенолов
- 25.14. Сульфирование фенолов
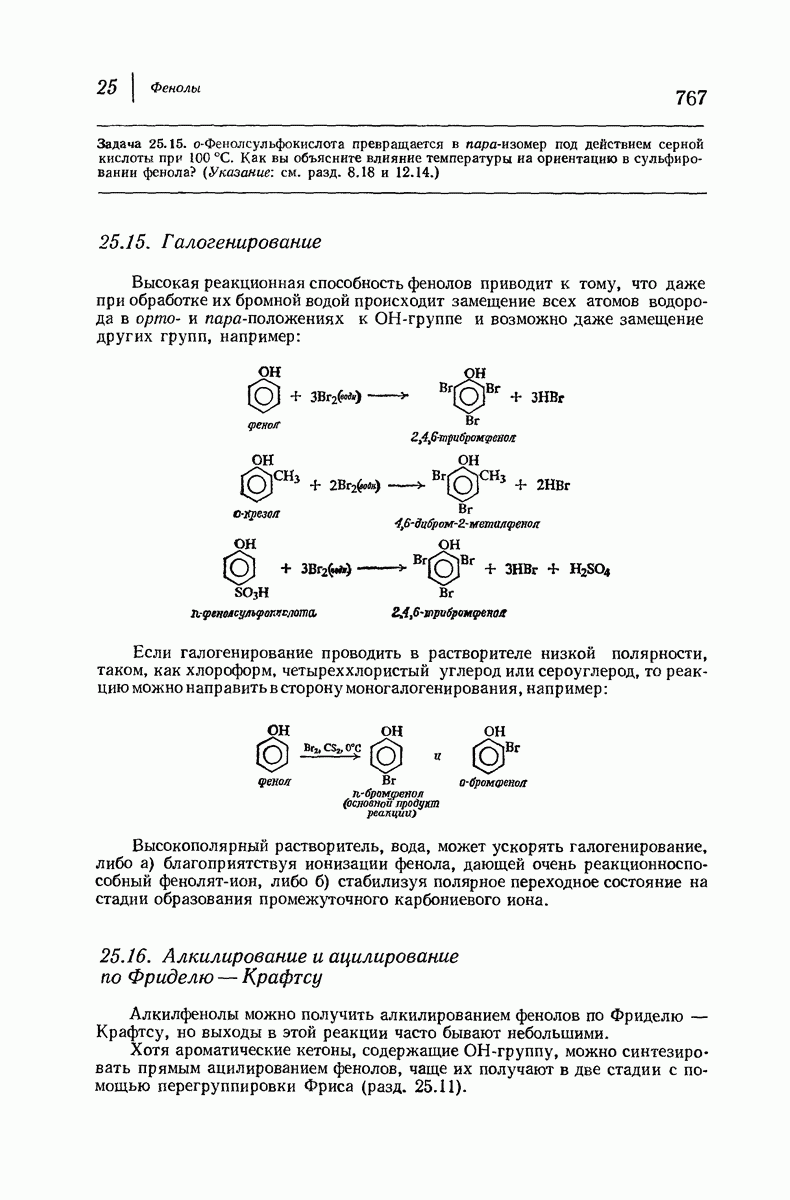
- 25.15. Галогенирование фенолов
- 25.16. Алкилирование и ацилирование по Фриделю — Крафтсу
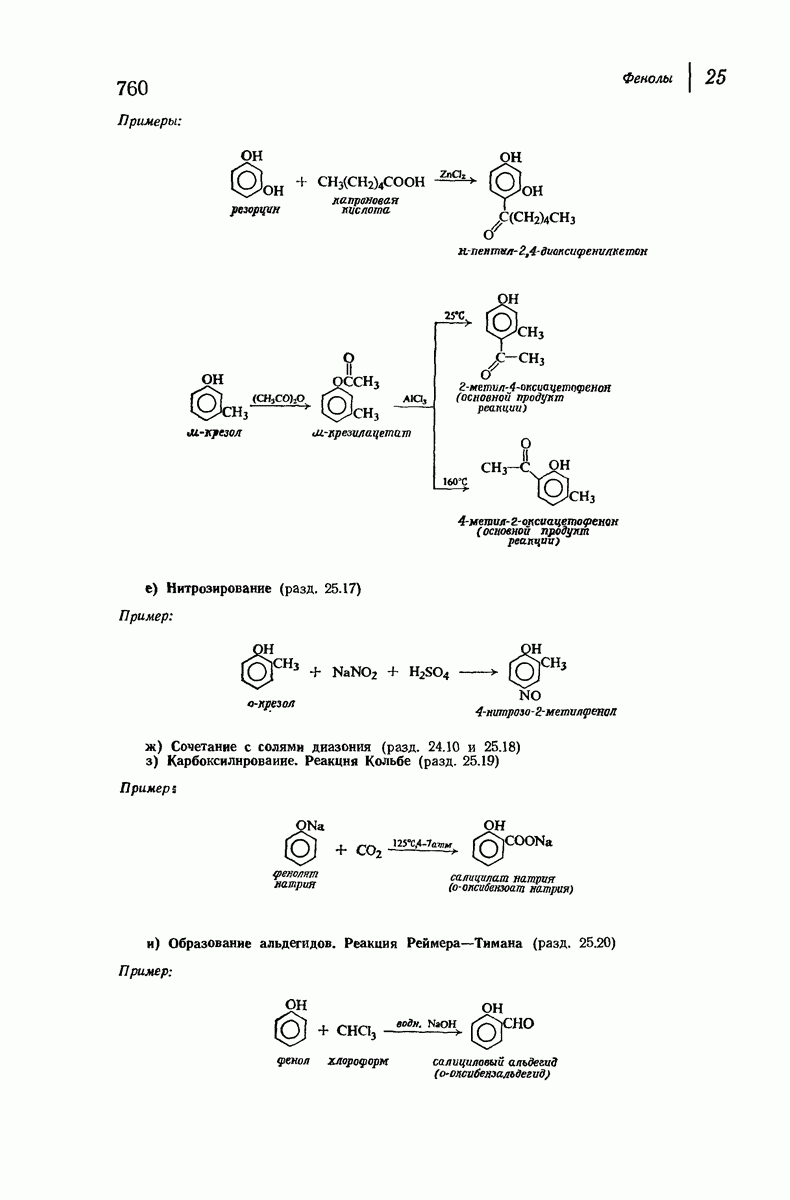
- 25.17. Нитрозирование
- 25.18. Сочетание с солями диазония
- 25.19. Реакция Кольбе. Синтез фенолкарбоновых кислот
- 25.20. Реакция Реймера — Тимана. Синтез ароматических альдегидов, содержащих ОН-группу. Дихлорметилен
- 25.21. Реакция с формальдегидом. Фенолформальдегидные смолы
- 25.22. Анализ фенолов
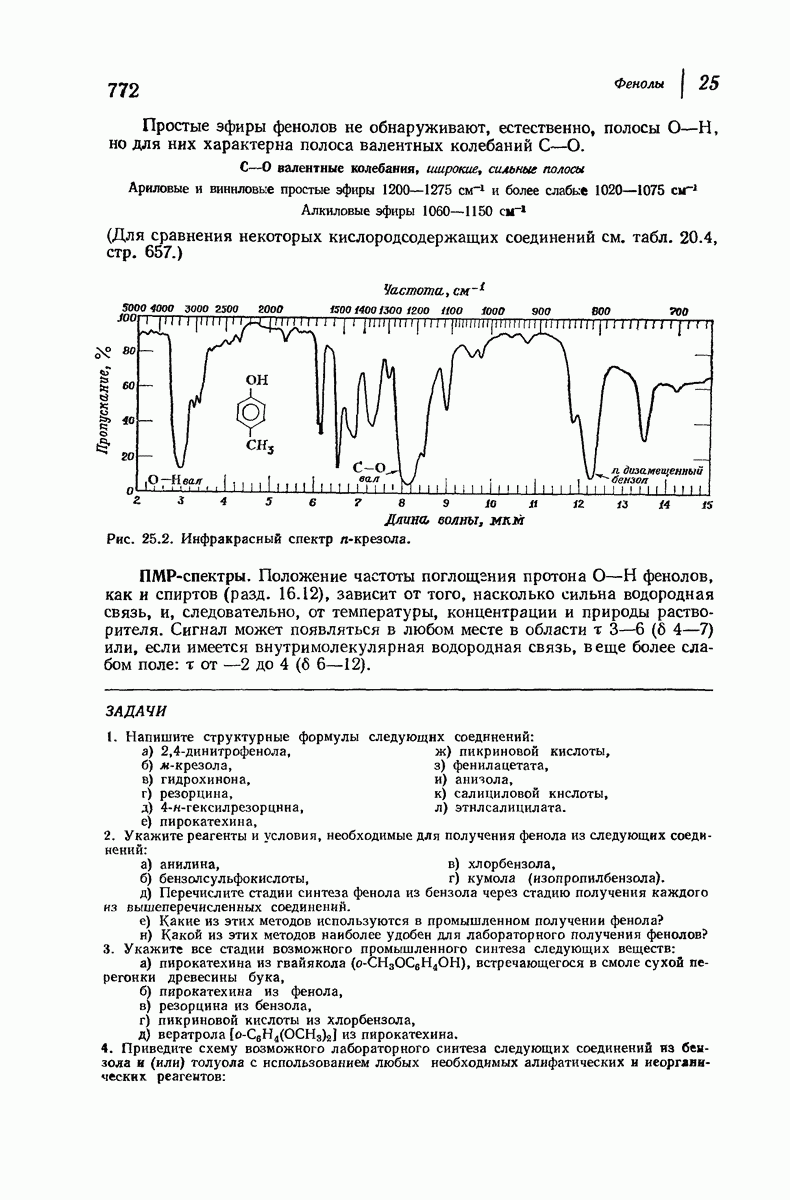
- 25.23. Спектральный анализ фенолов
- 26. Арилгалогениды. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРОМАТИЧЕСКОМ РЯДУ
- 26.7. Низкая реакционная способность арил- и винилгалогенидов
- 26.8. Структура арил- и винилгалогенидов
- 26.9. Влияние галогена на реакцию электрофильного замещения в ароматическом ряду
- 26.10. Нуклеофильное замещение в ароматическом ряду: бимолекулярный механизм
- 26.11. Бимолекулярный механизм нуклеофильного замещения, в ароматическом ряду
- 26.12. Реакционная способность при нуклеофильпом замещении в ароматическом ряду
- 26.13. Ориентация при нуклеофильном замещении в ароматическом ряду
- 26.14. Оттягивание электронов за счет резонансного эффекта
- 26.15. Данные в пользу наличия двух стадий в бимолекулярном замещении
- 26.16. Нуклеофильное замещение в алифатическом и ароматическом рядах
- 26.17. Механизм элиминирования — присоединения при нуклеофильном замещении в ароматическом ряду. Дегидробензол
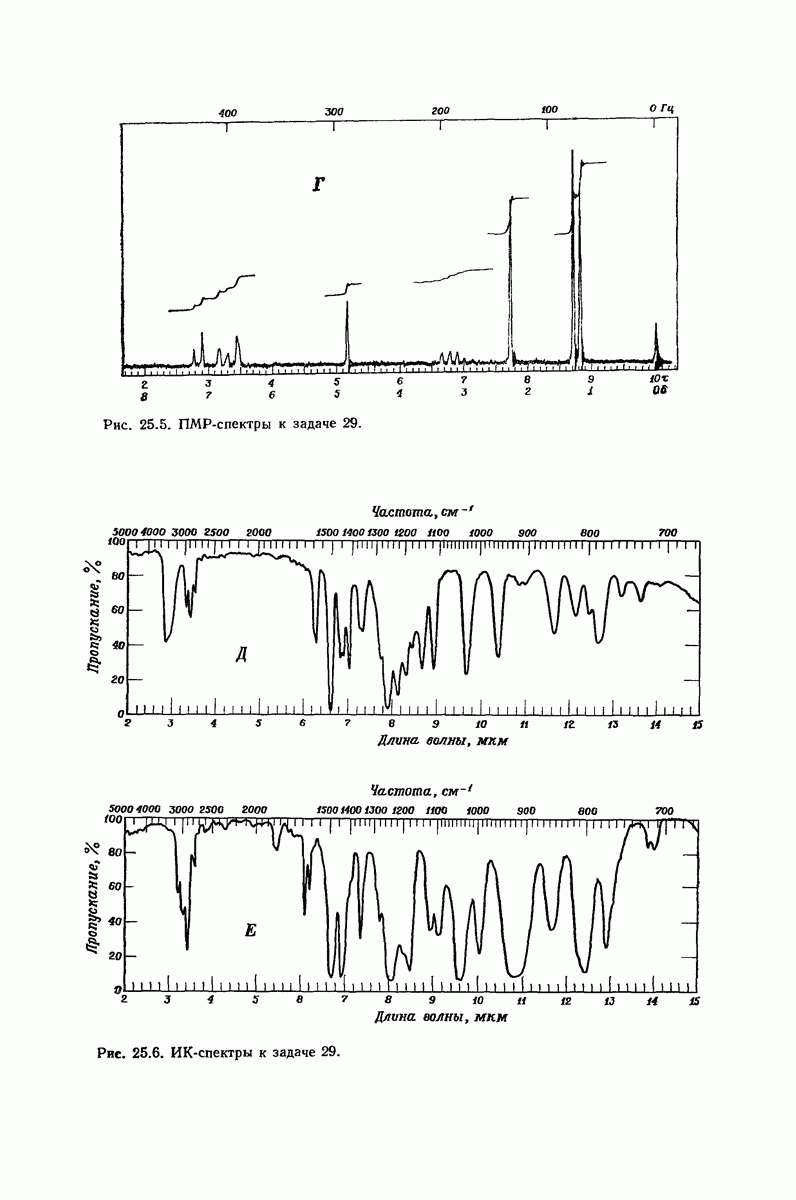
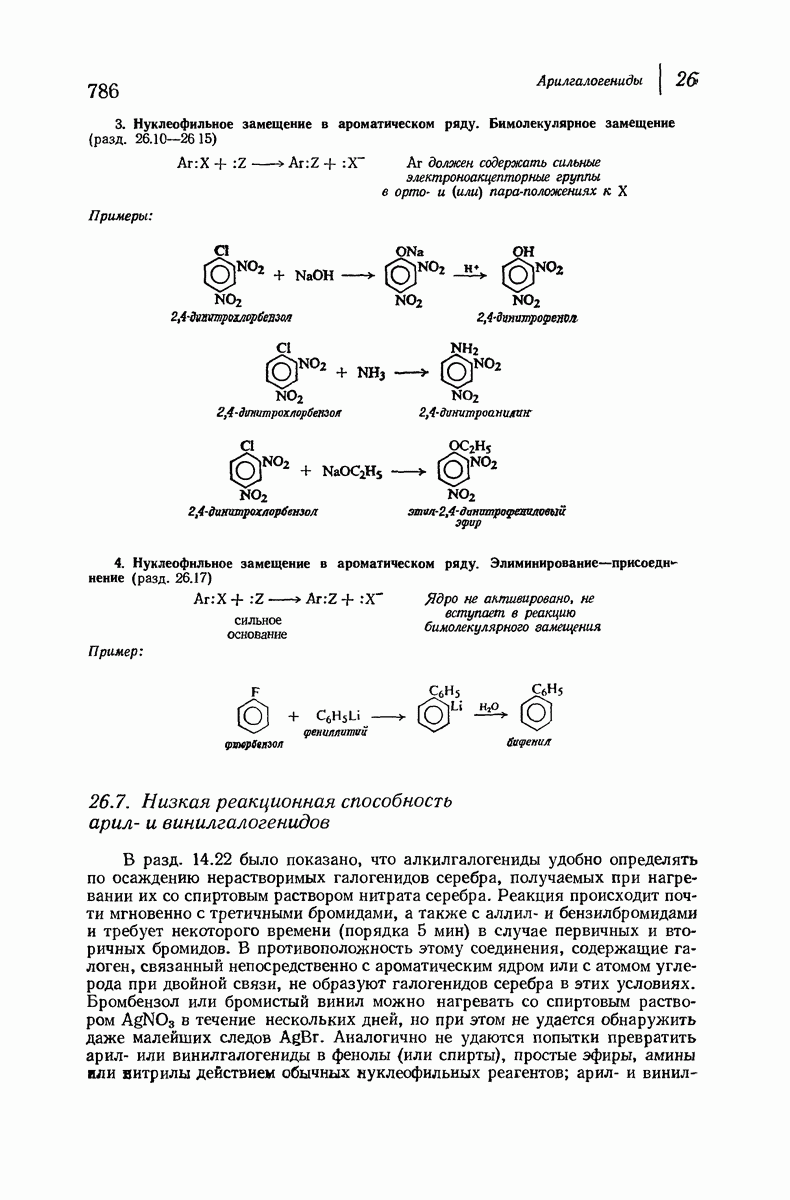
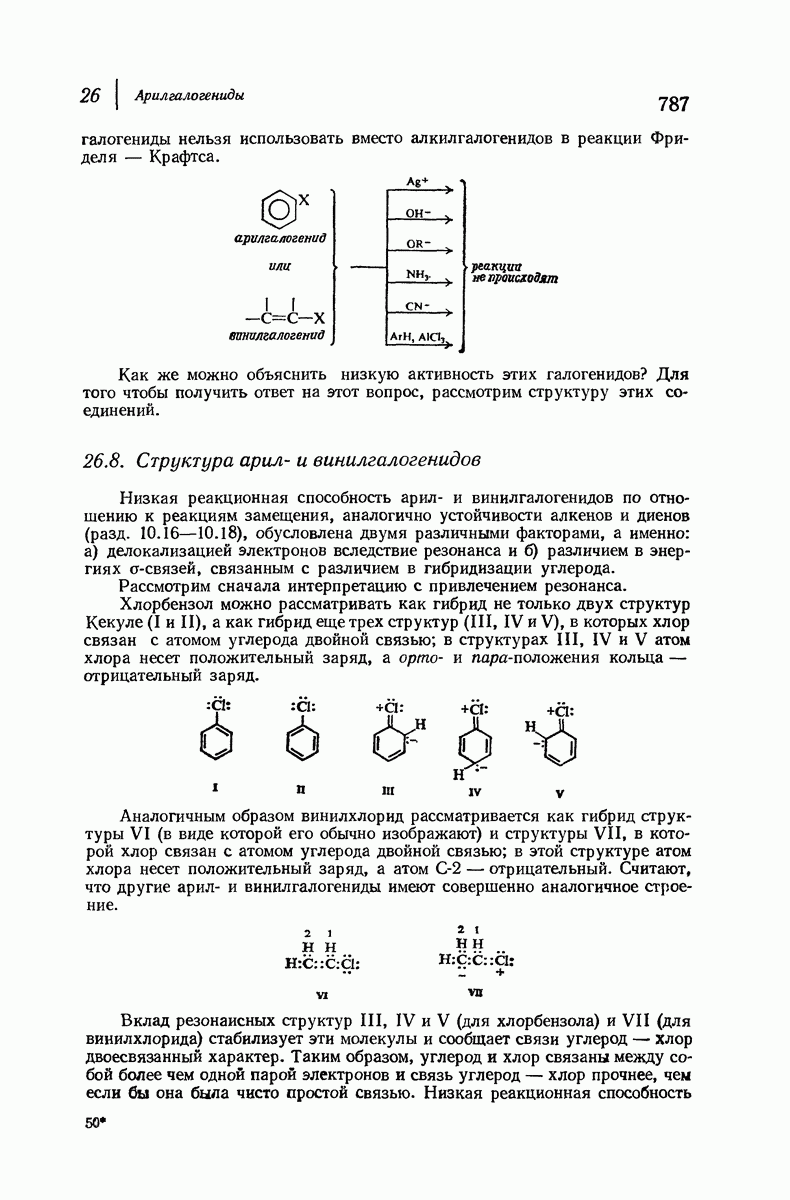
- 26.18. Анализ арилгалогенидов
- 27. Альдегиды и кетоны. II. Карбанионы
- 27.2. Реакции с участием карбанионов
- 27.3. Галогенирование кетонов, промотируемое основаниями
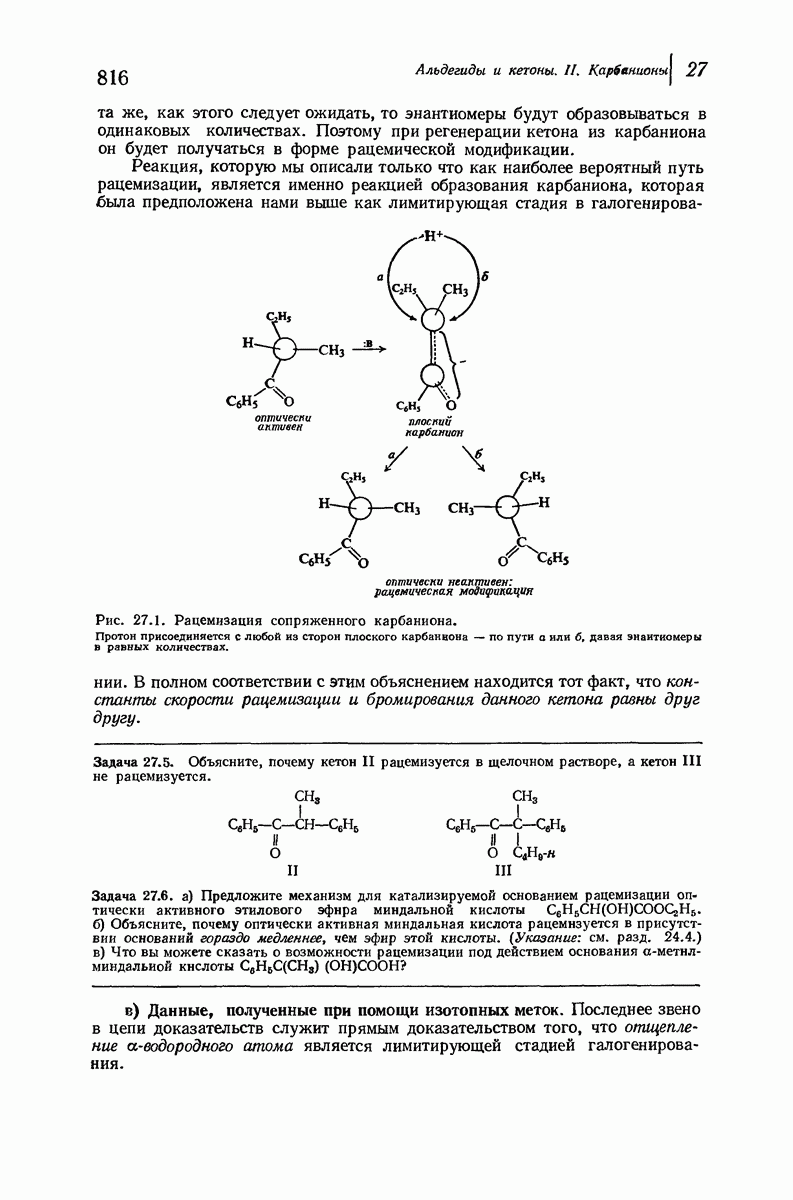
- 27.4. Стереохимия карбанионов
- 27.5. Галогенирование кетонов, катализируемое кислотами. Енолизация
- 27.6. Альдольная конденсация. Присоединение альдегидов и кетонов
- 27.7. Дегидратация продуктов альдольной конденсации
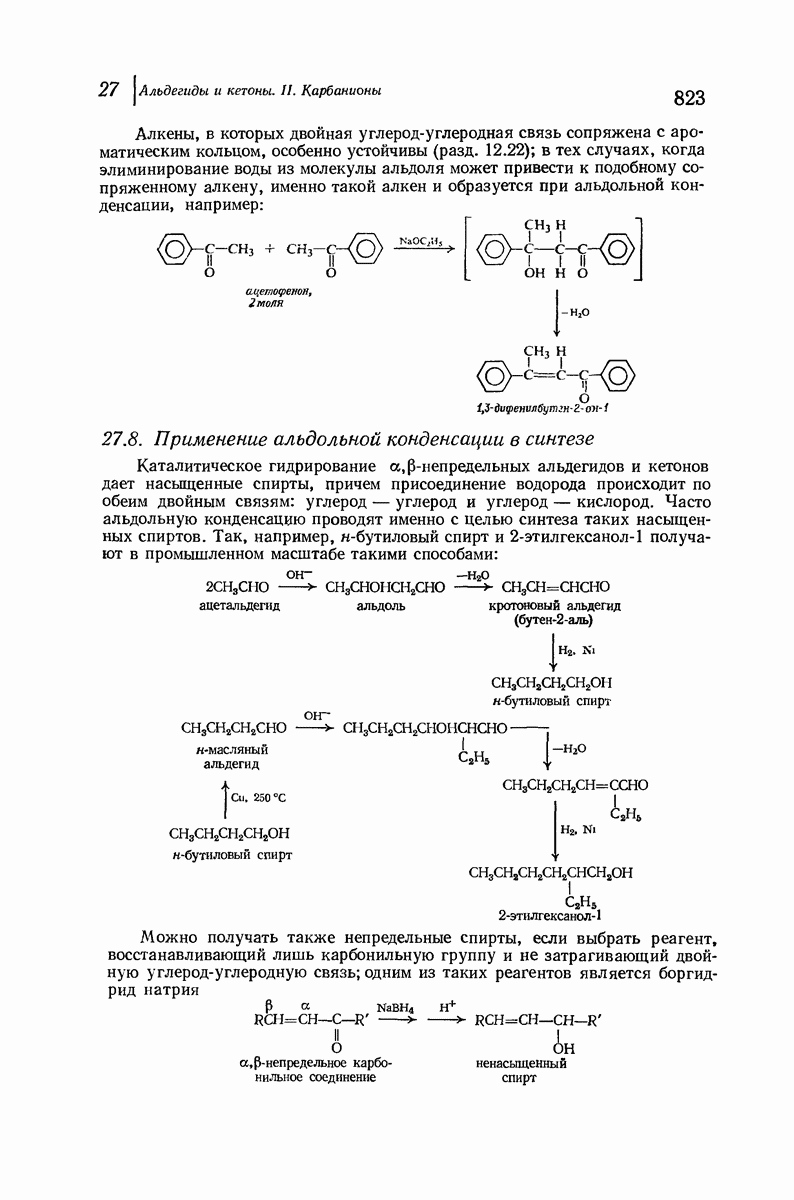
- 27.8. Применение альдольной конденсации в синтезе
- 27.9. Перекрестная альдольная конденсация
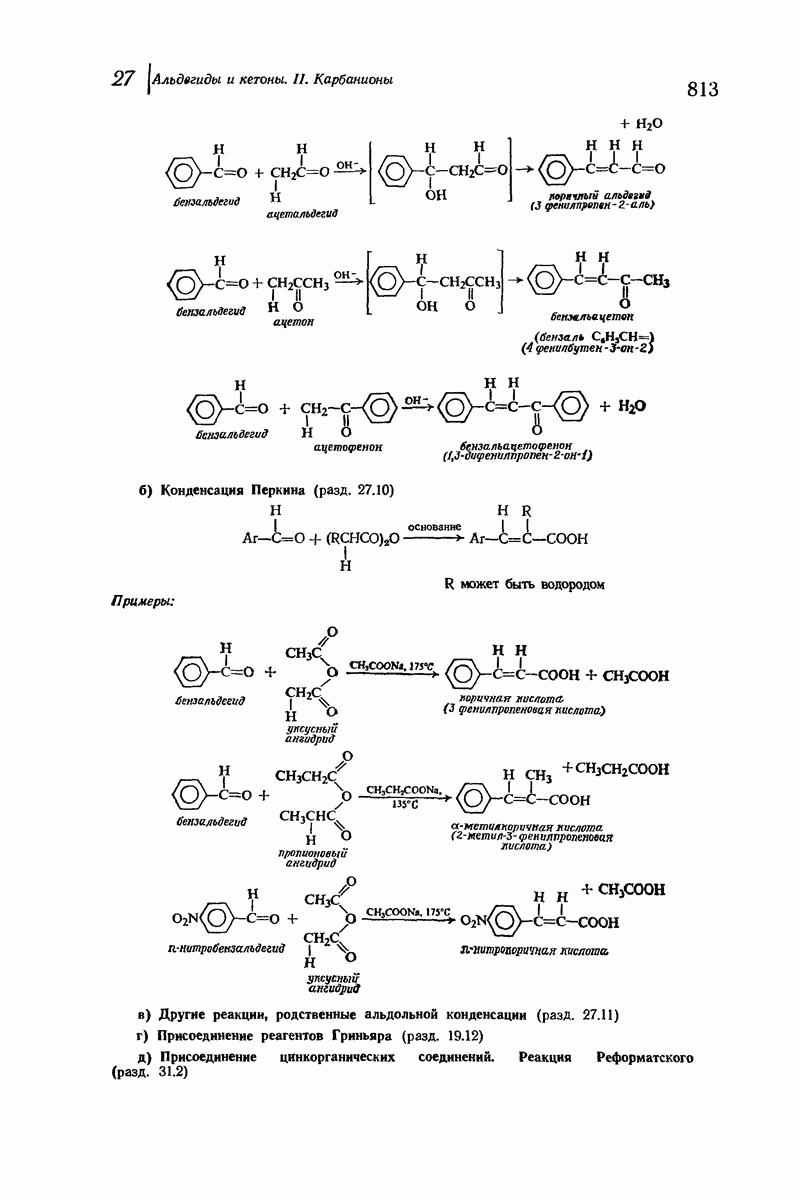
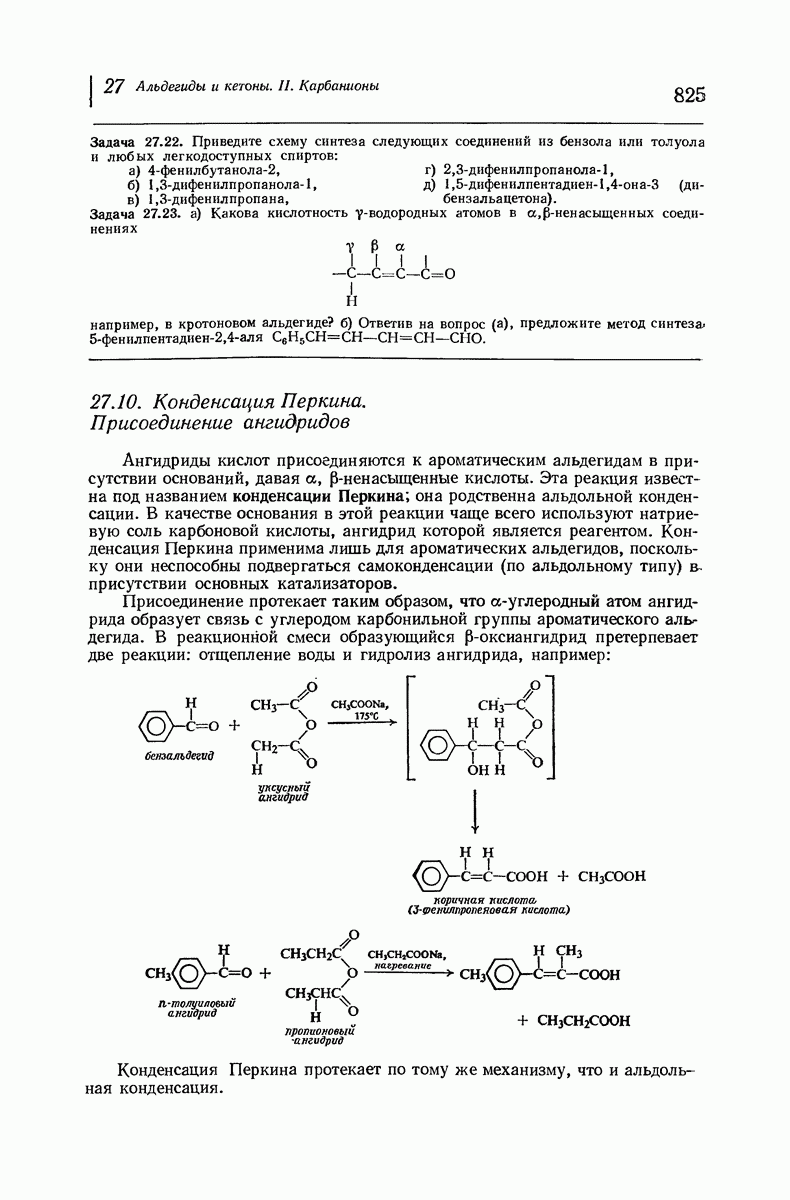
- 27.10. Конденсация Перкина. Присоединение ангидридов
- 27.11. Реакции, родственные альдольной конденсации
- 27.12. Реакция Виттига
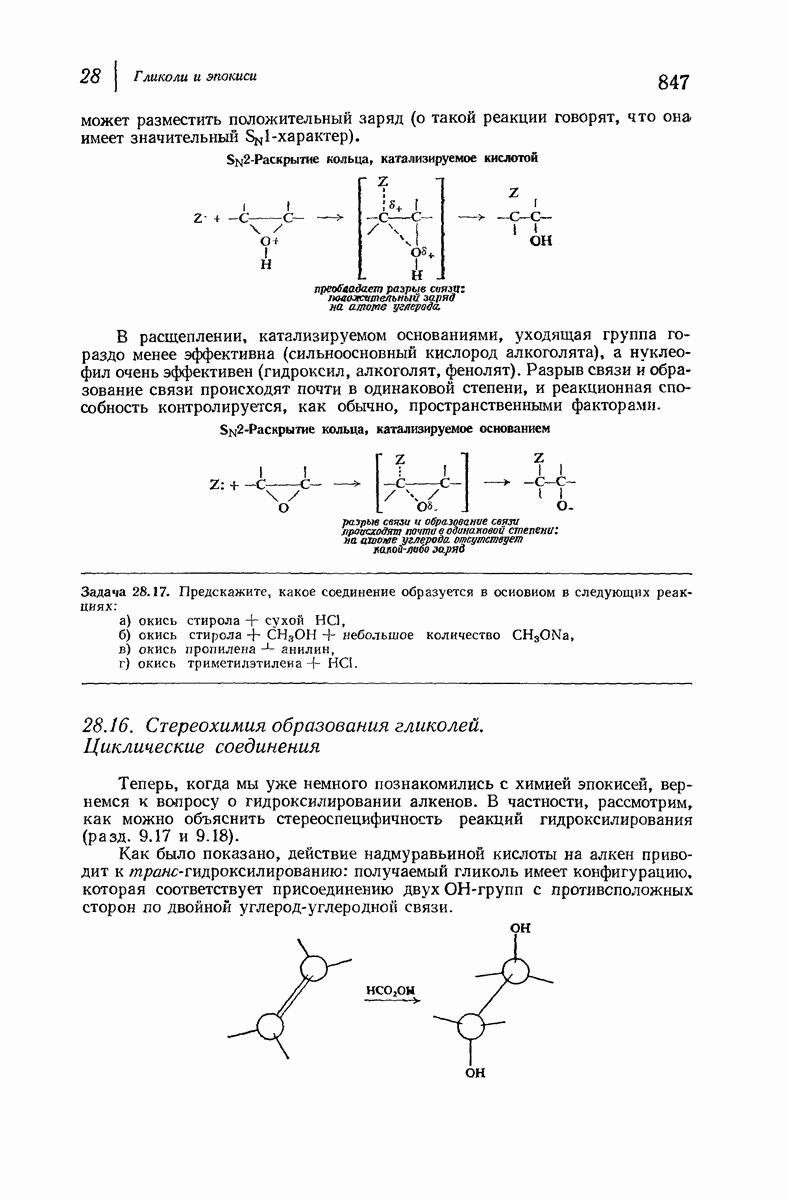
- 28. Гликоли и эпокиси
- 28.6. Окисление гликолей йодной кислоты
- 28.7. Пинаколиновая перегруппировка
- 28.8. Стереохимия 1,2-сдвигов: центр, к которому осуществляется миграция
- 28.9. Стереохимия 1,2-сдвигов: конформационные эффекты
- ЭПОКИСИ
- 28.10. Методы синтеза эпокисей
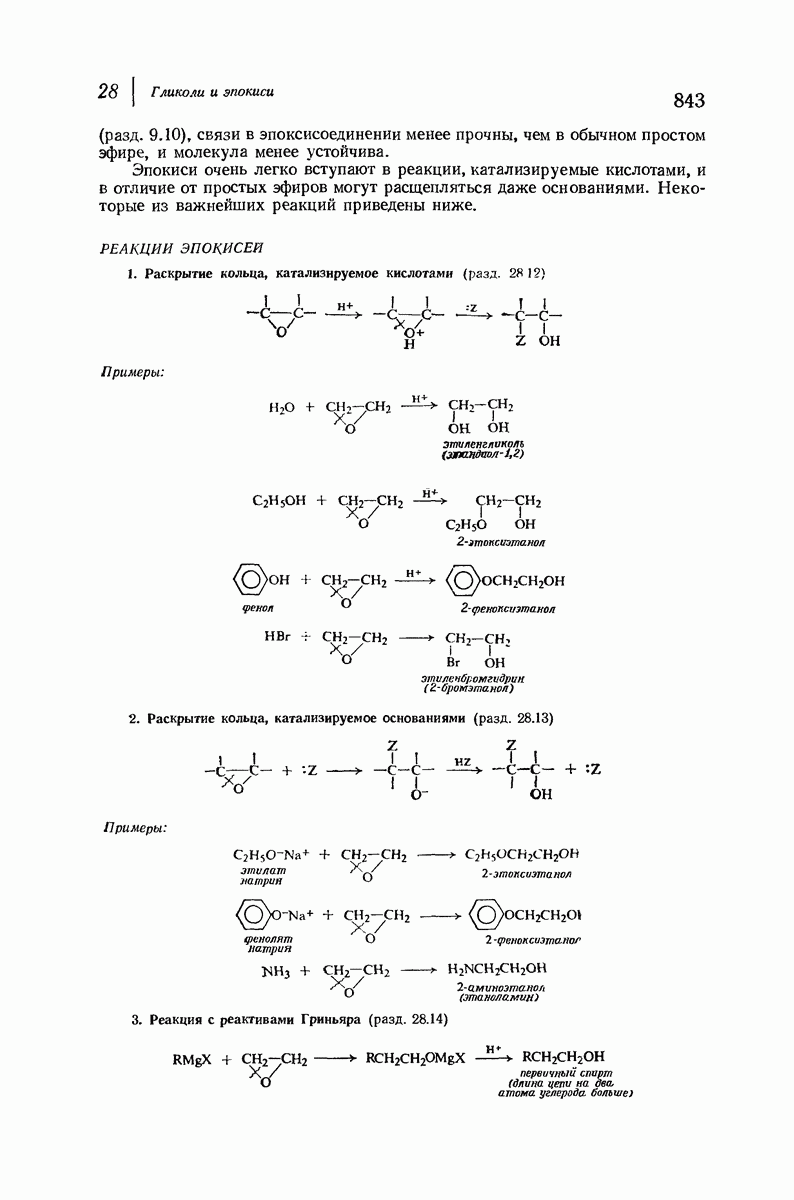
- 28.11. Реакции эпокисей
- 28.12. Раскрытие кольца эпокисей, катализируемое кислотами
- 28.13. Раскрытие кольца эпокисей, катализируемое основаниями
- 28.14. Реакция окиси этилена с реактивом Гриньяра
- 28.15. Направление раскрытия кольца эпокисей
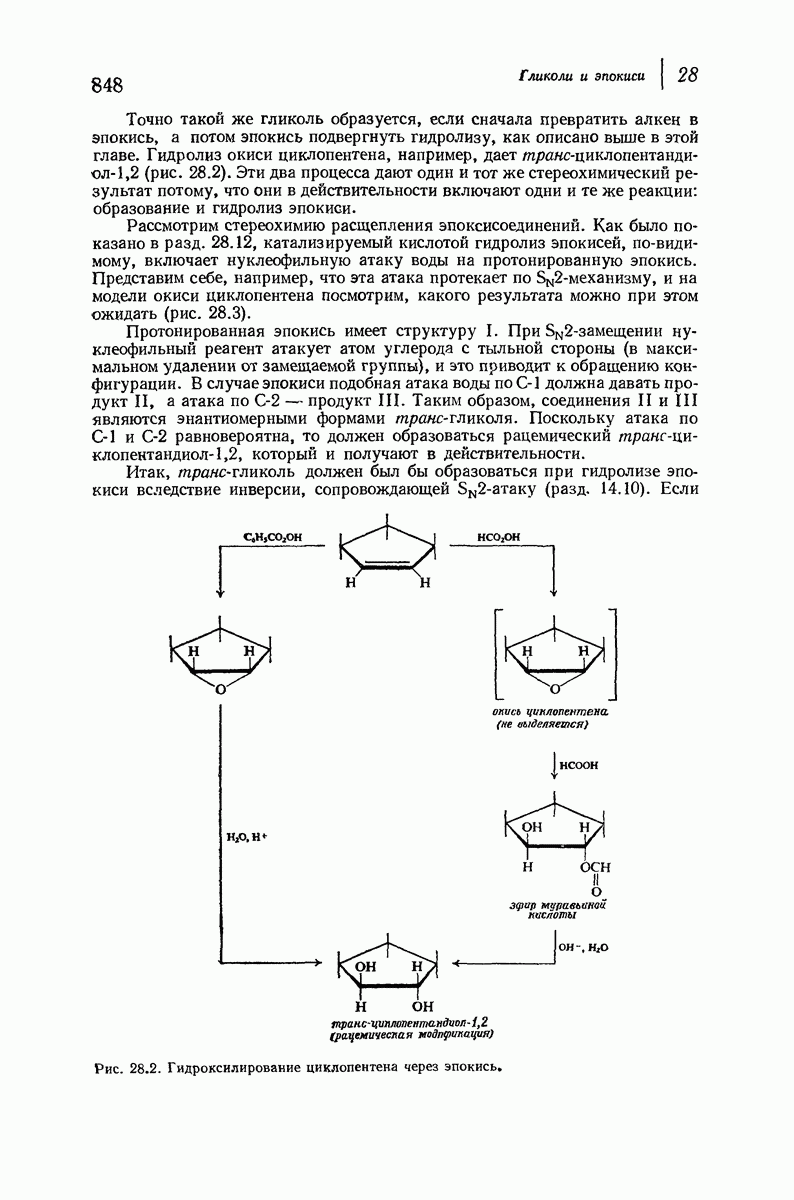
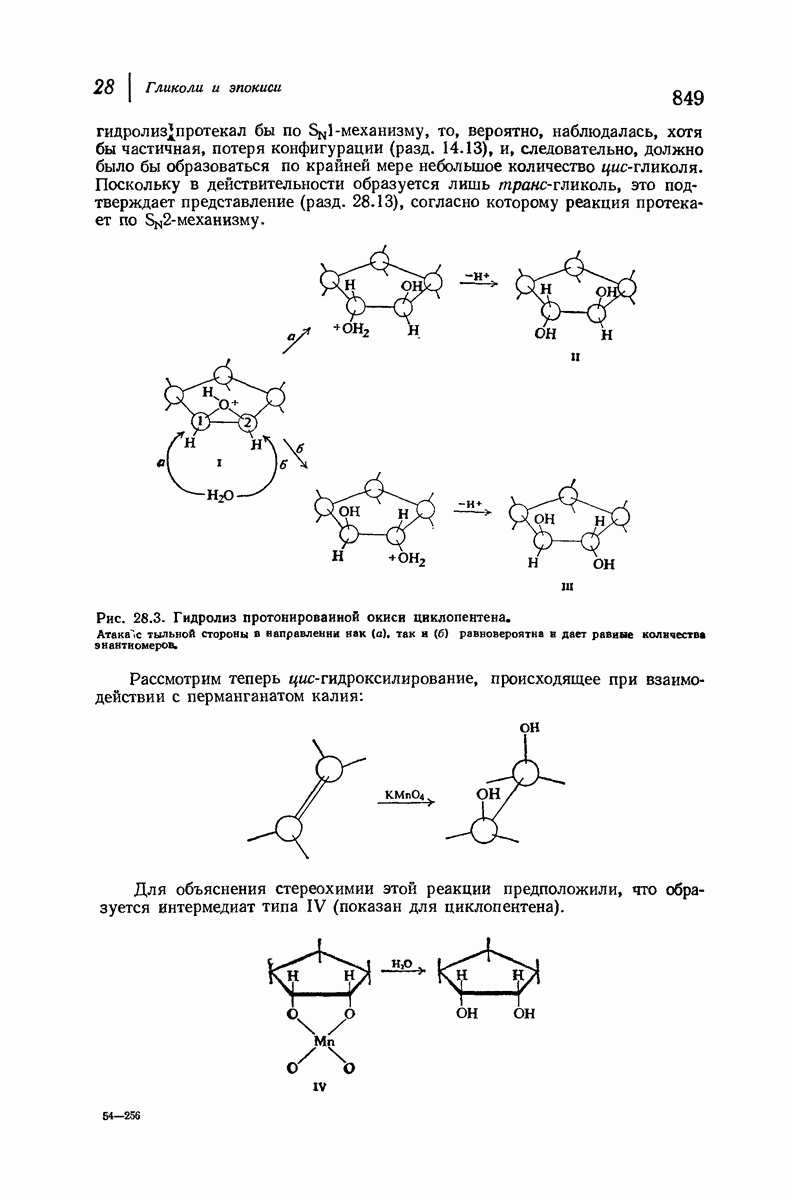
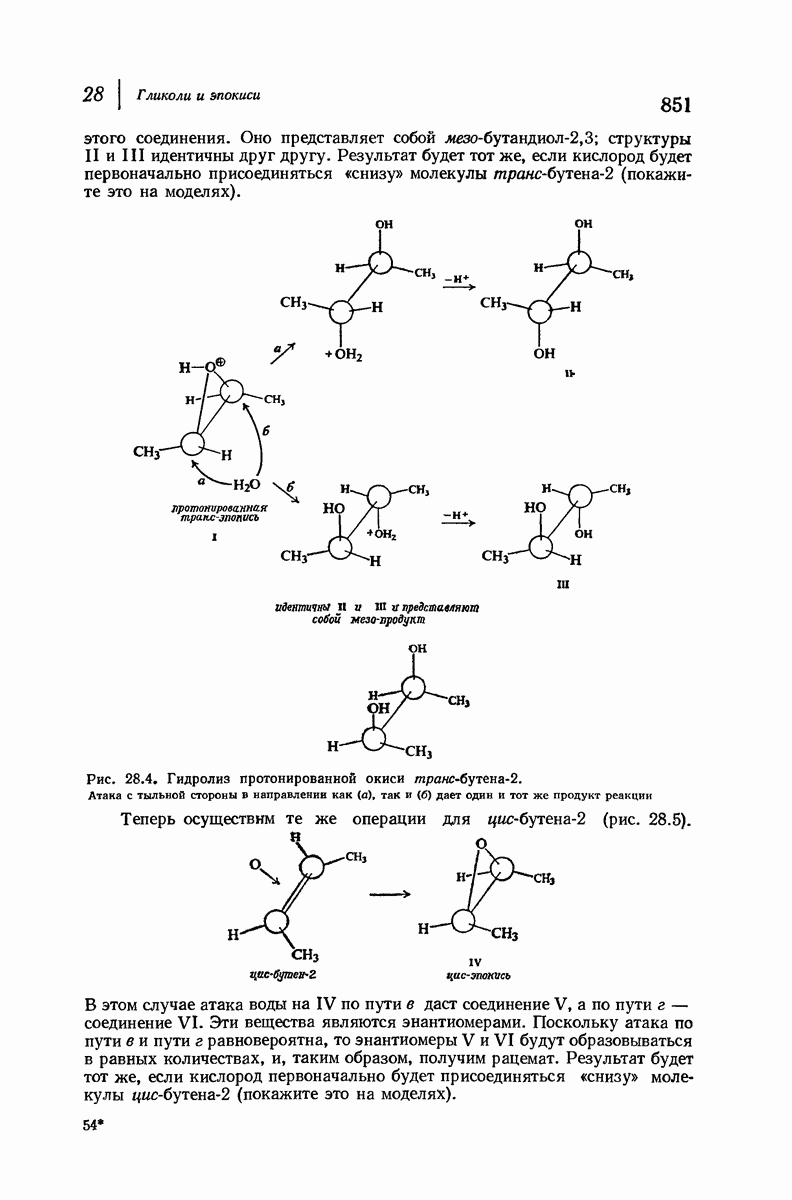
- 28.16. Стереохимия образования гликолей. Циклические соединения
- 28.17. Стереохимия образования гликолей. Ациклические соединения
- 28.18. Стереохимия присоединения галогена
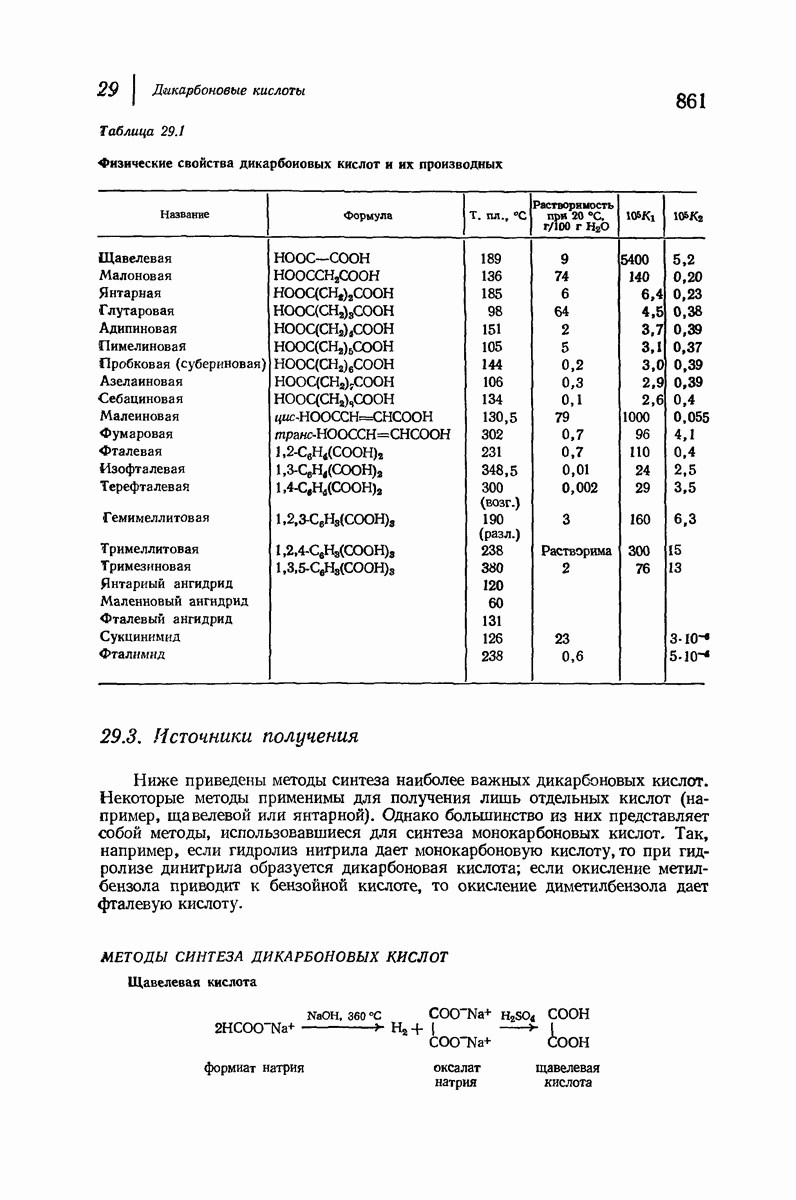
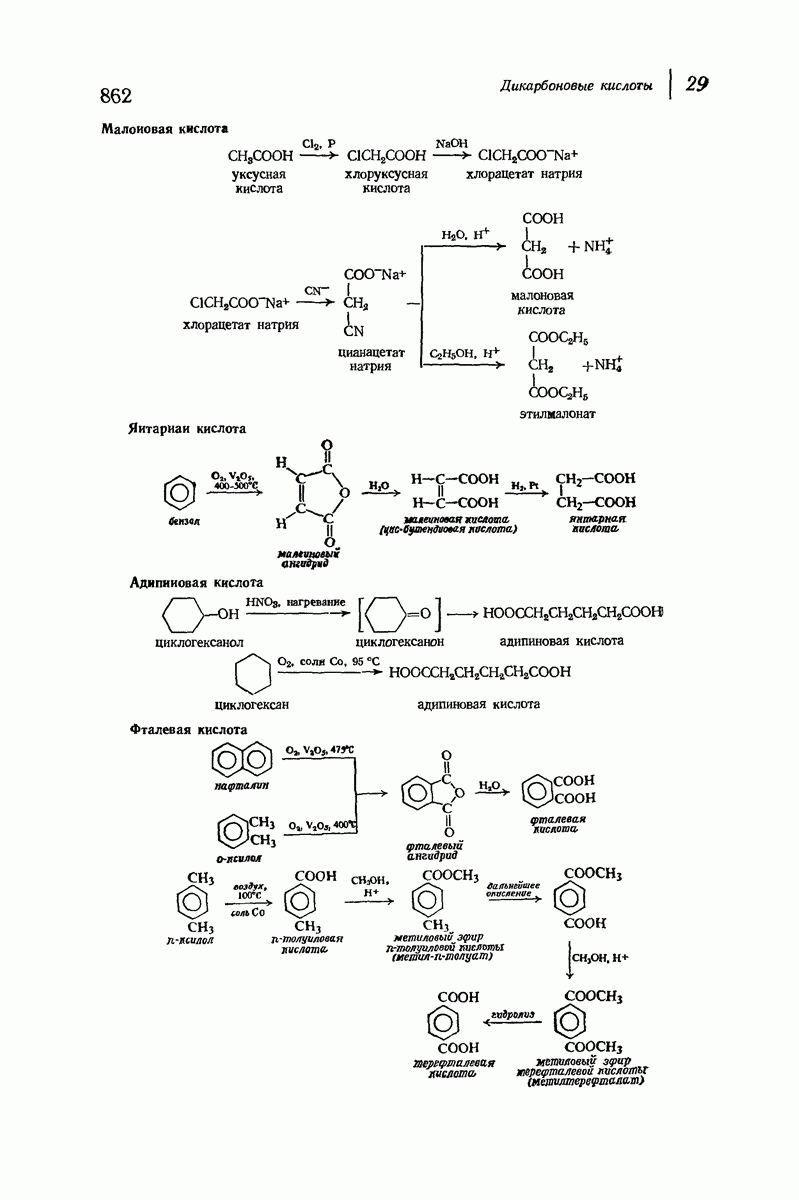
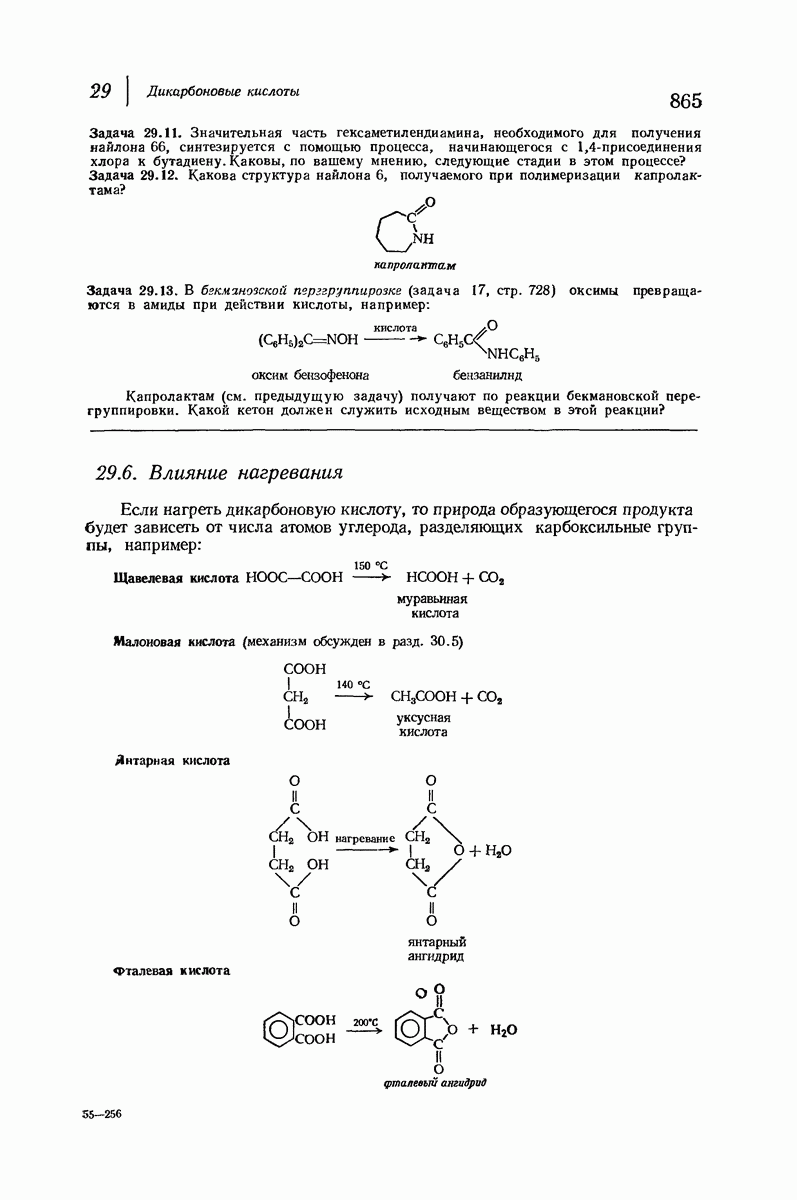
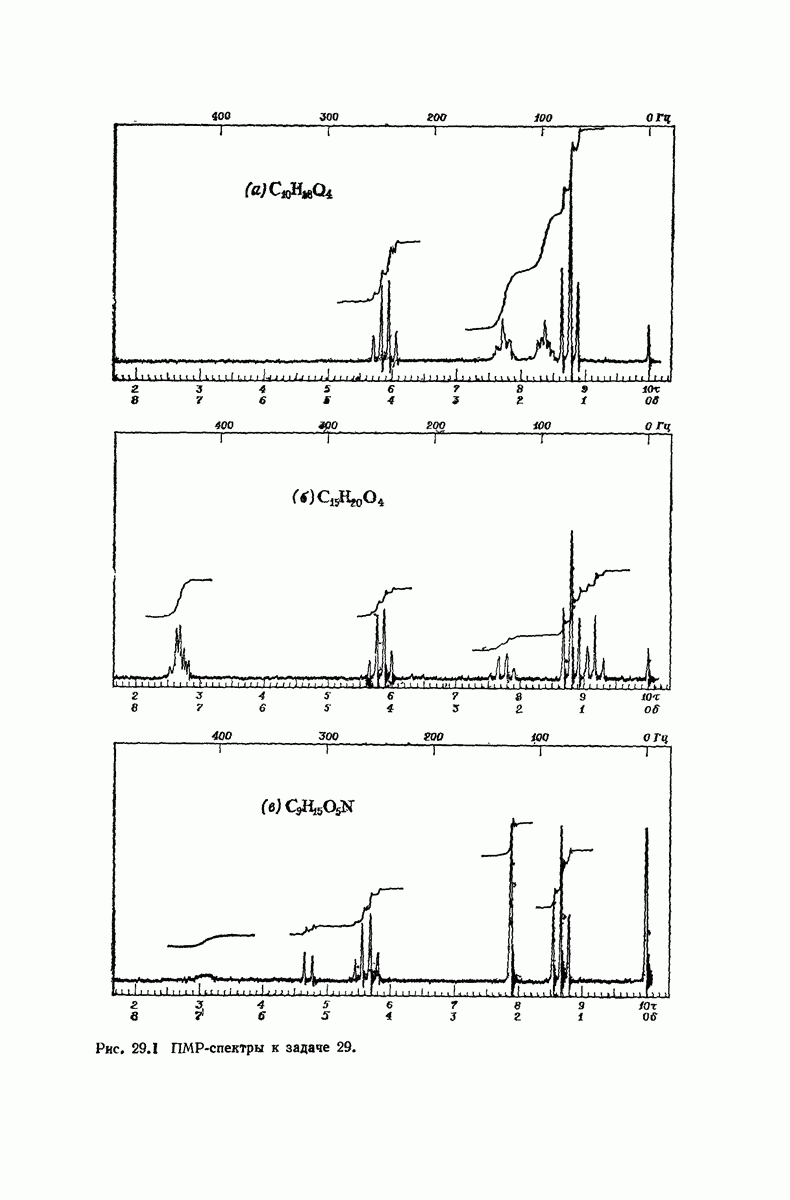
- 29. Дикарбоновые кислоты
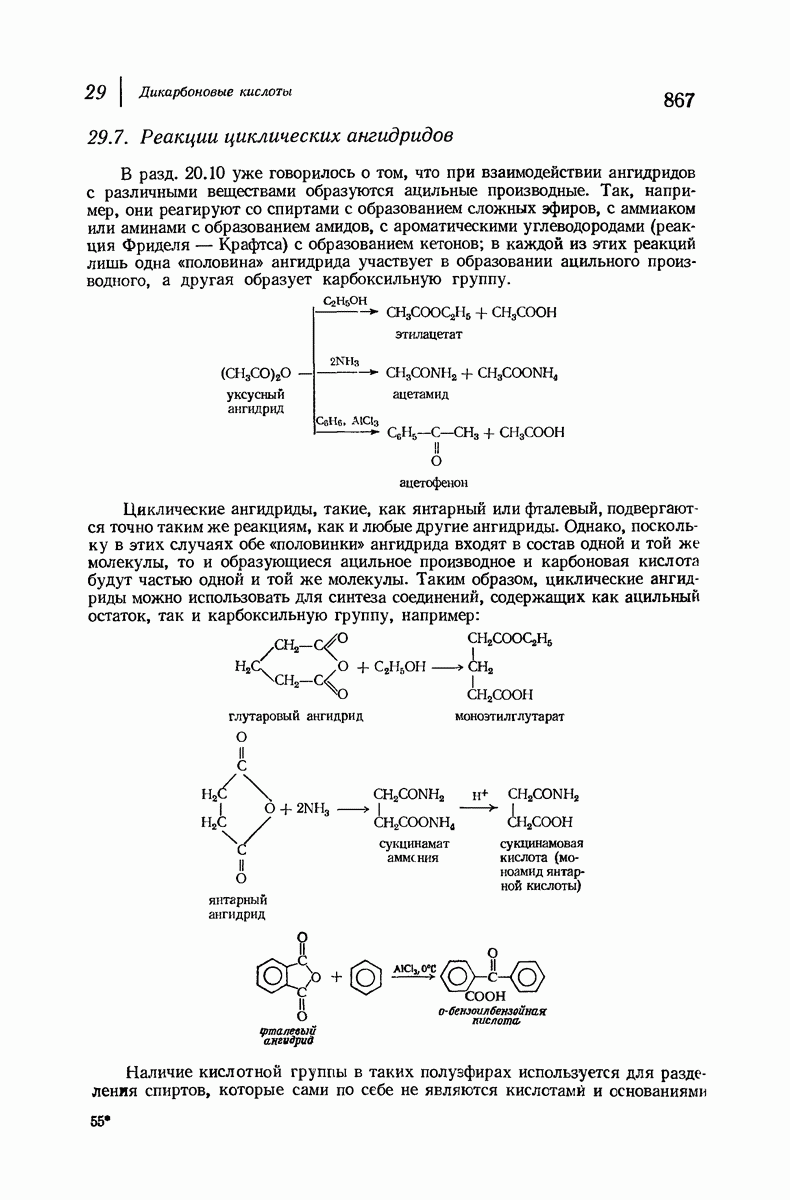
- 29.7. Реакции циклических ангидридов
- 29.8. Имиды. Синтез чистых первичных аминов по Габриэлю
- 29.9. Синтез карбоновых кислот при помощи малонового эфира
- УГОЛЬНАЯ КИСЛОТА И РОДСТВЕННЫЕ СОЕДИНЕНИЯ
- 29.10. Функциональные производные угольной кислоты
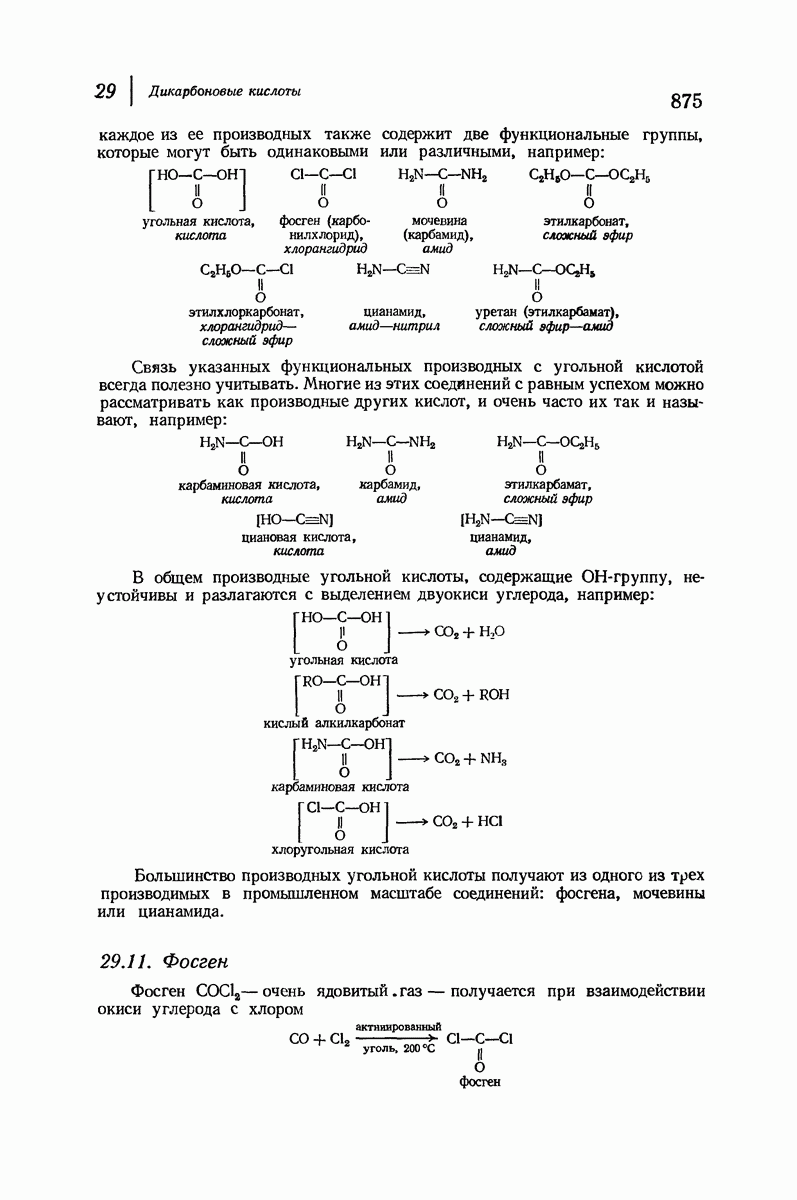
- 29.11. Фосген
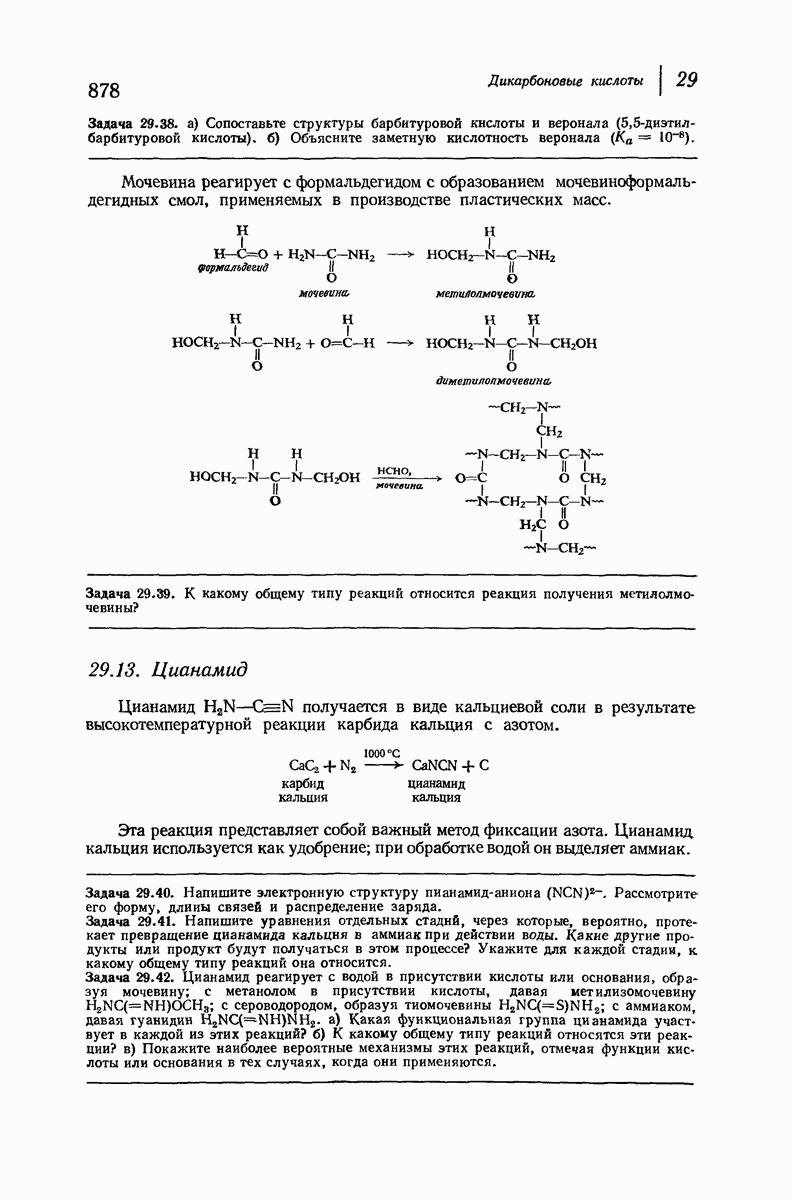
- 29.12. Мочевина. Барбитураты
- 29.13. Цианамид
- 29.14. Изоцианаты
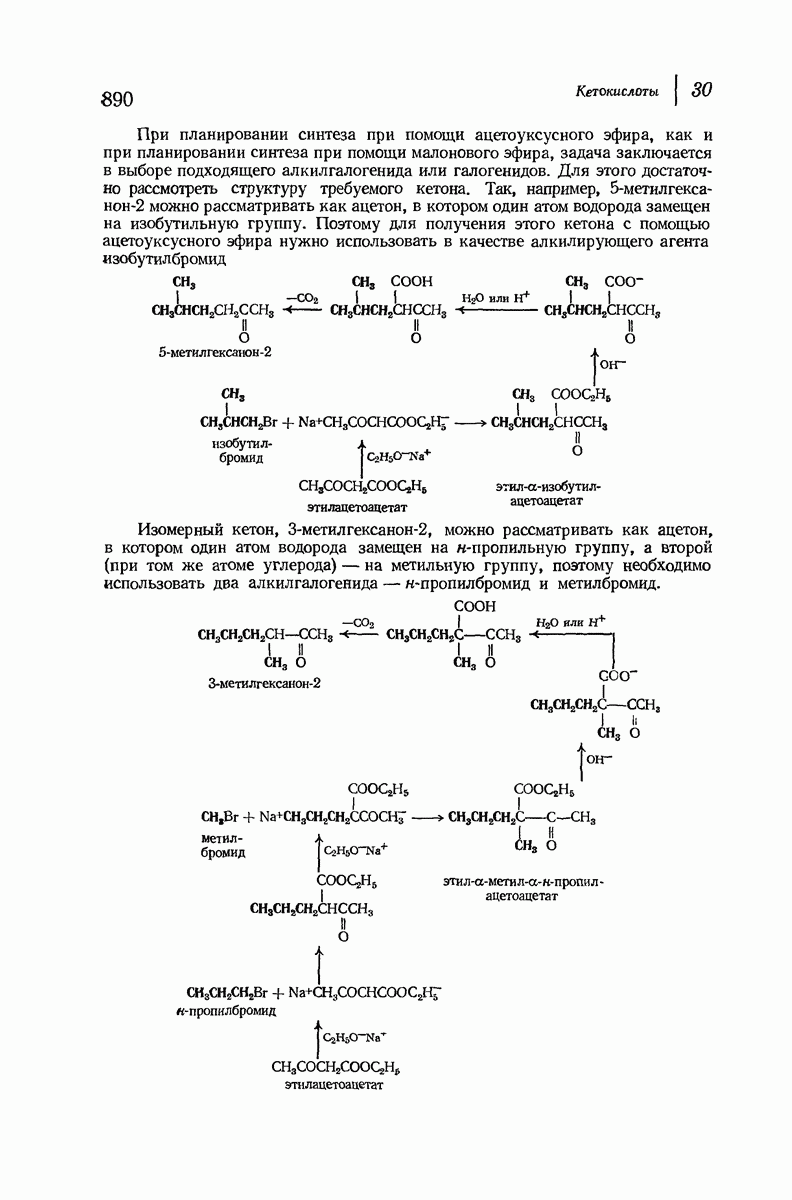
- 30. Кетокислоты
- 30.2. Получение b-кетоэфиров. Конденсация Клайзена
- 30.3. Перекрестная конденсация Клайзена
- 30.4. Синтез кетонов при помощи ацетоуксусного эфира
- 30.5. Декарбоксилирование кетокислот
- 30.6. Синтез кислот при помощи ацетоуксусного эфира
- 30.7. Кето-енольная таутомерия и ацетоуксусный эфир
- 30.8. Состав кето-енольных смесей
- 30.9. Кислоты и основания и кето-енольная таутомерия
- 31. Оксикислоты
- 31.2. Методы синтеза b-оксикислот. Реакция Реформатского
- 31.3. Дегидратация. Образование лактона
- 31.4. Стереохимия оксикислот
- 31.5. Оптические ряды. Глицериновый альдегид
- 31.6. Винная кислота. Относительные конфигурации
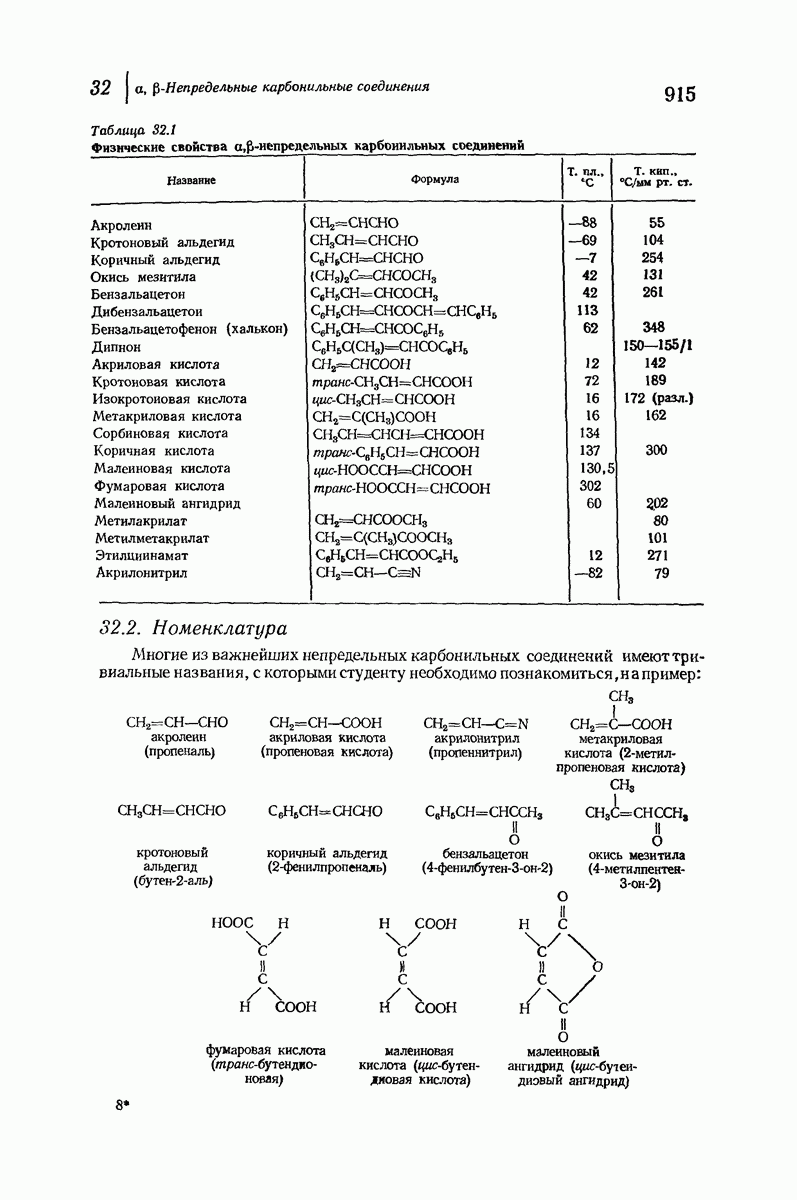
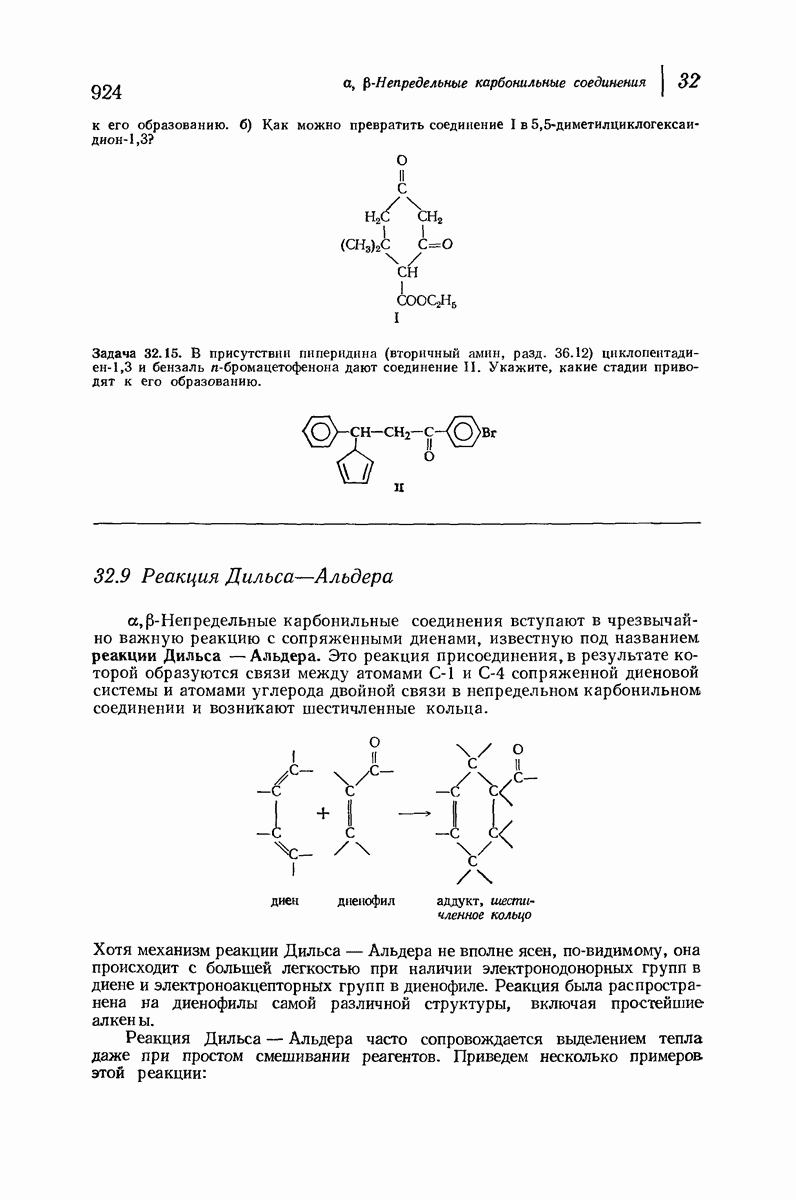
- 32 a,b-Непредельные карбонильные соединения
- 32.5. Электрофильное присоединение
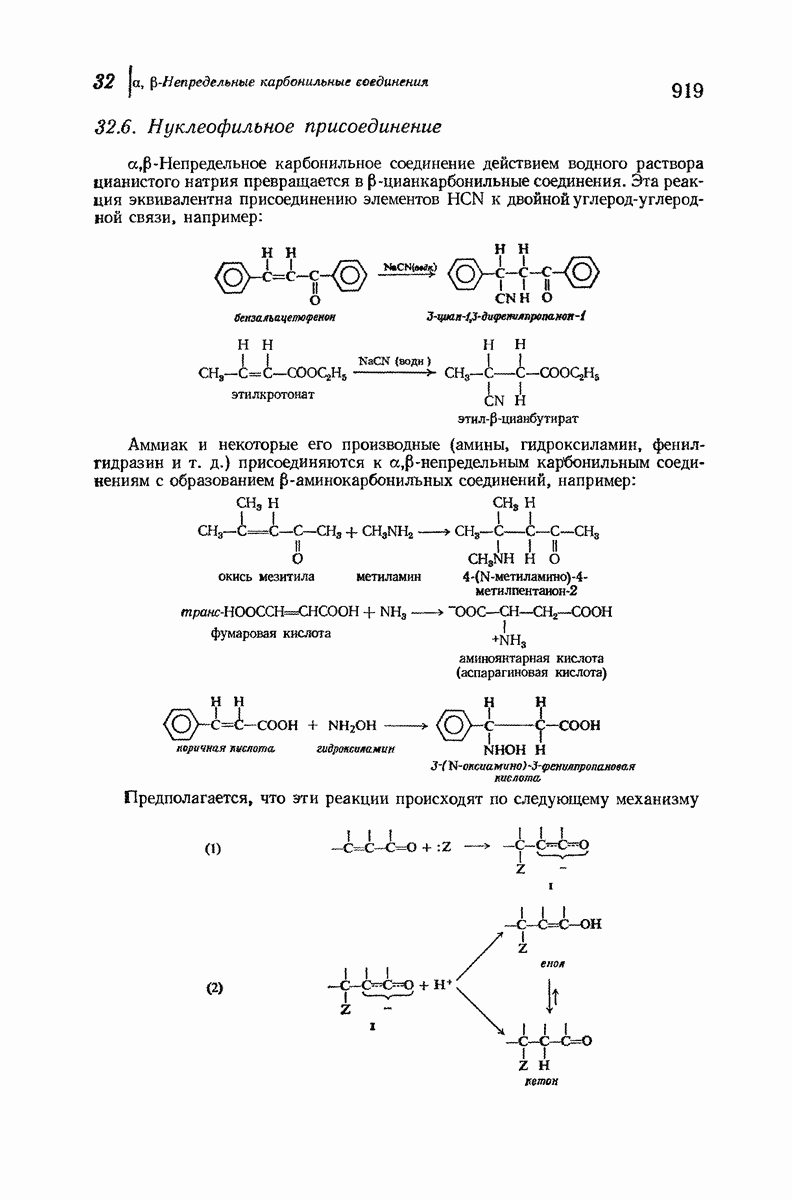
- 32.6. Нуклеофильное присоединение
- 32.7. Сравнение реакций нуклеофильного и электрофильного присоединения
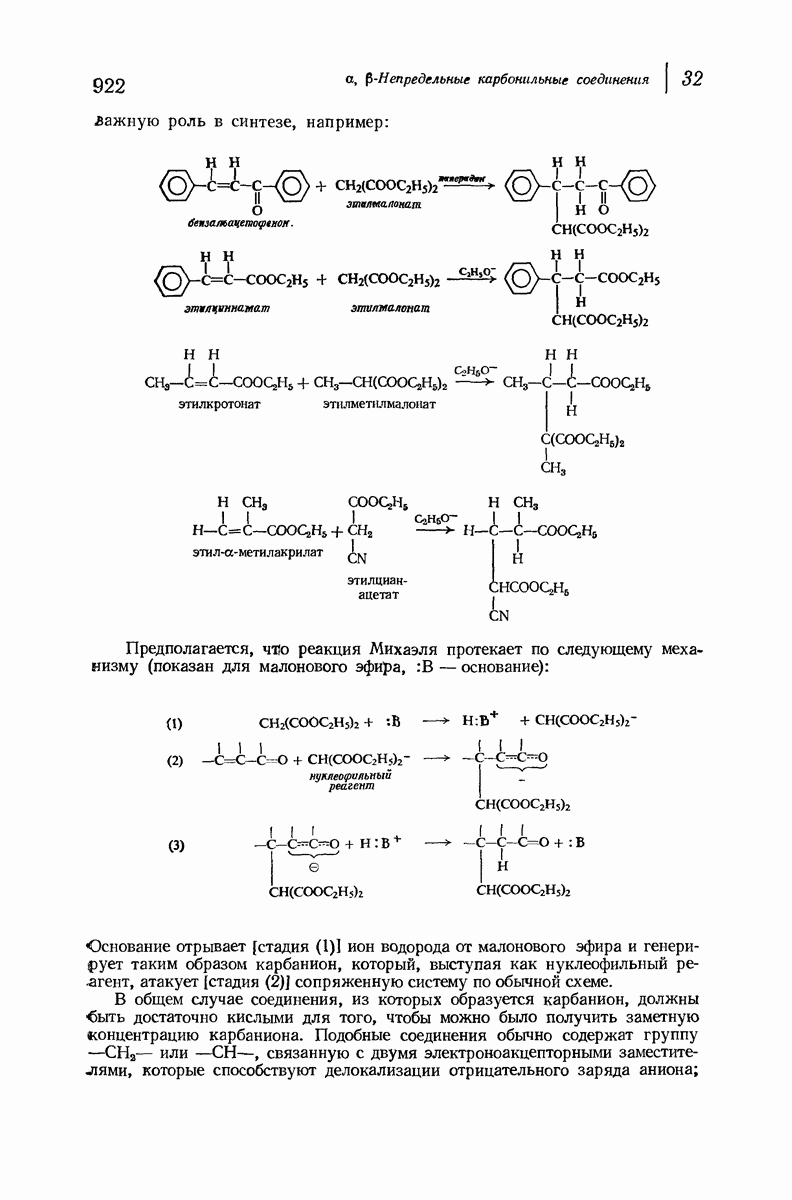
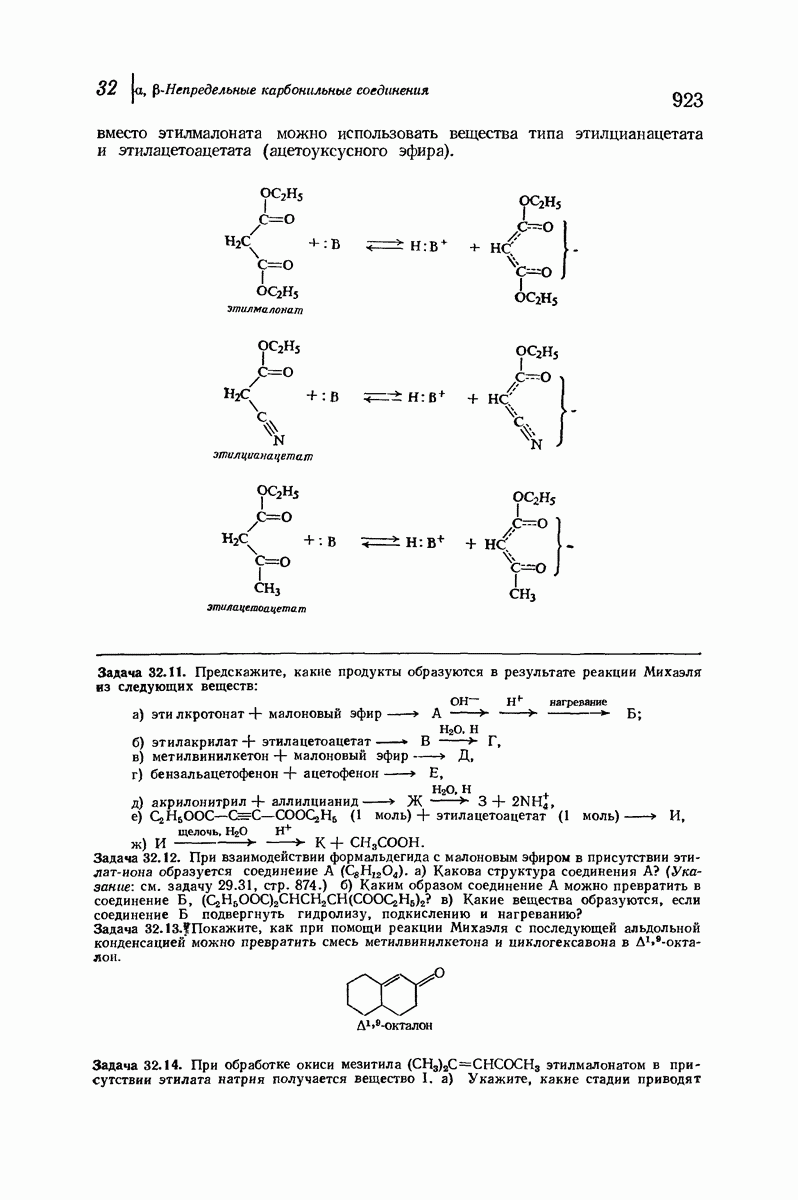
- 32.8. Присоединение по Михаэлю
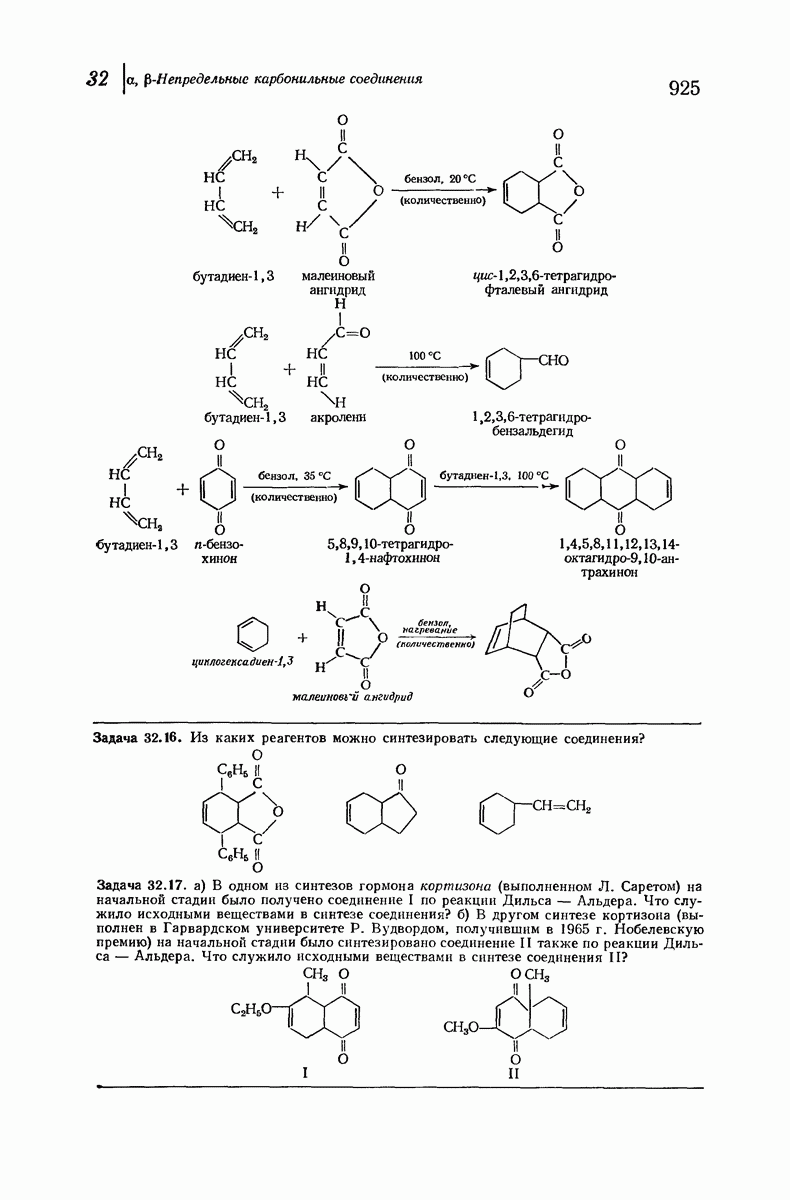
- 32.9 Реакция Дильса-Альдера
- 32.10. Хиноны
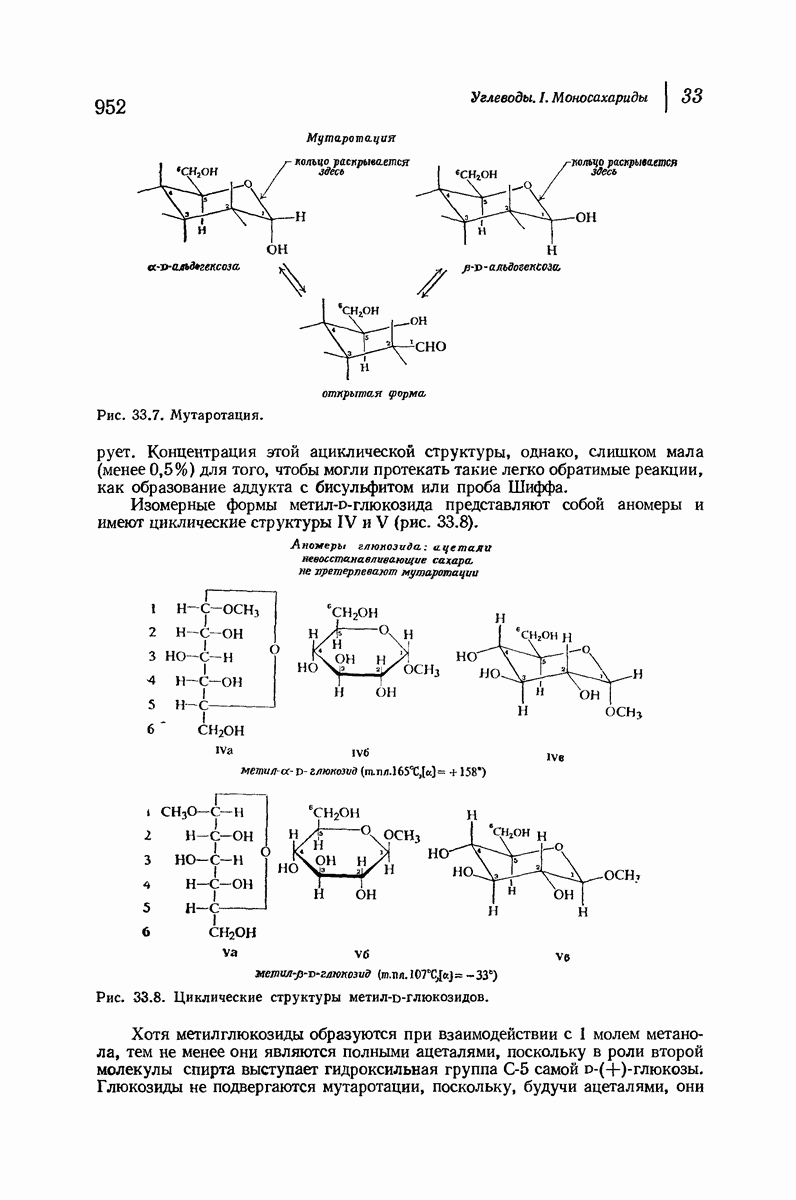
- 33. Углеводы. I. Моносахариды
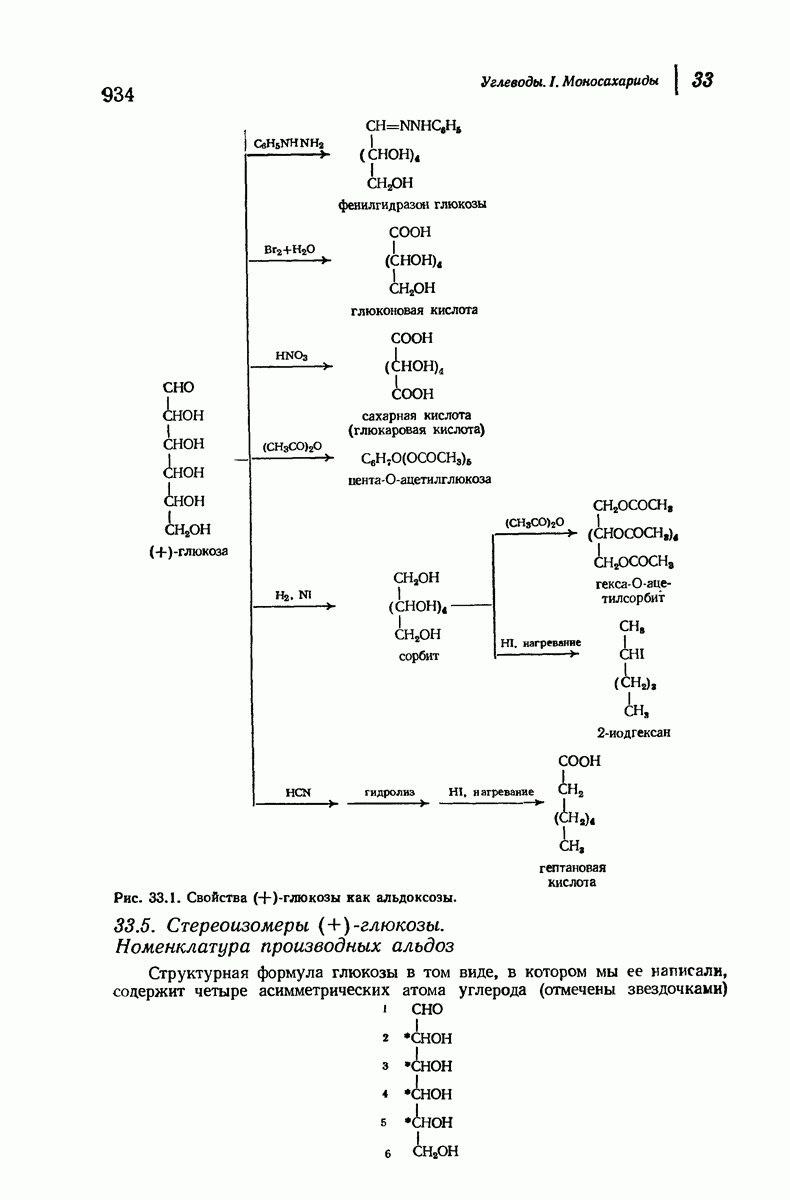
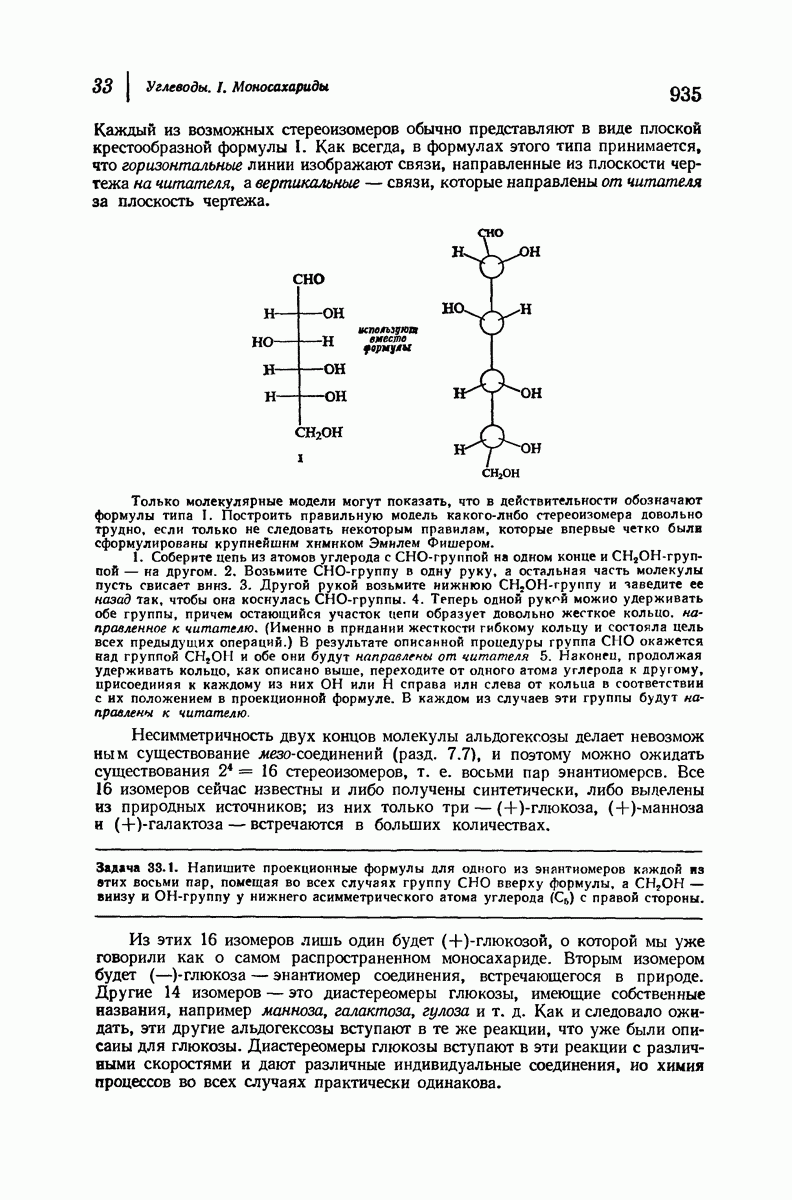
- 33.5. Стереоизомеры (+)-глюкозы. Номенклатура производных альдоз
- 33.6. Окисление. Действие щелочей
- 33.7. Образование озазона. Эпимеры
- 33.8. Увеличение длины углеродной цепи альдоз. Синтез Килиани — Фишера
- 33.9. Уменьшение длины цепи альдоз. Расщепление по Руффу
- 33.10. Превращение альдозы в ее эпимер
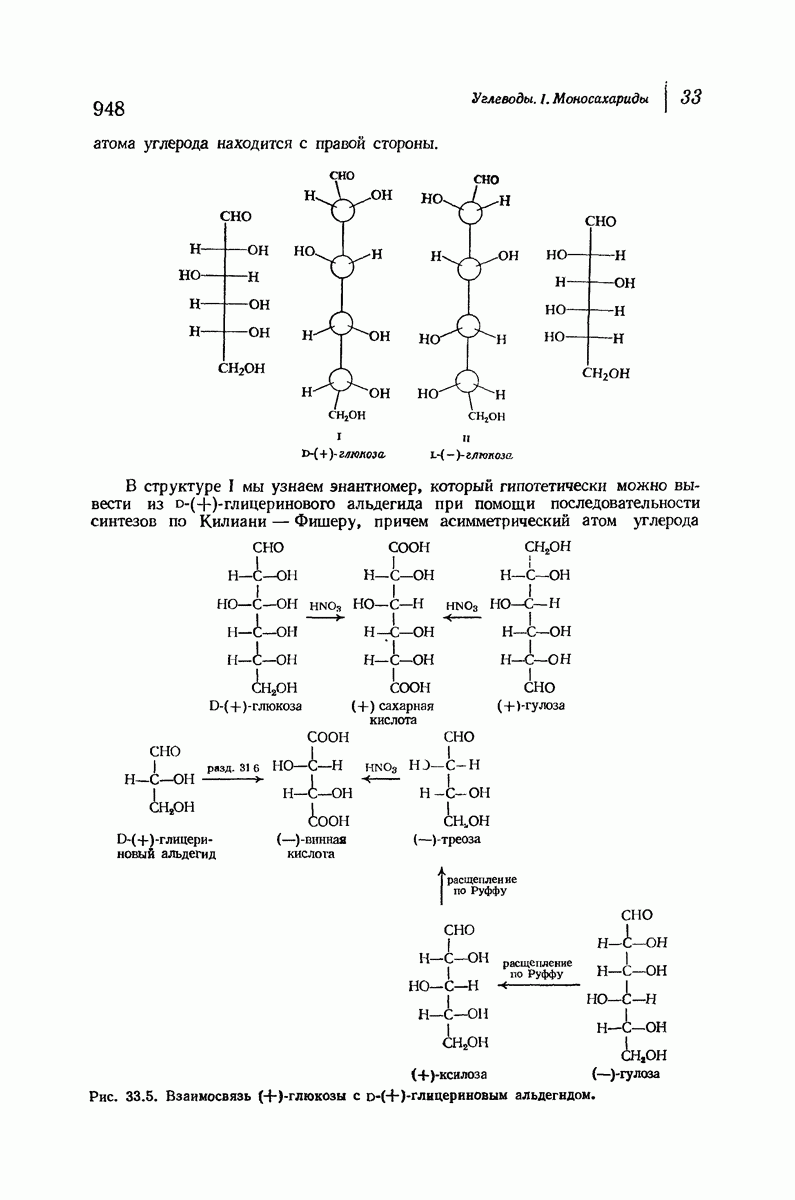
- 33.11. Конфигурация (+)-глюкозы. Доказательство Фишера
- 33.12. Конфигурации альдоз
- 33.13. Семейство альдоз. Абсолютная конфигурация
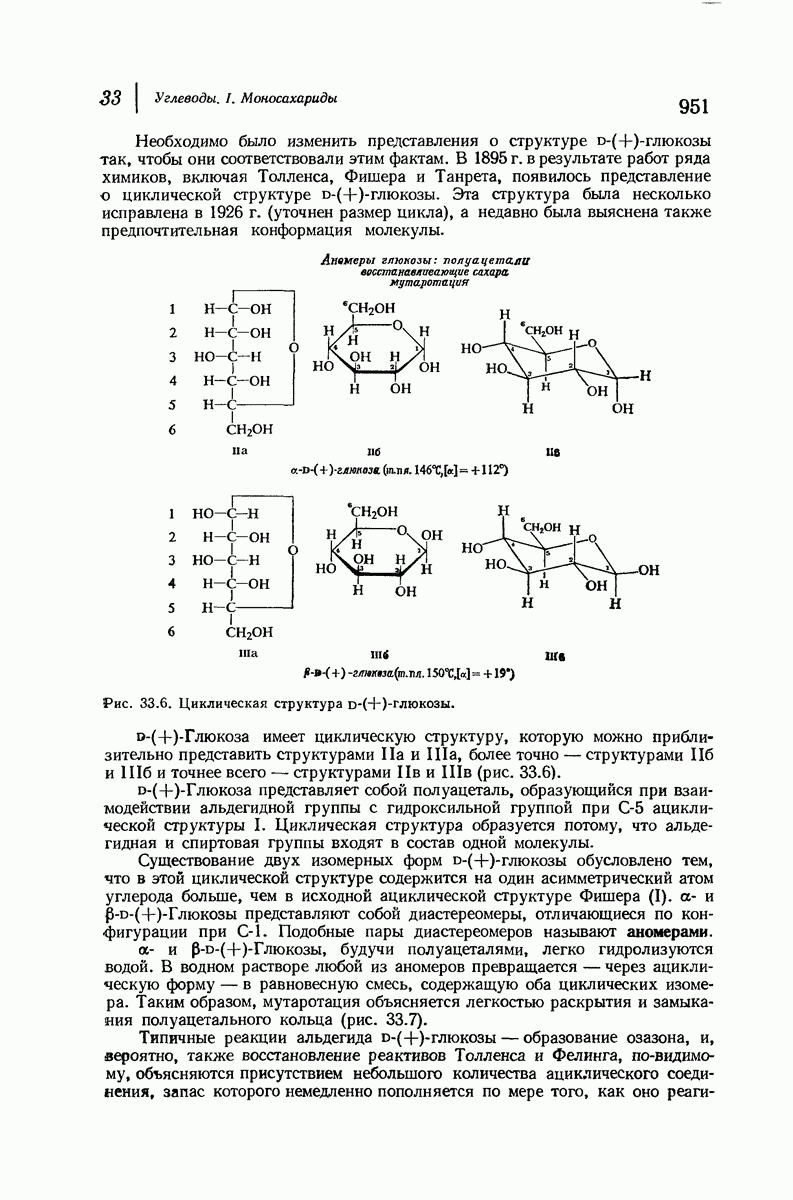
- 33.14. Циклическая структура D-(+)-глюкозы. Образование глюкозидов
- 38.15. Конфигурация при С-1
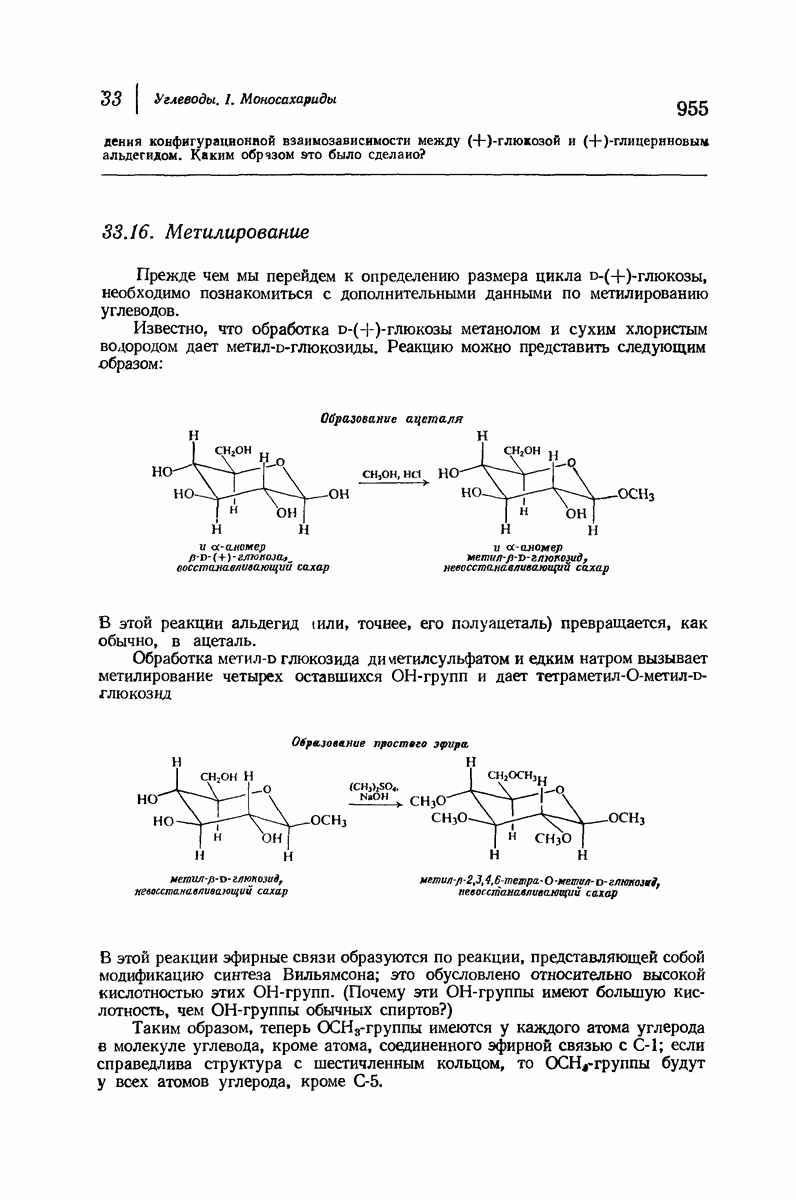
- 33.16. Метилирование
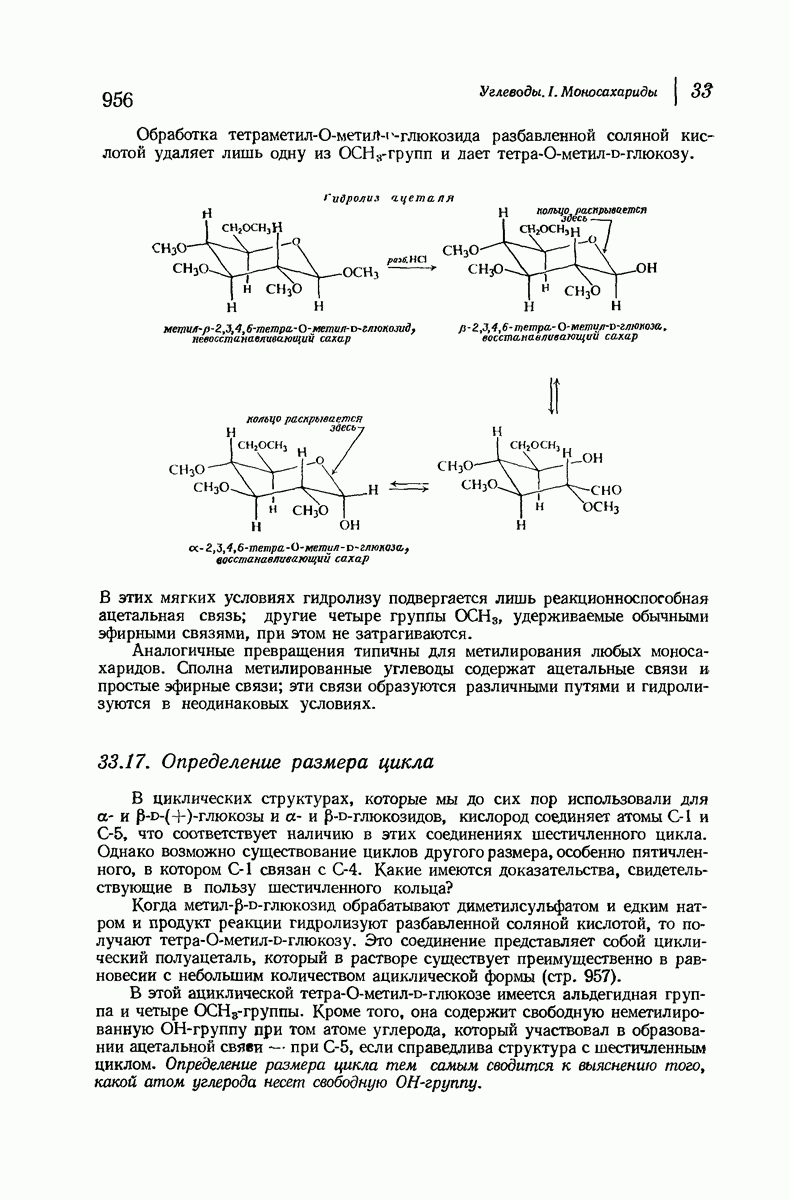
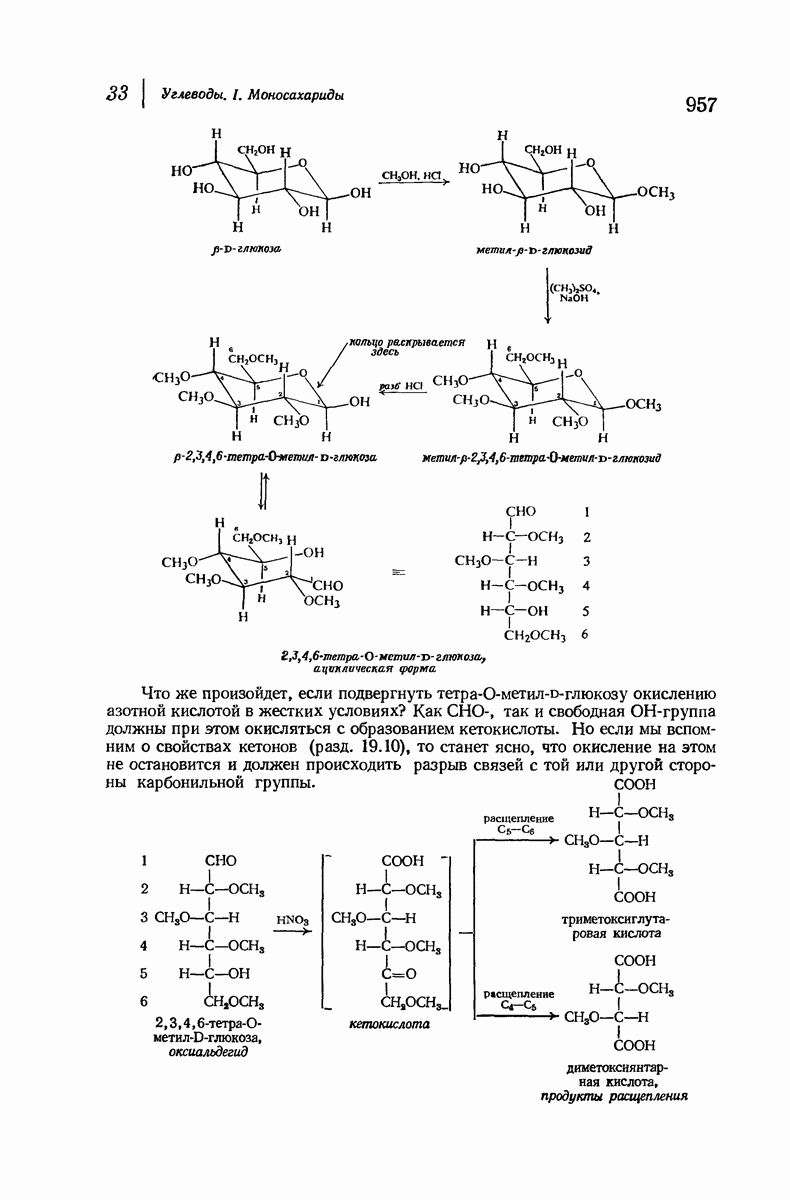
- 33.17. Определение размера цикла
- 33.18. Конформация
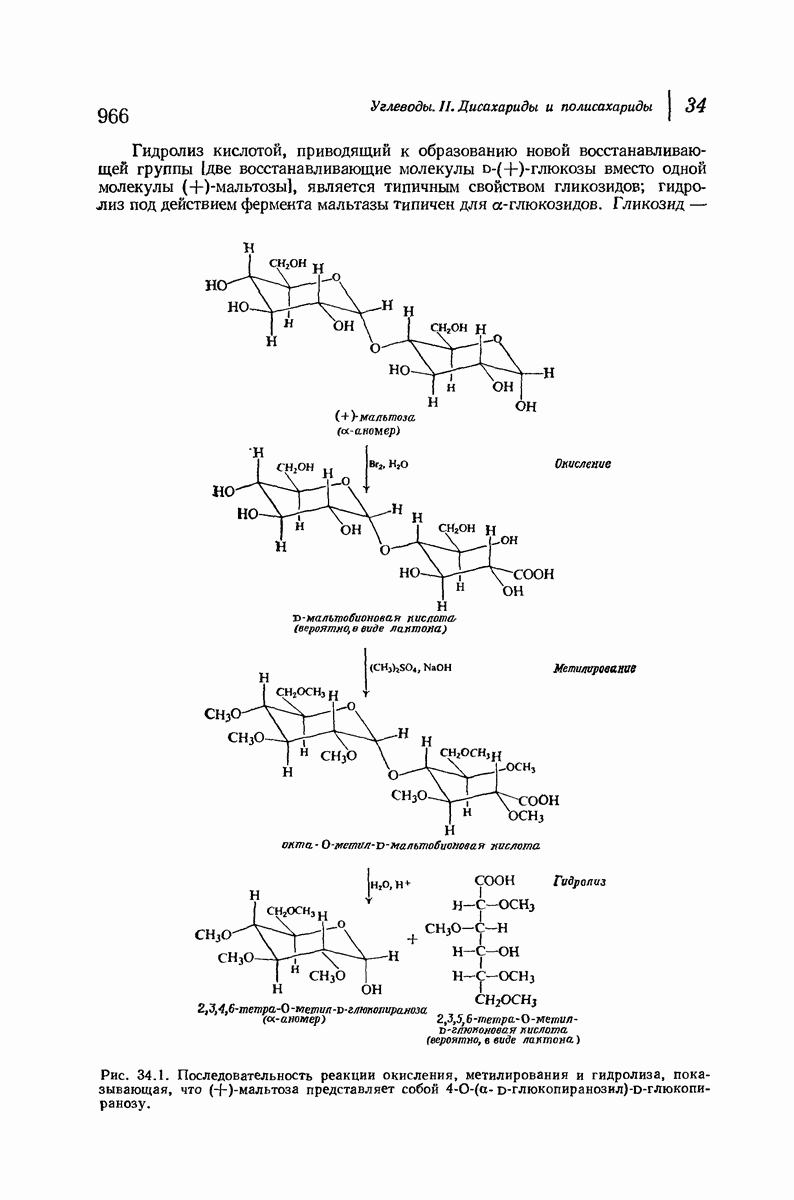
- 34. Углеводы. II. Дисахариды и полисахариды
- 34.3. (+)-Целлобиоза
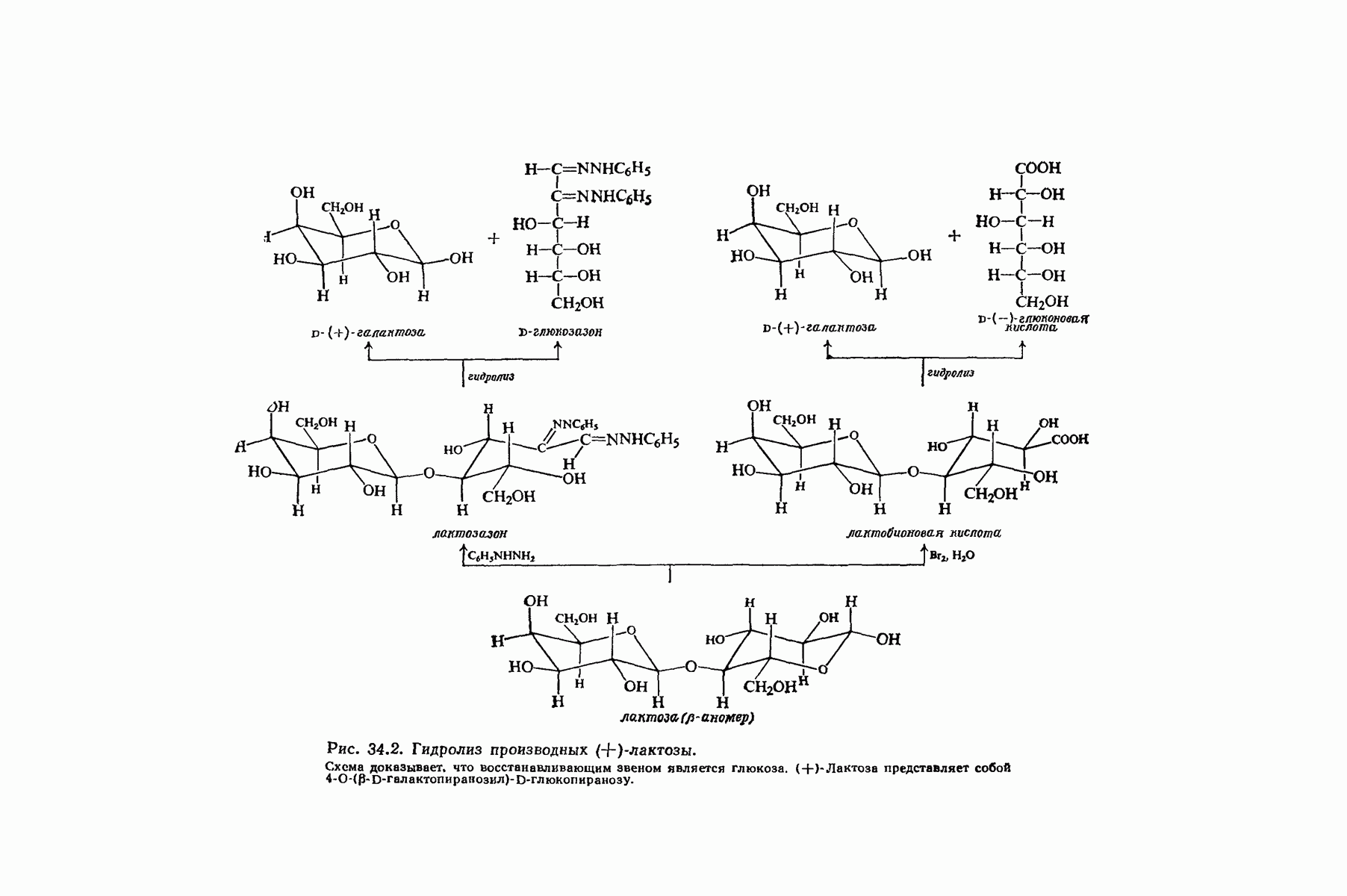
- 34.4. (+)-Лактоза
- 34.4. (+)-Сахароза
- 34.6. Полисахариды
- 34.7. Крахмал
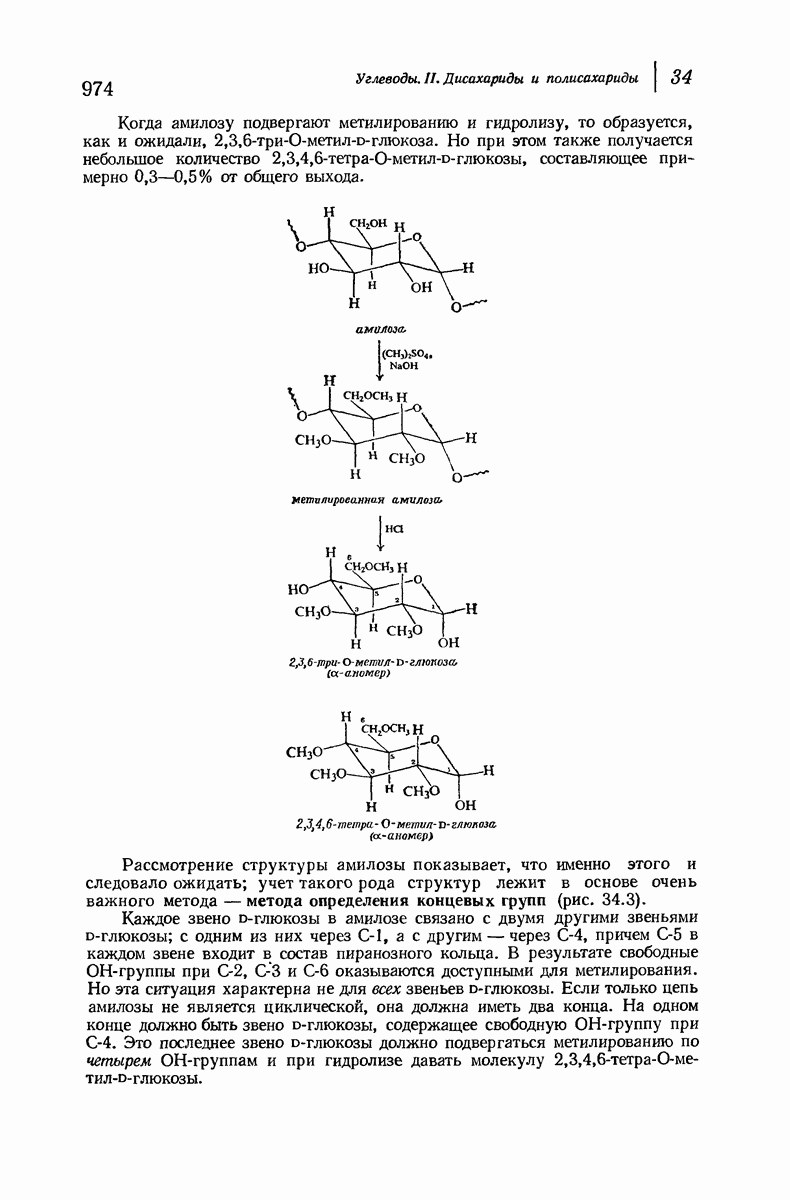
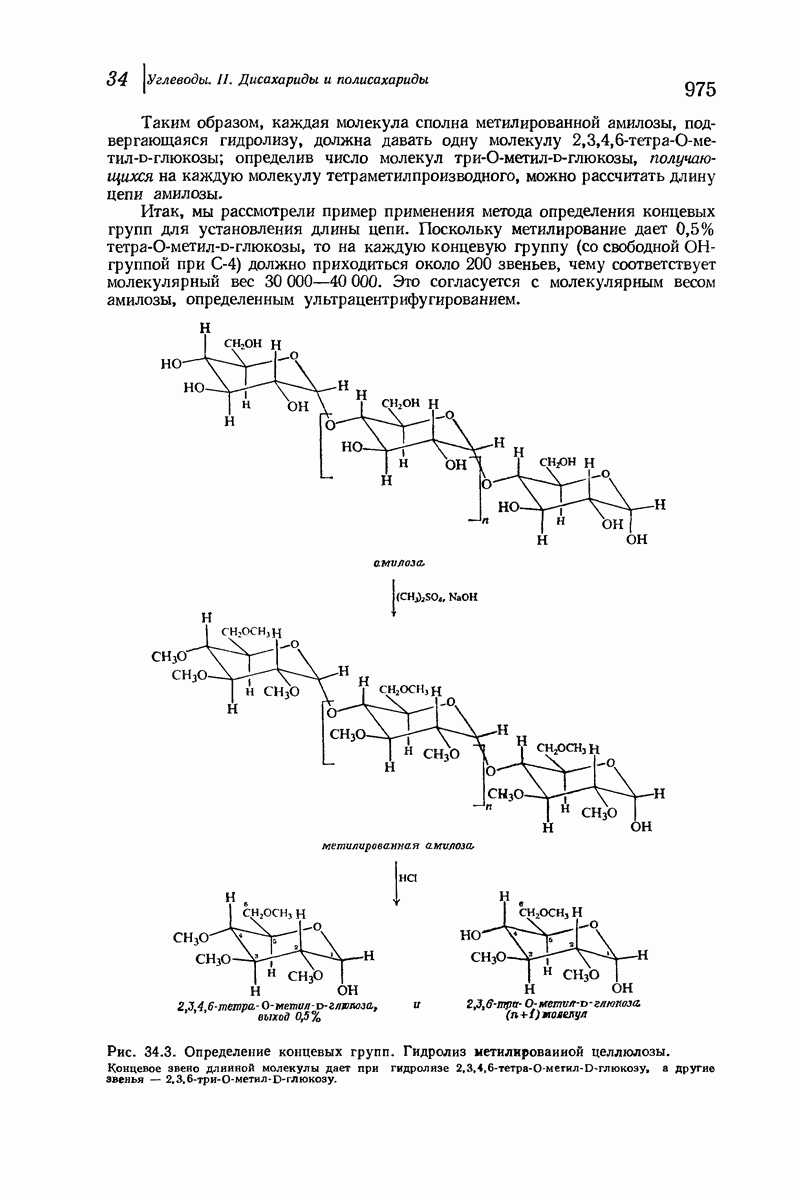
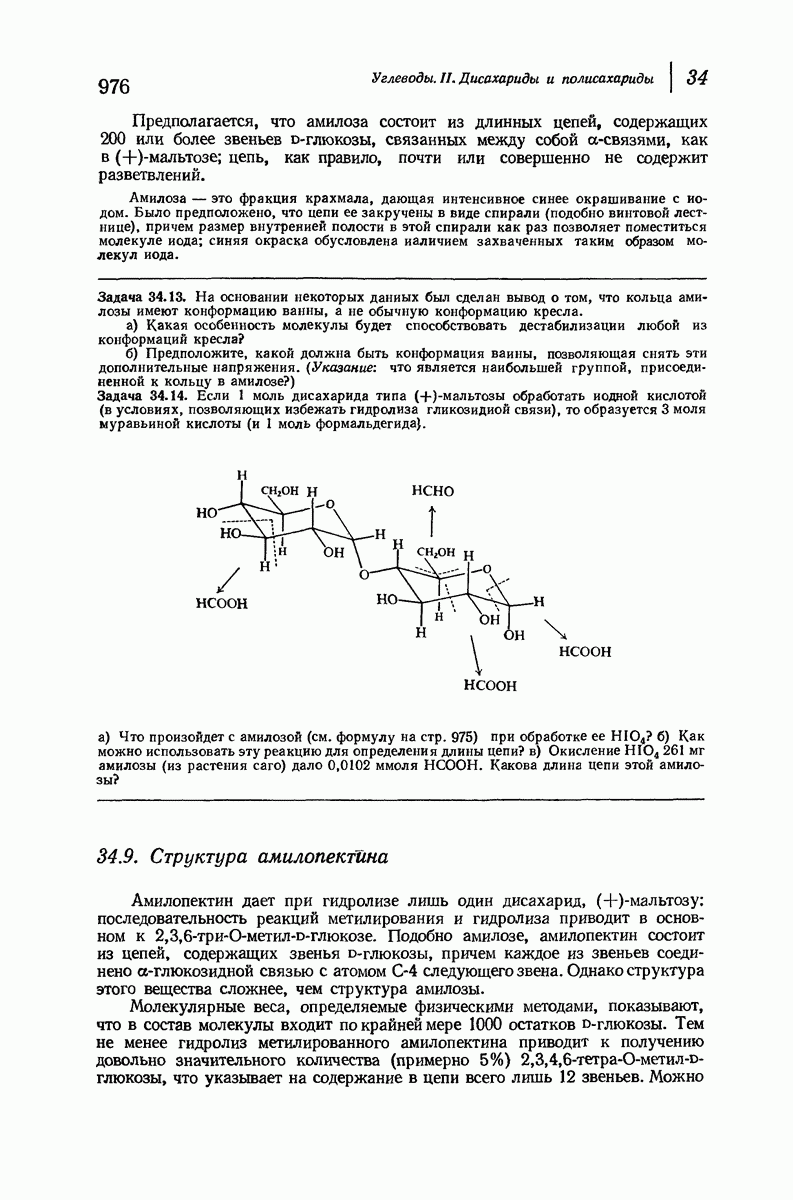
- 34.8. Структура амилозы. Определение концевых групп
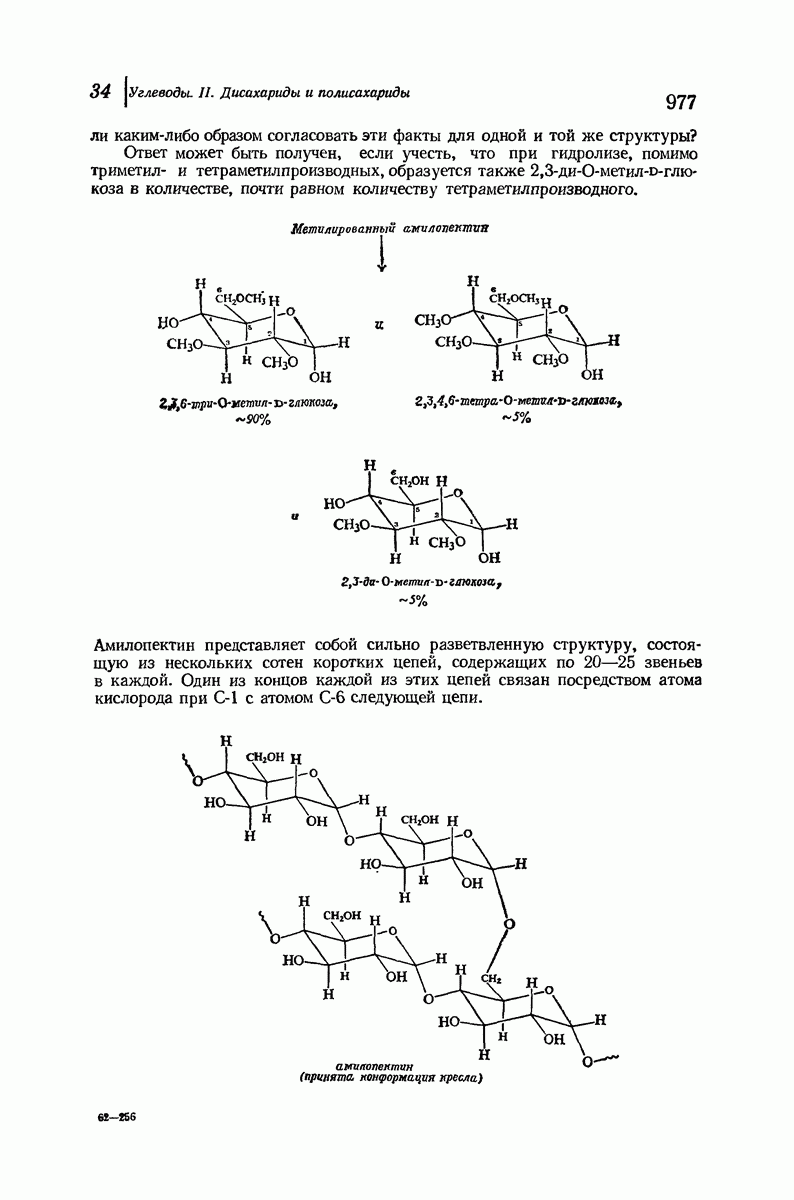
- 34.9. Структура амилопектина
- 34.10. Структура целлюлозы
- 34.11. Реакции целлюлозы
- 34.12. Нитрат целлюлозы
- 34.13. Ацетат целлюлозы
- 34.14. Искусственный шелк. Целлофан
- 34.15. Простые эфиры целлюлозы
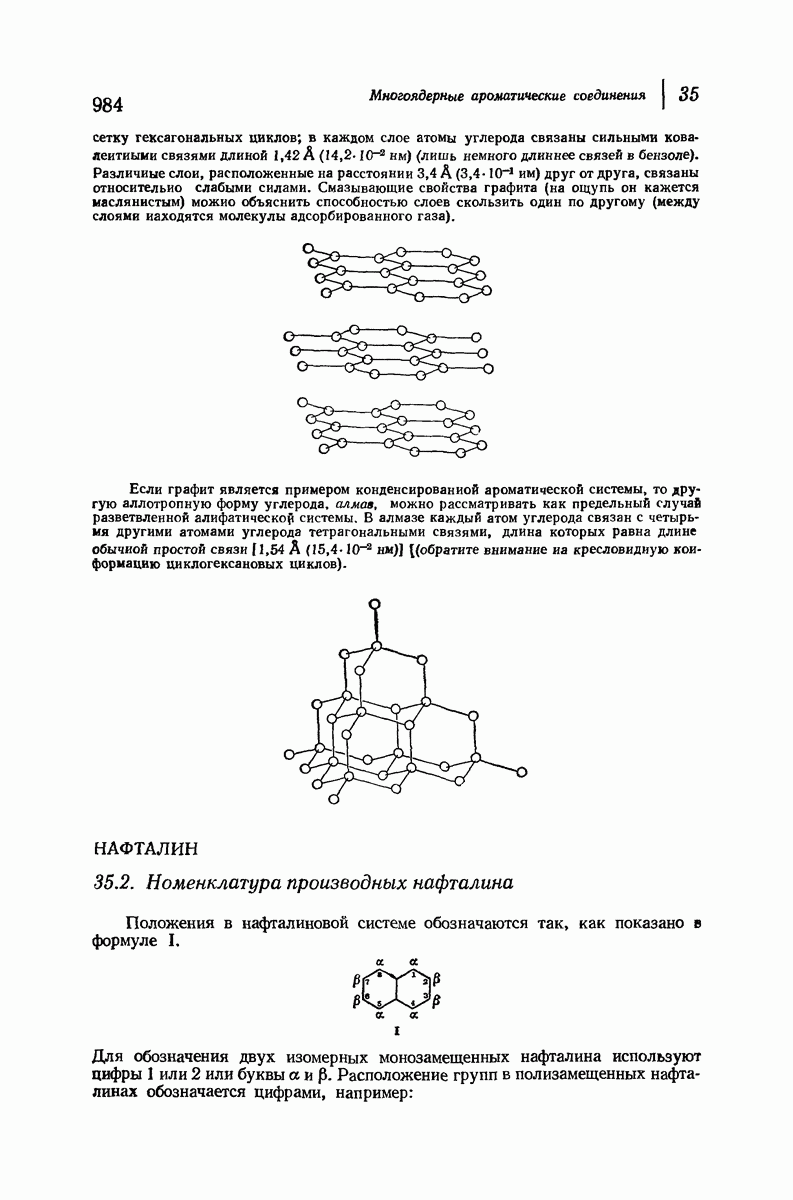
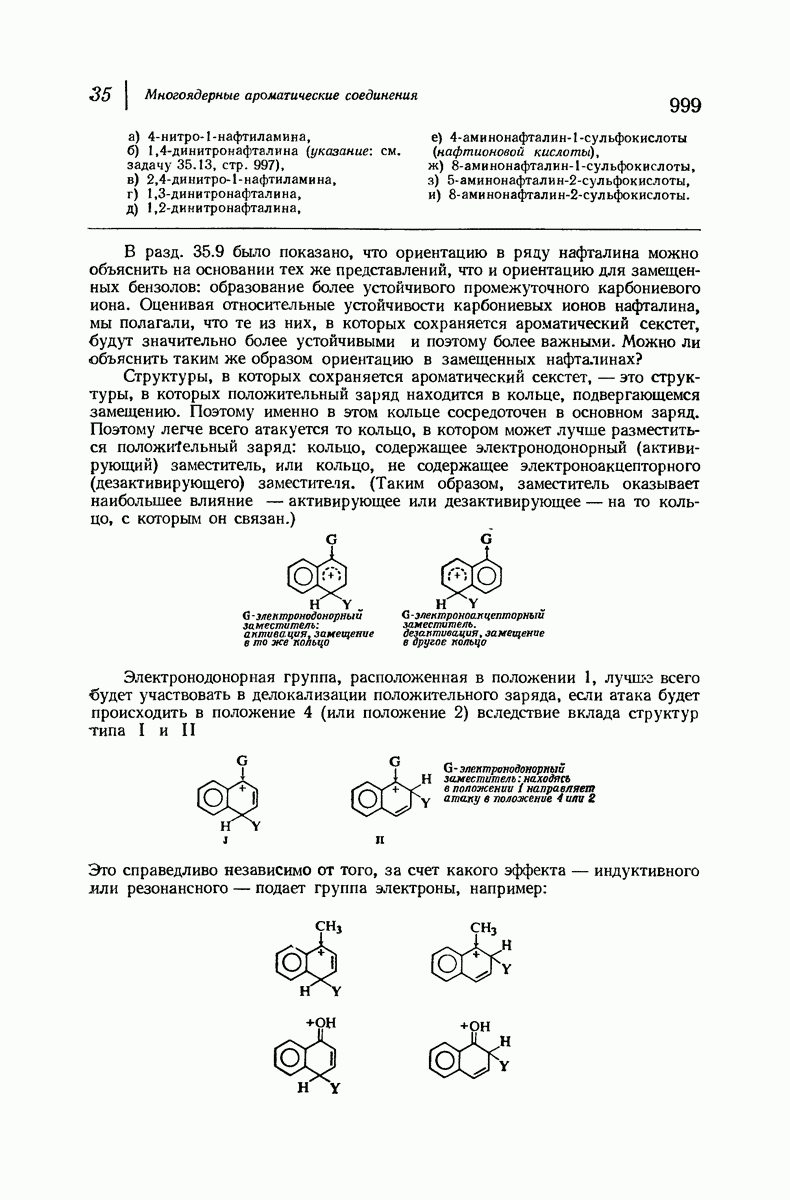
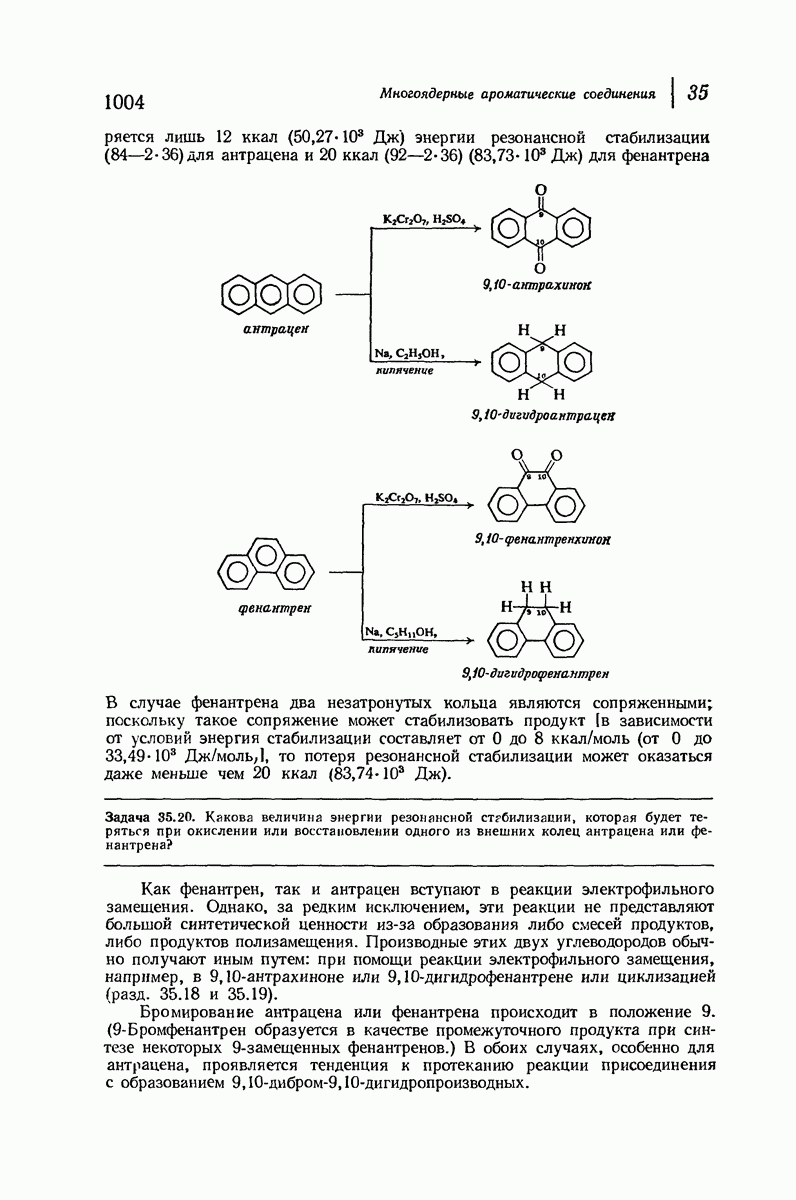
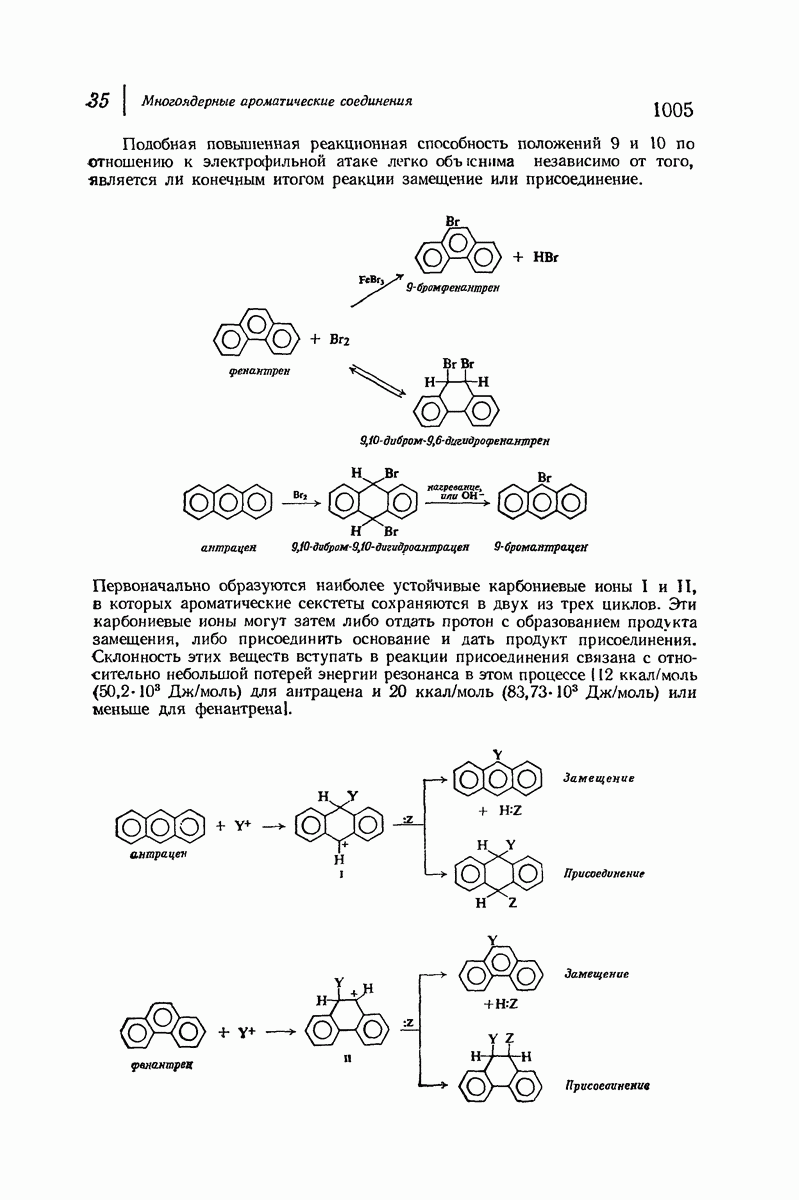
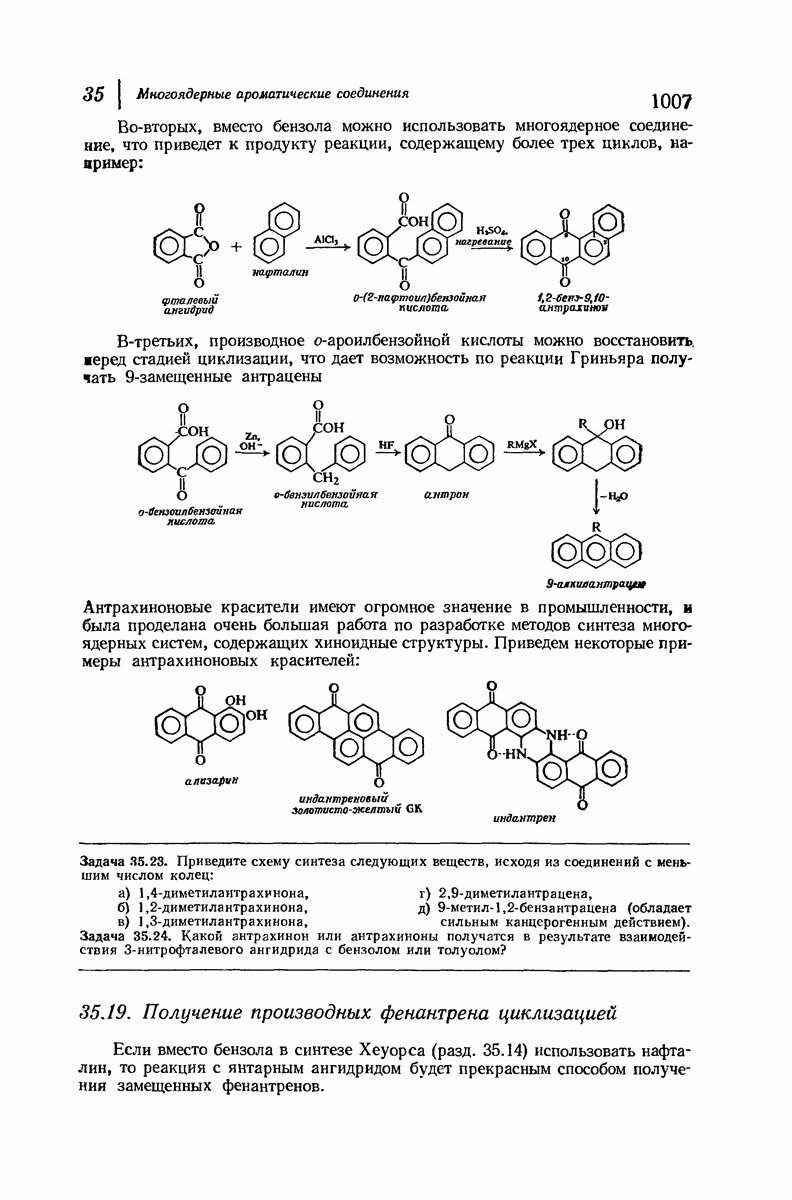
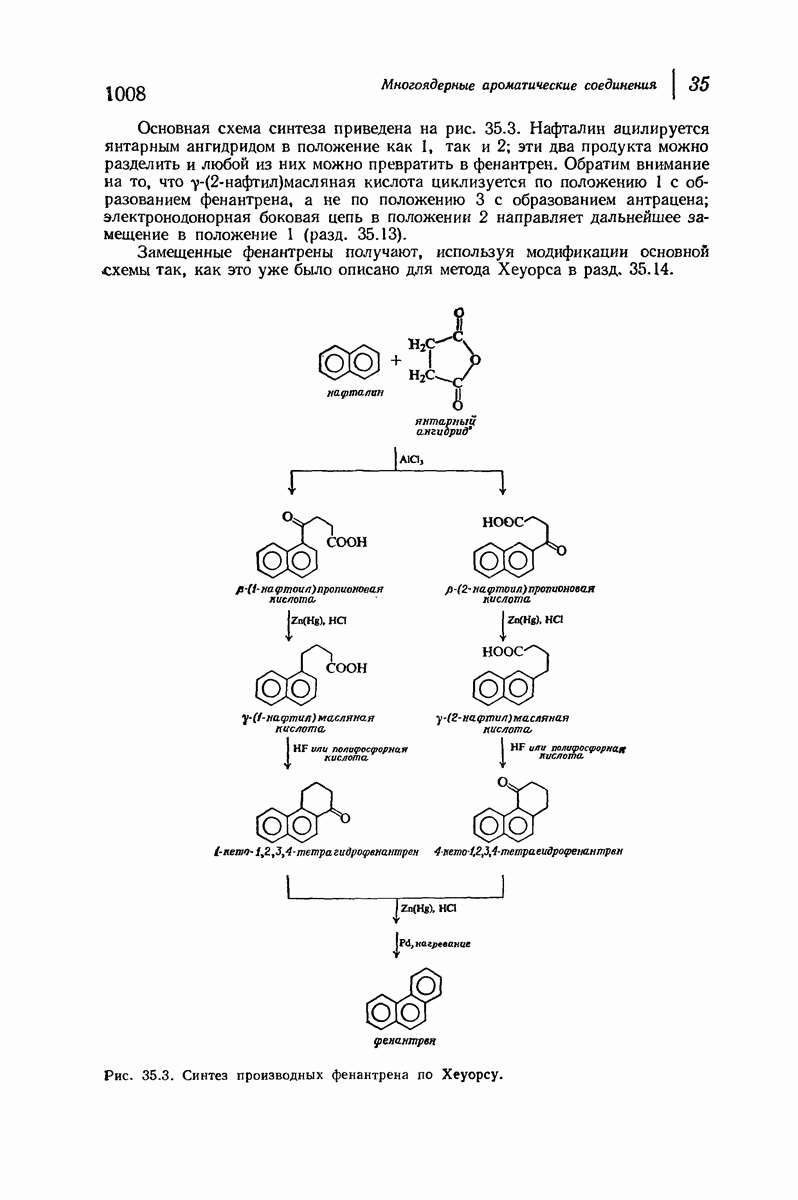
- 35. Многоядерные ароматические соединения
- НАФТАЛИН
- 35.2. Номенклатура производных нафталина
- 35.3. Структура нафталина
- 35.4. Реакции нафталина
- 35.5. Окисление нафталина
- 35.6. Восстановление нафталина
- 35.7. Дегидрирование гидроароматических соединений. Ароматизация
- 35.8. Нитрование и галогенирование нафталина
- 35.9. Ориентация электрофильного замещения в нафталине
- 35.10. Ацилирование нафталина по Фриделю-Крафтсу
- 35.11. Сульфирование нафталина
- 35.12. Нафтолы
- 35.13. Ориентация в реакциях электрофильного замещения производных нафталина
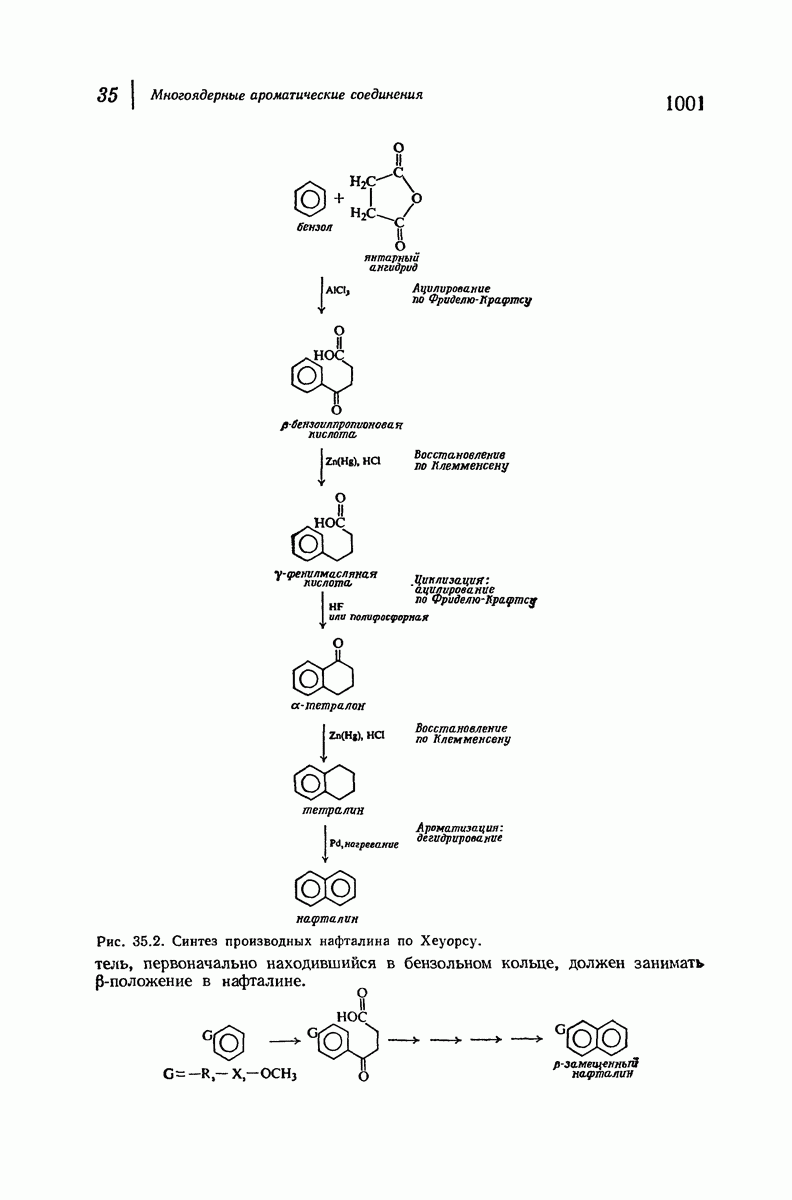
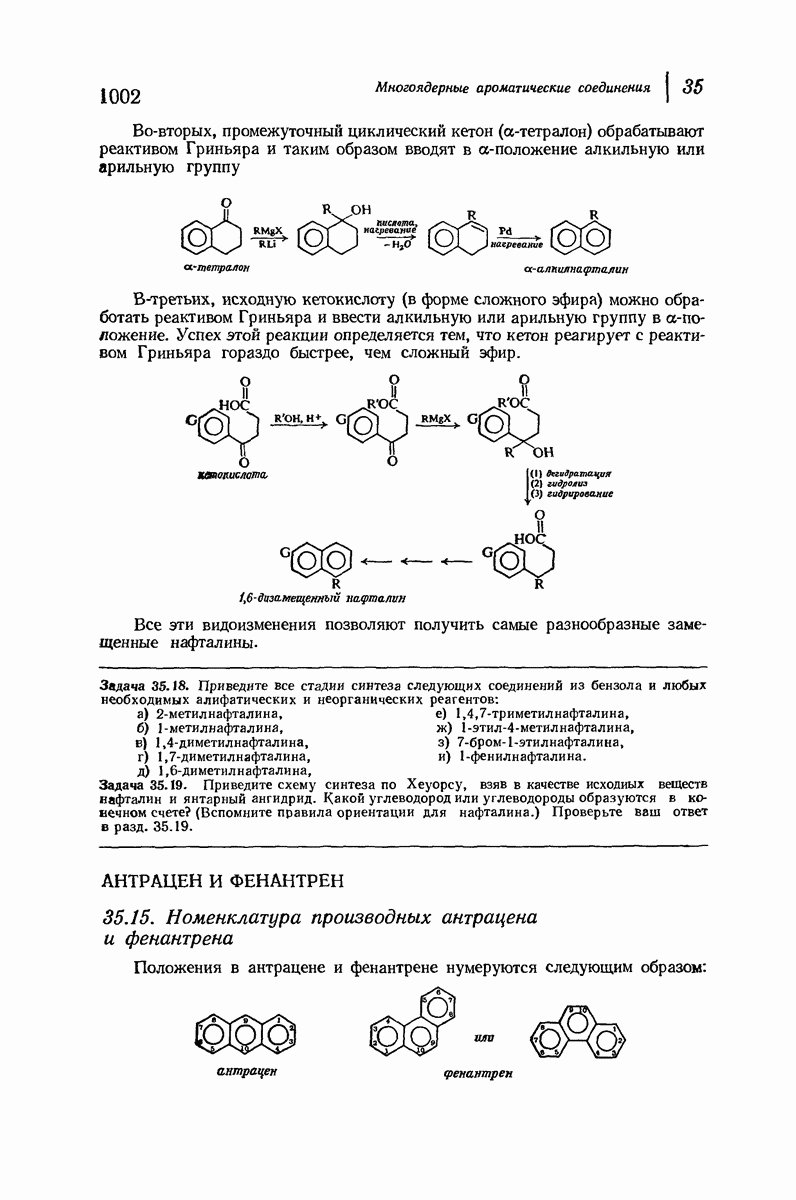
- 35.14. Синтез производных нафталина циклизацией. Синтез Хеуорса
- АНТРАЦЕН И ФЕНАНТРЕН
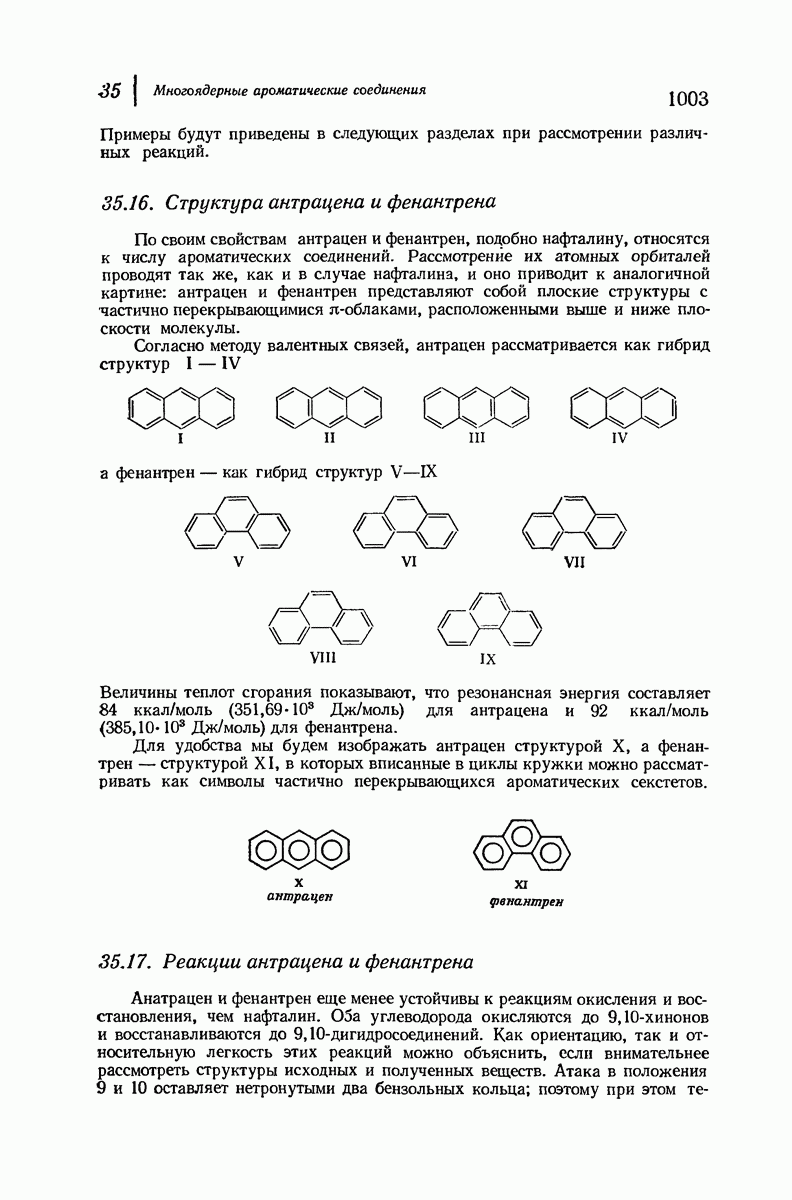
- 35.15. Номенклатура производных антрацена и фенантрена
- 35.18. Получение антрацена циклизацией. Антрахиноны
- 35.19. Получение производных фенантрена циклизацией
- 35.20. Канцерогенные углеводороды
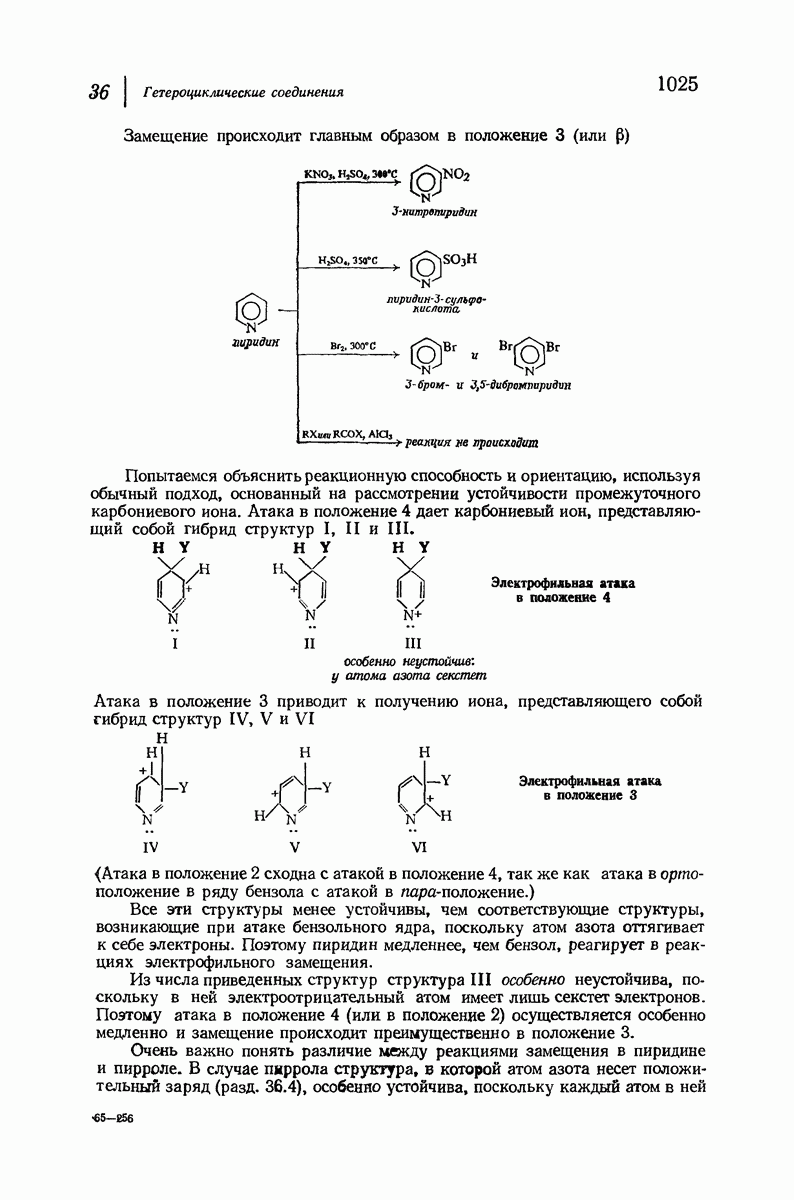
- 36. Гетероциклические соединения
- ПЯТИЧЛЕННЫЕ ЦИКЛЫ
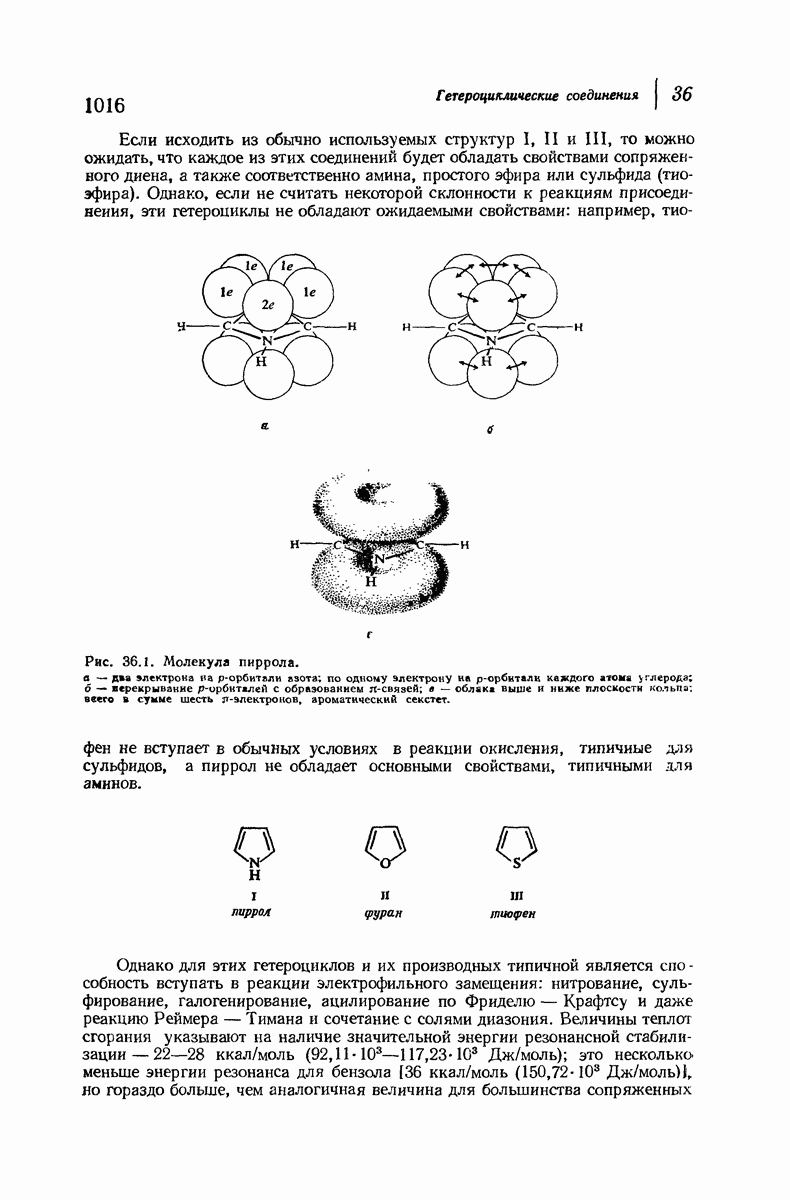
- 36.2. Структура пиррола, фурана и тиофена
- 36.3. Источники получения пиррола, фурана и тиофена
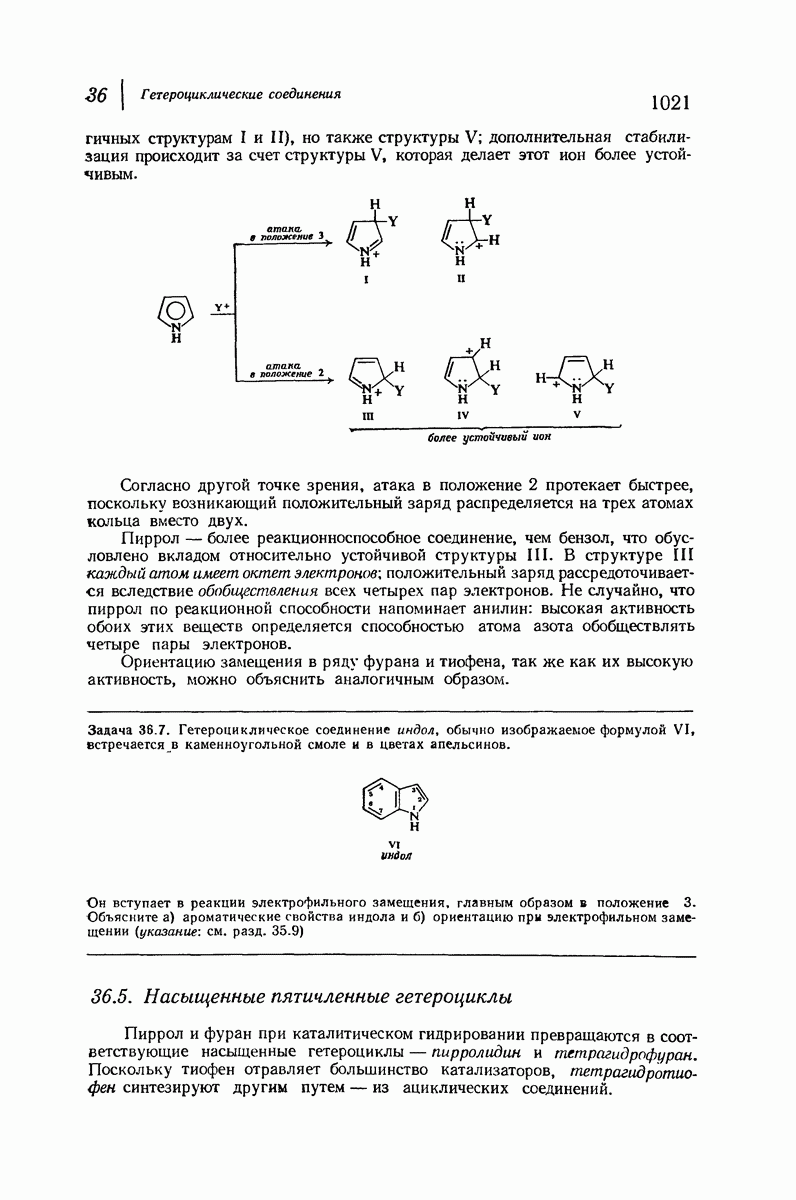
- 36.4. Электрофильное замещение в пирроле, фуране и тиофене. Реакционная способность и ориентация
- 36.5. Насыщенные пятичленные гетероциклы
- ШЕСТИЧЛЕННЫЕ ЦИКЛЫ
- 36.6. Структура пиридина
- 36.10. Нуклеофильное замещение в пиридине
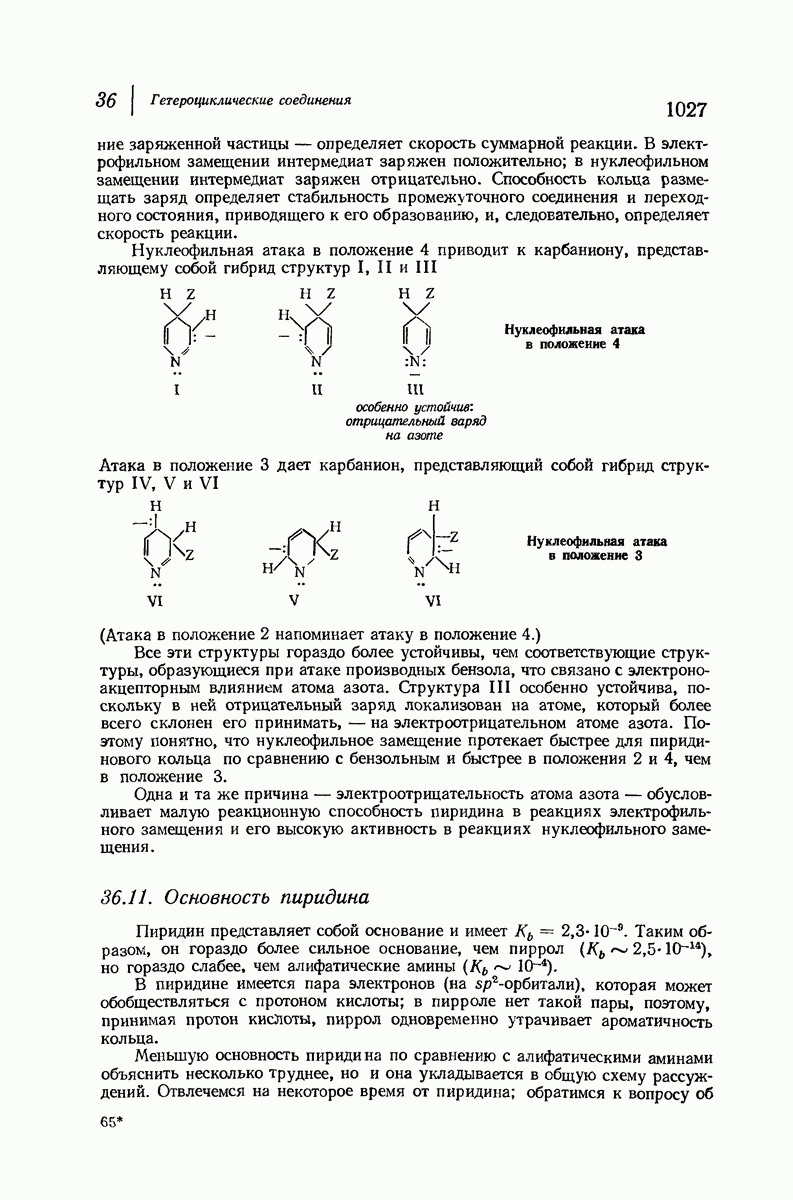
- 36.11. Основность пиридина
- 36.12. Восстановление пиридина
- КОНДЕНСИРОВАННЫЕ КОЛЬЦА
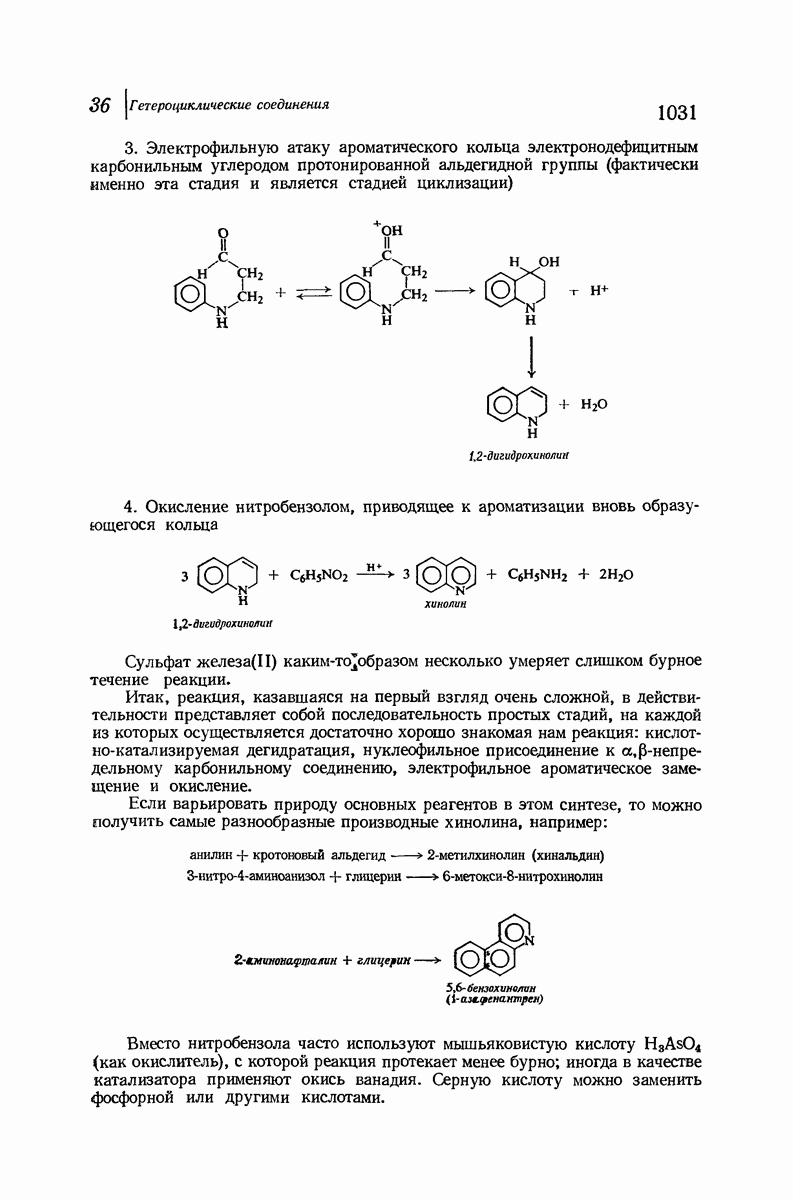
- 36.13. Хинолин. Синтез Скраупа
- 36.14. Изохинолин. Синтез Бишлера — Напиральского
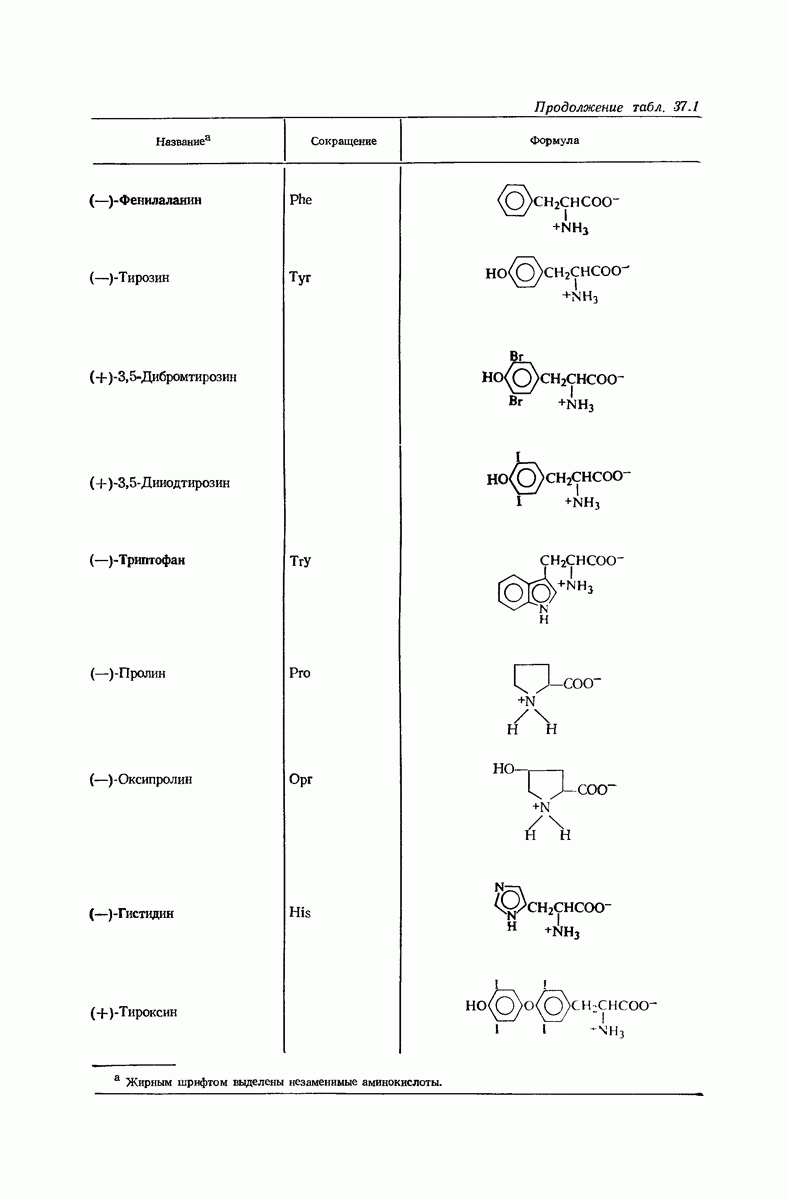
- 37. Аминокислоты и белки
- 37.3. Аминокислоты как биполярные ионы
- 37.4. Изоэлектрическая точка аминокислот
- 37.5. Конфигурация природных аминокислот
- 37.6. Синтез аминокислот
- 37.7. Реакции аминокислот
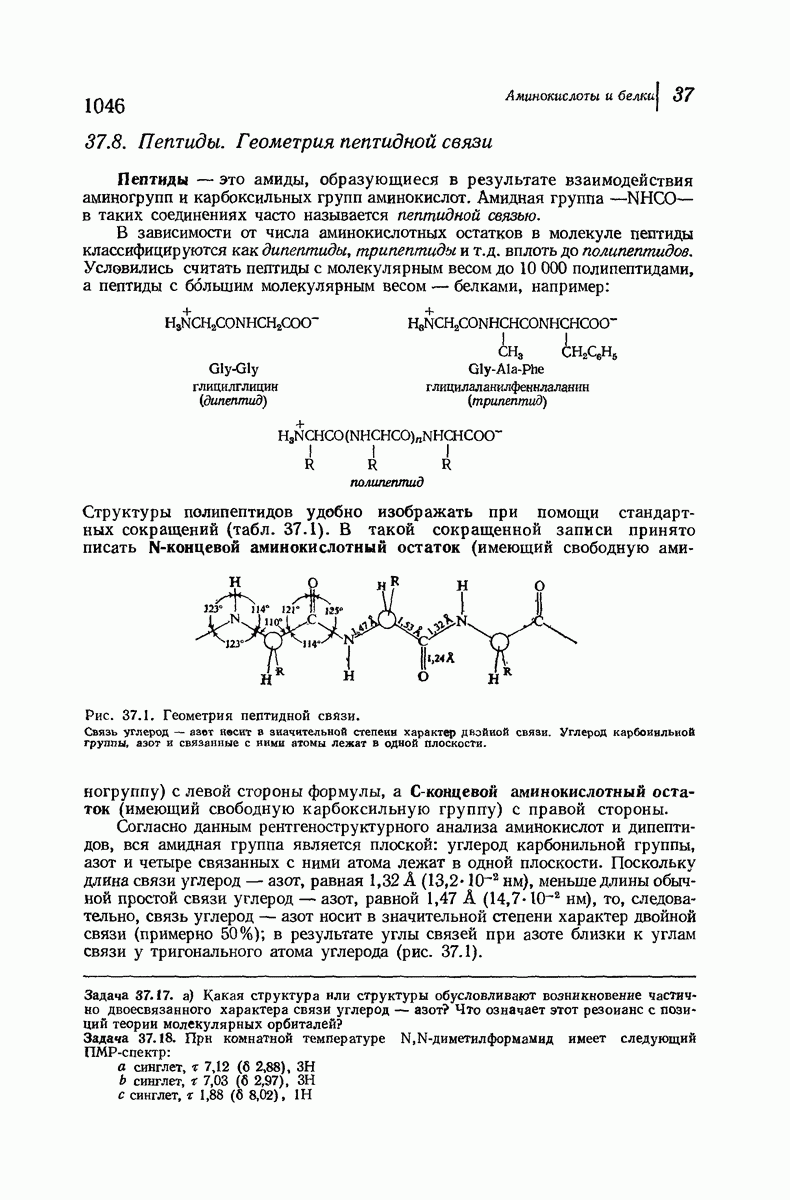
- 37.8. Пептиды. Геометрия пептидной связи
- 37.9. Определение структуры пептидов. Определение концевых групп. Частичный гидролиз
- 37.10. Синтез пептидов
- 37.11. Белки. Классификация и функция. Денатурация
- 37.12. Структура белков
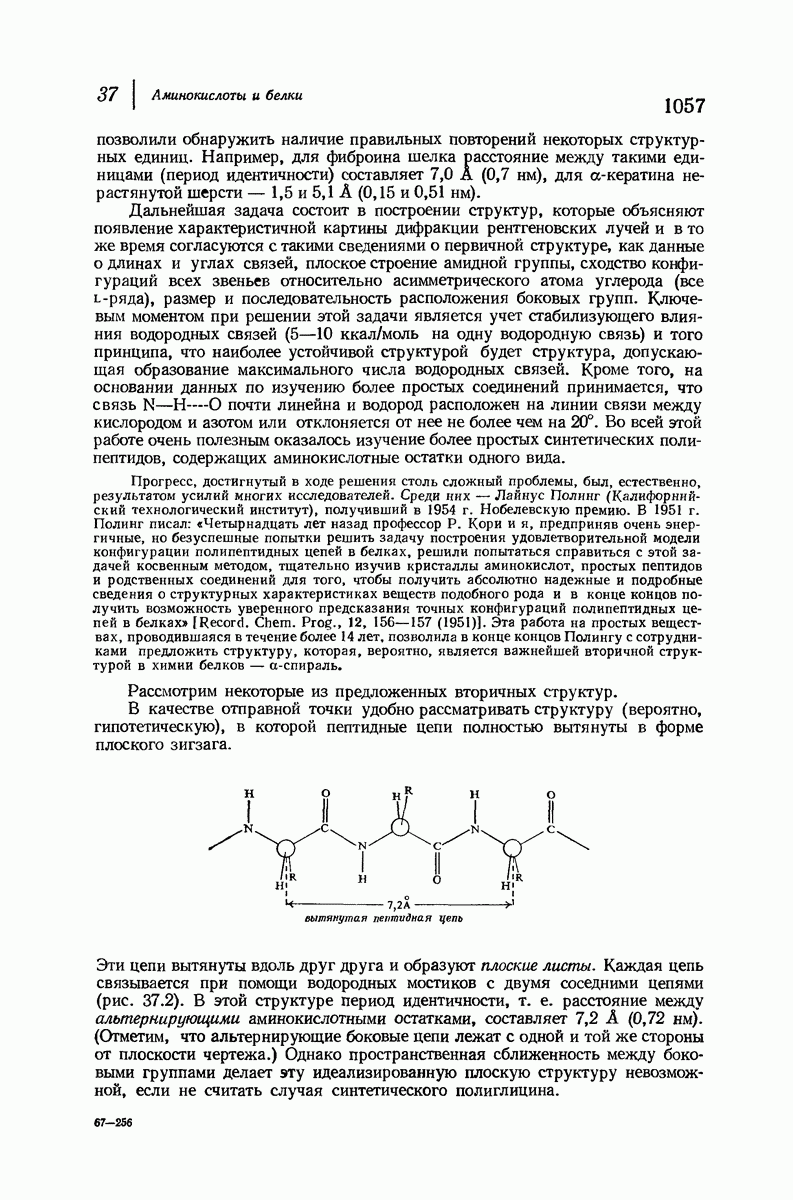
- 37.13. Пептидная цепь
- 37.14. Боковые цепи. Изоэлектрическая точка. Электрофорез
- 37.15. Сложные белки. Простетические группы
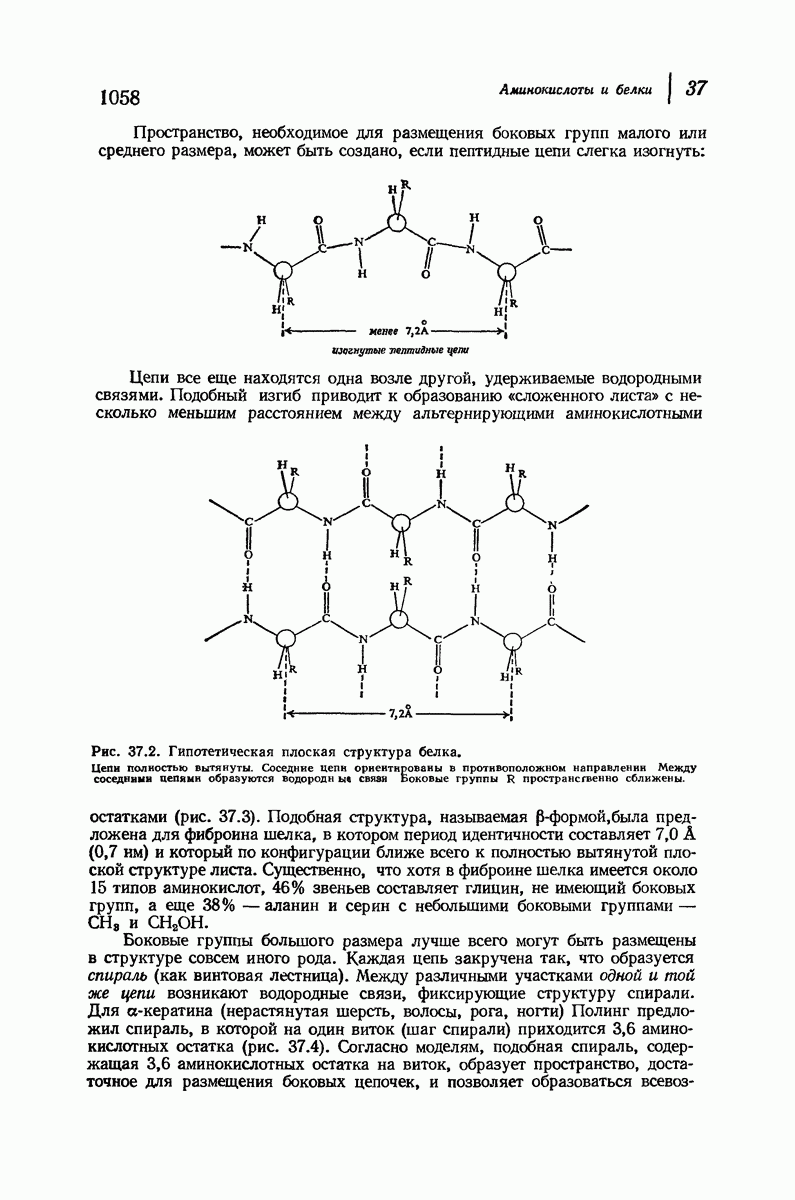
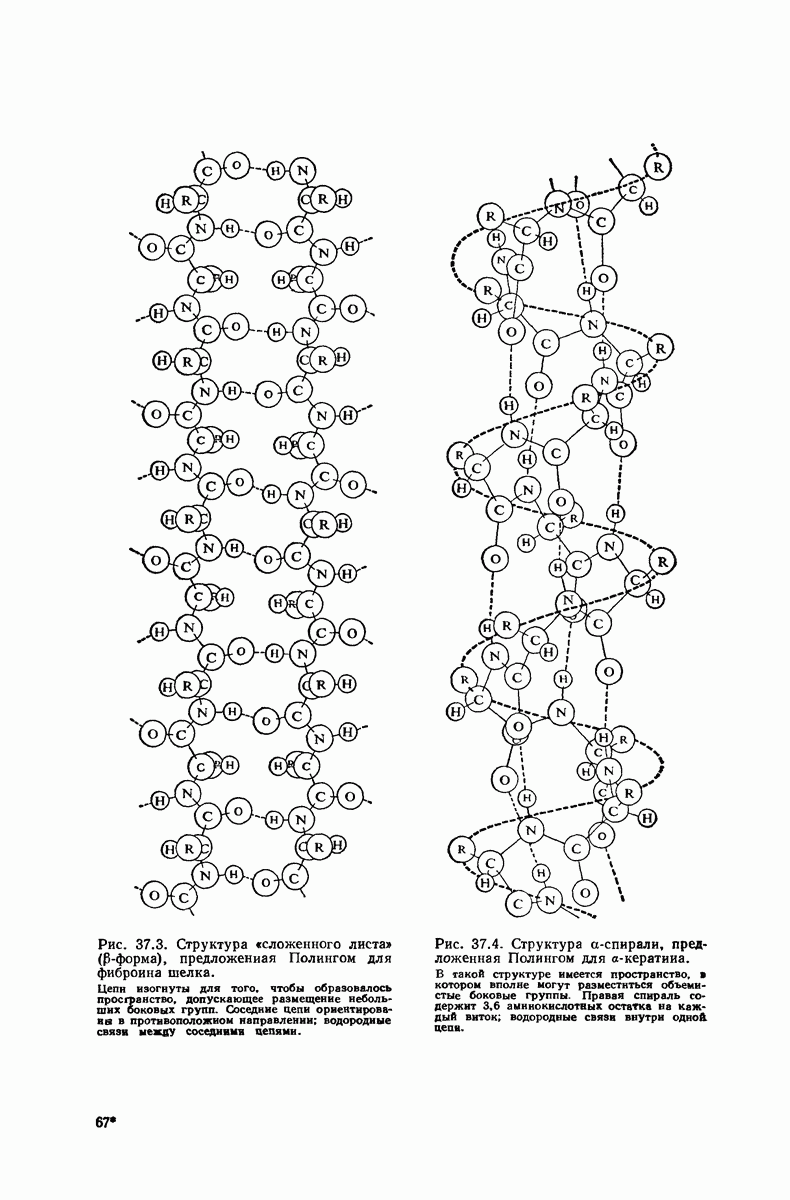
- 37.16. Вторичная структура белков
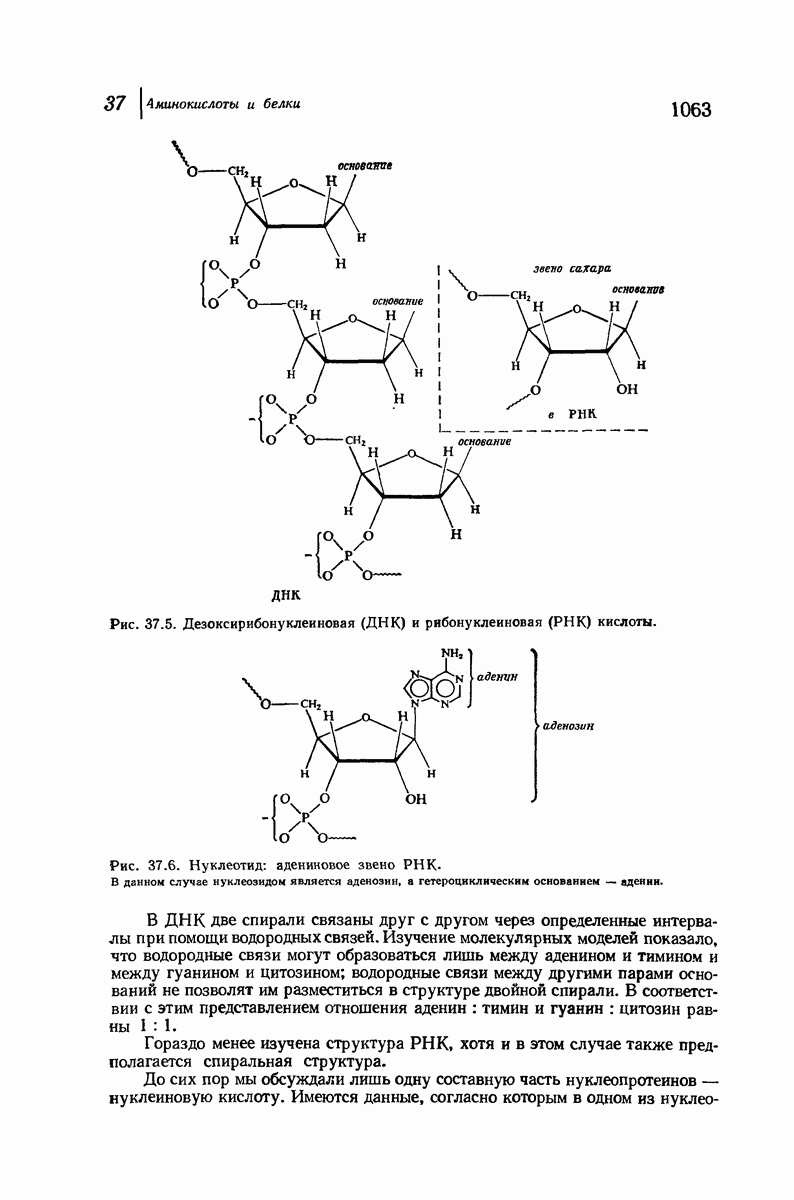
- 37.17. Нуклеопротеиды и нуклеиновые кислоты
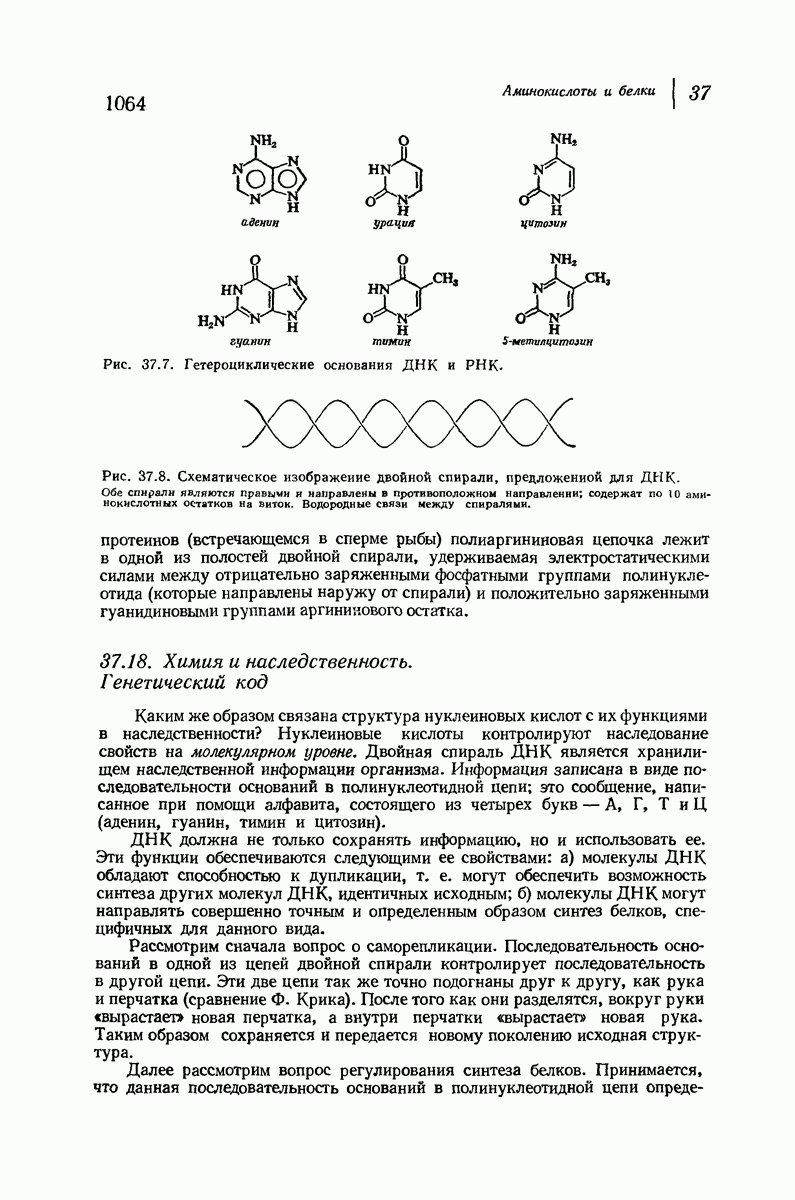
- 37.18. Химия и наследственность. Генетический код
- Список литературы для углубленного изучения